Napsin A 表达与培美曲塞联合铂类二线治疗表皮生长因子受体突变肺腺癌患者疗效和预后的关系△
程兰兰,陈君平,吕东来,徐军#
解放军联勤保障部队第九〇一医院1病理科,2肿瘤一科,合肥 230031
表皮生长因子受体(epidermal growth factor receptor,EGFR)-酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)已成为EGFR突变的晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者一线治疗的首选药物,但大量患者表现出原发性或获得性耐药和肿瘤进展。培美曲塞联合铂类方案化疗仍是目前临床应对EGFR-TKI 治疗失败患者的常用治疗手段,探索能有效预测二线化疗疗效的分子标志物可为临床制订个体化治疗方案提供参考。Napsin A是目前诊断肺腺癌最常用的标志物之一,也是早期肺癌手术切除后的预后评估指标[1-3]。研究报道,接受培美曲塞化疗的NSCLC中NapsinA基因表达与胸苷酸合成酶(thymidylate synthase,TS)水平和患者预后相关[4],TS 是培美曲塞的靶酶,其表达情况与培美曲塞的疗效密切相关。本研究探讨Napsin A 表达与培美曲塞联合铂类方案二线治疗NSCLC 患者疗效及预后的关系。
1 资料与方法
1.1 一般资料
选取2018 年1 月至2021 年6 月解放军联勤保障部队第九〇一医院收治的肺癌患者。纳入标准:①组织学分型为肺腺癌;②临床分期为ⅢB~Ⅳ期;③EGFR突变阳性且一线接受EGFR-TKI 治疗后进展;④年龄≥18 岁;⑤有耐药后二次活检EGFR、Kirsten 鼠肉瘤病毒癌基因同源物(Kirsten rat sarcoma viral oncogene homolog,KRAS)、肿瘤蛋白p53(tumor protein p53,TP53)和T790M 基因突变检测结果,且有足够可用的组织用于免疫组化检测;⑥后续至少接受2 个周期培美曲塞联合铂类化疗。排除标准:①肝肾功能、血常规及心电图异常;②既往接受过培美曲塞或吉西他滨等治疗。依据纳入和排除标准,本研究共纳入64 例肺腺癌患者。本研究经医院伦理委员会批准通过,所有患者均知情同意。
1.2 基因突变检测
所有标本用10%中性福尔马林固定,常规石蜡包埋。应用FFPE 样品DNA 分类试剂盒提取DNA,人类EGFR等多基因突变检测试剂盒均购自厦门艾德生物医药有限公司,详细操作参照试剂盒说明书进行。
1.3 免疫组化染色及结果判定
采用BenchMark-GX 全自动免疫组化仪进行免疫组化染色,采用EnVision 二步法。兔抗人单克隆抗体Napsin A 购自福州迈新公司,用磷酸盐缓冲液(phosphate buffered solution,PBS)代替一抗作为阴性对照,用已知阳性的手术切除肺腺癌组织作为阳性对照。Napsin A 定位于细胞质,使用半定量法来确定免疫组化评分。阳性细胞百分比评分:无阳性细胞为0 分,1%~10%为1 分,11%~50%为2 分,51%~80%为3 分,>80%为4 分;染色强度评分:无染色为0 分,淡黄色为1 分,棕黄色为2 分,棕褐色为3 分。两项评分相乘,总分≥4 分定义为阳性,<4 分定义为阴性。
1.4 疗效评价及预后分析
根据实体瘤疗效评价标准[5]评价疗效,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。客观缓解率(objective response rate,ORR)=(CR+PR)例数/总例数×100%,疾病控制率(disease control rate,DCR)=(CR+PR+SD)例数/总例数×100%。无进展生存期(progression-free survival,PFS)定义为二线治疗开始至疾病进展或尚未出现疾病进展的末次随访时间,总生存期(overall survival,OS)定义为二线治疗开始至因任何原因死亡的时间或末次随访时间。随访截止时间为2022 年12 月31 日。
1.5 统计学方法
采用SPSS 22.0 软件进行统计分析,计数资料以例数及率(%)表示,组间比较采用χ2检验或Fisher确切概率法;采用Kaplan-Meier 法绘制生存曲线,生存情况的比较采用Log-rank 检验;影响因素分析采用Cox 比例风险回归模型;以P<0.05 为差异有统计学意义。
2 结果
2.1 不同临床特征肺腺癌患者肺腺癌组织中Napsin A 表达情况的比较
64 例肺腺癌患者中,EGFR少见突变8 例,其中L861Q 和S768I 共突变2 例,G719X 突变4 例,19del 和L858R 共突变2 例;19del 继发T790M 突变8 例,L858R 继发T790M 突变5 例。Napsin A 在肺腺癌组织中呈细颗粒状着色,阳性表达率为73.4%(47/64)。不同性别、年龄、吸烟史、EGFR突变类型、KRAS状态、TP53状态及继发T790M 突变情况的肺腺癌患者肺腺癌组织中Napsin A 表达情况比较,差异均无统计学意义(P>0.05);国际肺癌研究协会(International Association for the Study of Lung Cancer,IASLC)分级为Ⅰ或Ⅱ级的肺腺癌患者肺腺癌组织中Napsin A 阳性表达率明显高于IASLC分级为Ⅲ级的患者,差异有统计学意义(P<0.01)。(表1)

表1 不同临床特征肺腺癌患者肺腺癌组织中Napsin A 表达情况的比较
2.2 近期疗效分析
64 例EGFR突变肺腺癌患者接受培美曲塞联合铂类二线治疗后,CR 0 例,PR 17 例,SD 39 例,PD 8 例,ORR 为26.6%,DCR 为87.5%。女性患者ORR 高于男性患者,差异有统计学意义(χ2=4.460,P=0.044);Napsin A 阳性患者DCR 明显高于Napsin A 阴性患者,差异有统计学意义(χ2=10.997,P=0.003)。(表2)
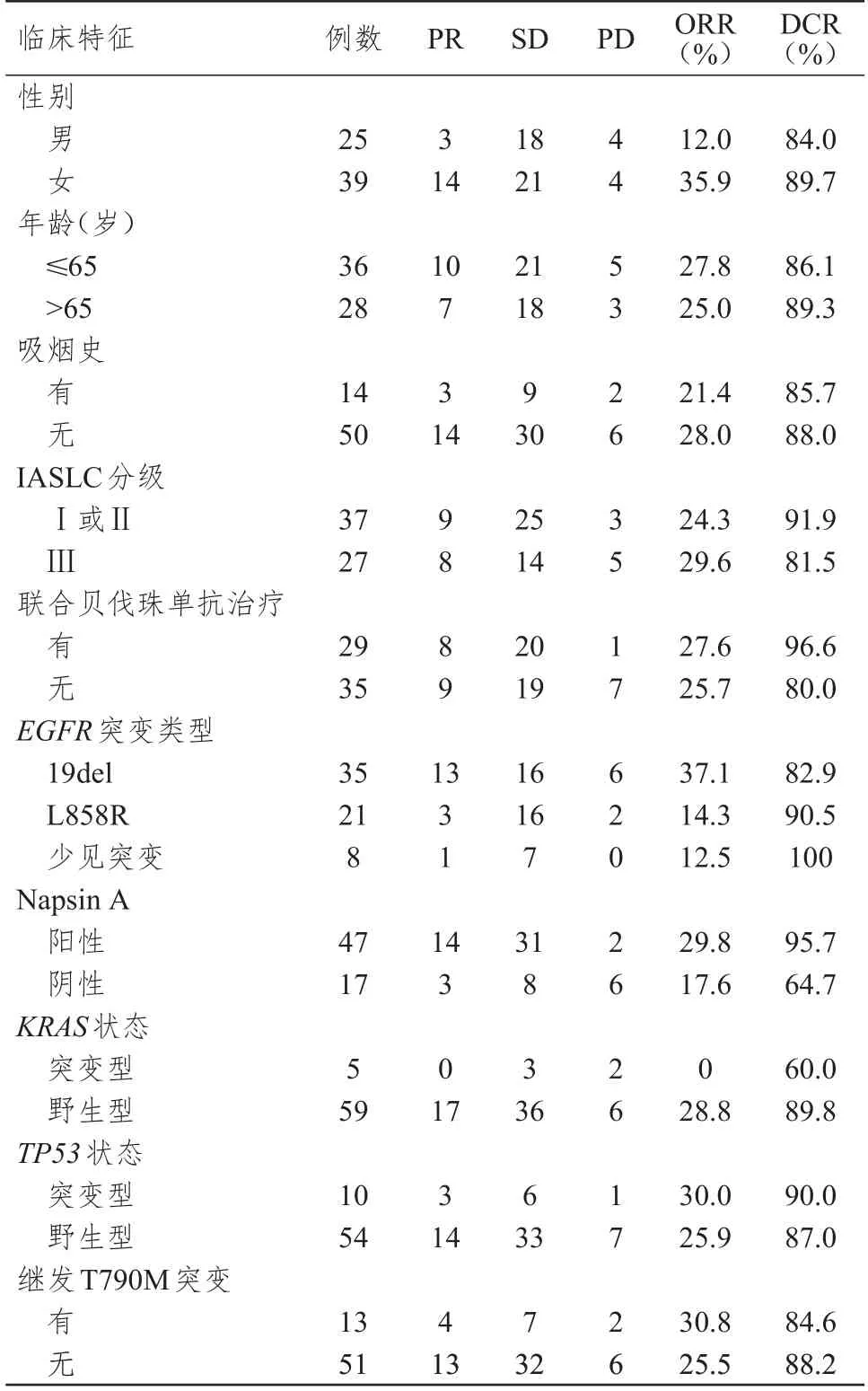
表2 不同临床特征EGFR 突变肺腺癌患者接受培美曲塞联合铂类二线治疗的近期疗效
2.3 二线治疗后PFS 影响因素的单因素分析和多因素分析
单因素及多因素分析结果显示,Napsin A 阳性、联合贝伐珠单抗治疗、无继发T790M 突变均是EGFR突变肺腺癌患者接受培美曲塞联合铂类二线治疗后PFS 的保护因素(表3)。采用Kaplan-Meier 法绘制生存曲线,结果显示,64 例患者中位PFS 为5.0 个月(95%CI:4.120~5.880 个月);Napsin A 阳性、联合贝伐珠单抗治疗、无继发T790M 突变患者的PFS 均优于Napsin A 阴性、未联合贝伐珠单抗治疗、继发T790M 突变患者(P<0.05)(图1)。
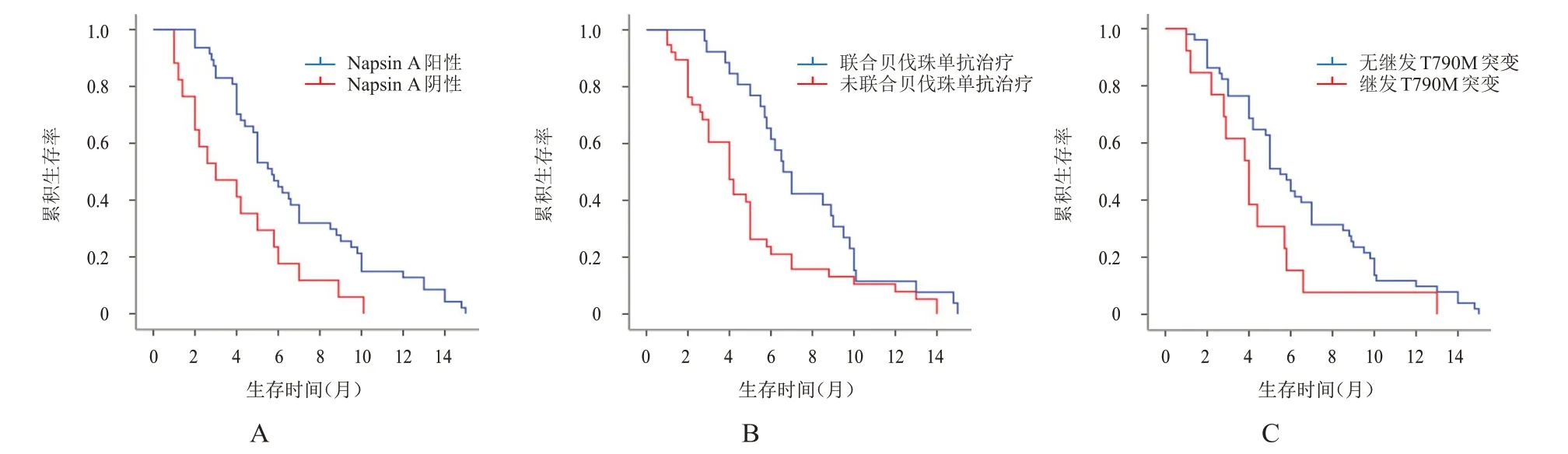
图1 不同临床特征EGFR突变肺腺癌患者接受培美曲塞联合铂类二线治疗后的PFS曲线

表3 EGFR 突变肺腺癌患者接受培美曲塞联合铂类二线治疗后PFS 影响因素的单因素分析和多因素分析
2.4 二线治疗后OS 影响因素的单因素分析和多因素分析
多因素分析结果显示,Napsin A 阳性是EGFR突变肺腺癌患者接受培美曲塞联合铂类二线治疗后OS 的保护因素(表4)。采用Kaplan-Meier 法绘制生存曲线,结果显示,64例患者中位OS为21.0个月(95%CI:15.271~26.729个月);Napsin A阳性患者中位OS 为26.0 个月(95%CI:19.988~32.012 个月),明显优于Napsin A 阴性患者(中位OS 为16.0 个月,95%CI:13.485~18.515个月)(P=0.003)(图2)。

图2 Napsin A阳性(n=47)和Napsin A阴性(n=17)肺腺癌患者的OS曲线
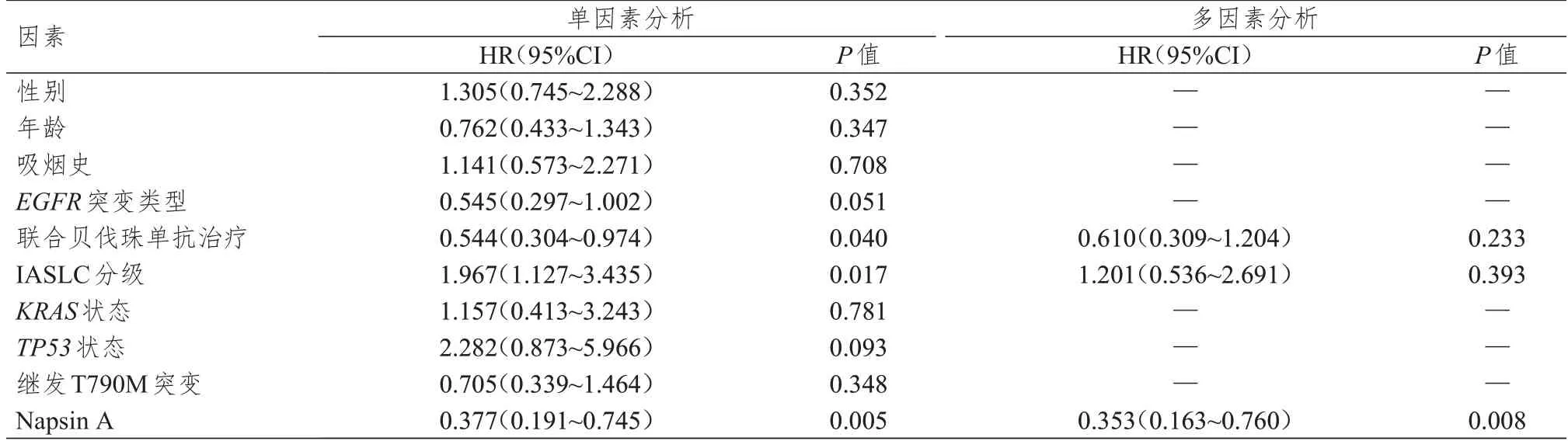
表4 EGFR 突变肺腺癌患者接受培美曲塞联合铂类二线治疗后OS 影响因素的单因素分析和多因素分析
3 讨论
本研究集中探讨EGFR-TKI治疗进展后的培美曲塞联合铂类二线治疗效果,总体ORR 为26.6%,与Zhong 等[6](30.9%)、Masuda 等[7](23.0%)和Jiang等[8](27.0%)报道相近;中位PFS 为5.0 个月,与Han等[9](5.09 个月)、Masuda 等[7](5.1 个月)的结果相近,略高于Zhong 等[6](4.5 个月)报道;中位OS 为21.0 个月,与郑宣轩等[10](20.4 个月)的结果相近,但比Masuda 等[7](17.8 个月)报道的略长。出现这些差异的可能原因:一是样本量差异;二是本研究及Masuda等[7]的研究均入组了部分联合贝伐珠单抗治疗的患者,一定程度上能有效延长PFS 和OS;三是入组患者中19del突变比L858R突变的比例略高,以往研究表明19del突变患者的OS优于L858R突变患者[11],本研究结果也显示19del 趋向于是患者OS的独立保护因素,但差异无统计学意义(P=0.052)。
本研究分析了二线治疗后患者PFS 和OS 的影响因素。多项研究表明,应用贝伐珠单抗二线及以上治疗晚期肺腺癌疗效显著,EGFR-TKI 和贝伐珠单抗有协同作用,二者有共同的c-met 上游通路[12]。郑宣轩等[10]报道应用贝伐珠单抗联合化疗二线及以上治疗晚期NSCLC 的ORR 为32.2%,PFS 为6.4个月。本研究结果显示,联合贝伐珠单抗治疗患者的ORR 为27.6%,中位PFS 为6.6 个月,均优于未联合贝伐珠单抗治疗患者,联合贝伐珠单抗治疗是二线治疗后患者PFS 的独立保护因素。继发T790M 突变是一代EGFR-TKI 获得性耐药的机制之一,相比于其他原因引起的耐药,T790M 突变患者预后更好[13],但如果在TKI 治疗前伴发T790M 突变则临床反应较差[14]。本研究检测到继发T790M突变13 例(20.3%),远低于文献报道的突变率[13]。主要原因:入组均为TKI 耐药后接受化疗的患者,不能代表整个EGFR突变群体,另有很大一部分T790M 突变患者继续接受二代或三代TKI 治疗而非化疗。结果显示,无继发T790M 突变患者接受二线治疗后PFS 优于继发T790M 突变患者,继发T790M 突变是二线治疗后患者PFS 的独立危险因素,提示这部分患者二线接受化疗疗效有限,可以选择二代或三代TKI 治疗或其他治疗。
Napsin A 是继甲状腺转录因子-1(thyroid transcription factor-1,TTF-1)之后又一个在预后中受到关注的肺腺癌标志物[1],常表达于肺腺癌、卵巢透明细胞癌、肾细胞癌、甲状腺癌等[15-16],是判断早期手术切除的肺腺癌患者预后的标志物[1-3]。Lee 等[3]单因素分析显示,TTF-1 阳性患者预后较好,但差异无统计学意义(P=0.096);多因素分析显示,无论TNM 分期如何,Napsin A 是一个比TTF-1 更有利于预后的独立影响因素。研究发现,Napsin A 表达受TTF-1 的调控[1],TTF-1 表达与培美曲塞化疗后患者的PFS 有关[17],但该研究有一定局限性,没有分析OS。基于这些结果,本研究探究了Napsin A对培美曲塞联合铂类二线治疗肺腺癌疗效的预测价值。结果显示,在EGFR突变肺腺癌中Napsin A阳性表达率为73.4%,与文献报道的阳性表达率(70.0%~90.0%)相近。本研究结果显示,Napsin A阳性患者DCR 为95.7%,显著优于阴性患者(64.7%)。单因素和多因素分析结果显示,Napsin A阴性是二线治疗患者PFS 和OS 的独立危险因素,提示临床选择Napsin A 阳性患者接受二线治疗对DCR、PFS、OS 更有利,因此Napsin A 是预测培美曲塞联合铂类方案二线治疗EGFR突变肺腺癌患者疗效和预后的分子标志物。
有关Napsin A 在培美曲塞联合铂类治疗中的作用机制尚不清楚。本研究发现,IASLC 分级为Ⅰ或Ⅱ级的肺腺癌患者肺腺癌组织中Napsin A 阳性表达率明显高于IASLC 分级为Ⅲ级的患者,说明肿瘤分化程度越差就越容易出现Napsin A表达缺失,患者预后越差。研究报道,下调Napsin A可促进转化生长因子-β1(transforming growth factor-β1,TGF-β1)诱导的肺腺癌细胞增殖[17-18]。研究发现,Napsin A 表达水平与厄洛替尼的药物敏感性呈正相关,Napsin A 过表达可抑制TGF-β1 和integrin 信号转导通路诱导的上皮-间充质转化(epithelialmesenchymal transition,EMT)和由EMT 介导的EGFR-TKI 耐药,而EMT 也是培美曲塞化疗的耐药机制之一[19-21]。Napsin A 在培美曲塞联合铂类治疗中的确切作用还需进一步探讨。
本研究尚有不足之处:①病例选择的偏倚不可避免,因为本研究是对当时接受了EGFR检测和培美曲塞化疗患者的数据进行的回顾性分析,而不是研究期间所有患者的结果,数量偏少。②未进行TS 表达量的评估,因此无从判断疗效差异是否与各自的TS 水平差异有关。③根据现有资料,仅观察了EGFR、KRAS、TP53和T790M 基因突变,无法排除其他驱动基因突变对结果的影响。下一步需进行大样本前瞻性研究验证结果。

