骨髓增生异常综合征基因突变特征的临床分析△
安万花,郭淑利,肖蓬莉,王万里,田焕焕,彭靓,杨璞,毛慧云,王慧睿#
1新乡医学院研究生院,河南 新乡 453003
2郑州大学附属洛阳市中心医院血液内科,河南 洛阳 471009
1 资料与方法
1.1 一般资料
收集2015 年1 月至2020 年12 月于郑州大学附属洛阳市中心医院进行二代测序检测的MDS 患者的病历资料。纳入标准:符合MDS 诊断标准[4];进行二代测序检测。排除标准:病历资料不完整。根据纳入、排除标准,共纳入43 例MDS 患者,其中,男26 例,女17 例;年龄55~71 岁,中位年龄65岁;外周血白细胞计数(0.53~19.78)×109/L,中位白细胞计数2.80×109/L;血红蛋白(31~114)g/L,中位血红蛋白68 g/L;中性粒细胞计数(0.15~39.60)×109/L,中位中性粒细胞计数1.30×109/L;血小板计数(6~216)×109/L,中位血小板计数43×109/L;MDS 的诊断与分型[4]:MDS 伴单系病态造血(MDS-SLD)4例,MDS 伴多系病态造血(MDS-MLD)10 例,MDS伴环形铁粒幼细胞伴单系病态造血(MDS-RSSLD)2 例,MDS 伴孤立5q(MDS-5q-)1 例,MDS 伴原始细胞增多Ⅰ型(MDS-EB-1)20 例,MDS 伴原始细胞增多Ⅱ型(MDS-EB-2)5 例,MDS 不能分类型(MDS-U)1 例。本研究经医院伦理委员会批准通过,所有患者均知情同意。
1.2 染色体核型分析
收集骨髓细胞,经过24 h 培养后制片,采用常规R 显带技术,根据参考文献[8]进行染色体核型描述。
1.3 二代测序靶向检测基因突变
提取骨髓液(2~5 ml)中的gDNA,通过多重聚合酶链反应(polymerase chain reaction,PCR)扩增技术,一次性抓取待检测的所有基因(髓系血液疾病34 种高频突变基因),并将构建好的文库用illumina 平台NextSeq550 测序仪进行检测。本检测涵盖了所检测基因编码区及附近内含子区的点突变、小片段插入和缺失型突变,依据突变基因在血液病中的突变类型和功能,并参照指南和文献报道判定检测结果。测序由康圣环球(北京海思特医学检验实验室)完成。
1.4 治疗方案
结合IPSS-R 预后分层、年龄、依从性等进行综合评价,选择治疗方案。21 例较低危组患者以支持治疗为主,包括成分输血、造血生长因子及免疫调节剂等;20 例较高危组患者多采用去甲基化药物、预激方案等化疗及异基因造血干细胞移植;2例患者定期门诊复查,未行相关治疗。
1.5 随访
通过门诊、住院及电话进行随访,随访截止时间为2020 年12 月31 日,随访内容主要为生存状态、死亡时间及原因。总生存期(overall survival,OS):从疾病确诊日期到死亡或末次随访日期。
1.6 统计学方法
采用SPSS 25.0 统计软件进行数据分析并采用Graphpad Prism9.0 及Circos V0.69 软件绘制统计图,不符合正态分布的计量资料以中位数(四分位数间距)[M(P25,P75)]表示,组间比较采用Mann-WhitneyU检验;计数资料以例数及率(%)表示,组间比较采用χ2检验或Fisher 确切概率法;以P<0.05为差异有统计学意义。
2 结果
2.1 基因突变特征分析
本研究共检测到33 种基因突变,每例患者的突变基因个数为0~8 个,中位突变基因个数为2个。40 例(93.02%)患者携带至少1 个基因突变,其中11 例(25.58%)患者携带1 个基因突变,29 例(67.44%)患者携带≥2 个基因突变;在携带1 个基因突变的患者中,肿瘤蛋白p53(tumor protein p53,TP53)突变率最高,占18.18%。
检出的异常基因中,检出频率>5%的基因共16 个,其中突变例数较多的基因有U2 小核RNA 辅助因子1(U2 small nuclear RNA auxiliary factor 1,U2AF1)、ASXL 转录调控因子1(ASXL transcriptional regulator 1,ASXL1)、DNA 甲基转移酶3α(DNA methyltransferase 3 alpha,DNMT3A)、甲基胞嘧啶双加氧酶2(tet methylcytosine dioxygenase 2,TET2)、RUNX 家族转录因子1(RUNX family transcription factor 1,RUNX1)(图1A);突变负荷(即变异丰度)中位数较高的基因有E1A 结合蛋白p300(E1A binding protein p300,EP300)(49.1%)、CREB 结合蛋白(CREB binding protein,CREBBP)(47.6%)、ASXL1(47.1%)、TP53(45.0%)、U2AF1(42.7%)、剪接因子3b 亚基1(splicing factor 3b subunit 1,SF3B1)(41.0%)(图1B)。

图1 MDS患者检出基因的突变例数及突变负荷
依据MDS 患者检出突变基因的功能进行分类,突变频率从高到低依次为表观遗传相关基因[占62.79%(27/43),包括ASXL1、DNMT3A、DNMT3B、TET2、SET结合蛋白1(SET binding protein 1,SETBP1)、BCL6 辅抑制物(BCL6 corepressor,BCOR)、异柠檬酸脱氢酶1(isocitrate dehydrogenase 1,IDH1)、IDH2、赖氨酸甲基转移酶2D(lysine methyltransferase 2D,KMT2D)、zeste 2 多梳抑制复合体2 亚基增强子(enhancer of zeste 2 polycomb repressive complex 2 subunit,EZH2)和WT1]、剪接子相关基因[占46.51%(20/43),包括U2AF1、SF3B1、富含丝氨酸和精氨酸的剪接因子2(serine and arginine rich splicing factor 2,SRSF2)和锌指CCCH 型RNA 结合基序和富含丝氨酸/精氨酸(zinc finger CCCH-type,RNA binding motif and serine/arginine rich 2,ZRSR2)]、转录调节相关基因[占37.21%(16/43),包括RUNX1、PHD手指蛋白6(PHD finger protein 6,PHF6)、CREBBP、cut 样同源盒1(cut like homeobox 1,CUX1)、CCAAT 增强子结合蛋白(CCAAT enhancer binding protein alpha,CEBPA)、GATA 结合蛋白2(GATA binding protein 2,GATA2)、亲嗜性病毒整合位点1(ecotropic viral integrationsite 1,EVI1)和ETV6]、信号转导相关基因[占30.23%(13/43),包括蛋白酪氨酸磷酸酶非受体11 型(protein tyrosine phosphatase non-receptor type 11,PTPN11)、Janus 激酶2(Janus kinase 2,JAK2)、NRAS、Kirsten 鼠肉瘤病毒癌基因同源物(Kirsten rat sarcoma viral oncogene homolog,KRAS)、KIT、CBL]、细胞增殖或凋亡相关基因[占18.60%(8/43),包括TP53和核仁磷酸蛋白1(nucleophosmin 1,NPM1)]和其他功能[占11.63%(5/43),包括STAG2和EP300](表1)。其中,表观遗传基因组(n=27)患者基因突变个数为3.00(2.00,5.00)个,明显多于非表观遗传基因组(n=16)的1.00(1.00,2.80)个,差异有统计学意义(Z=-2.922,P=0.003);剪接子相关基因U2AF1为本研究检出率最高的突变基因,U2AF1突变组(n=10)患者基因突变个数为4.00(2.00,5.00)个,多于非突变组(n=33)的2.00(1.00,3.00)个,差异有统计学意义(Z=-2.288,P=0.022)。
根据坑槽大小,结合实际情况选用人工夯实或小型机具压实。坑槽压实后应在表面均匀撒布一层细砂,使细砂填充表面孔隙,减少路表水的下渗,最后将修补完成的坑槽清洁干净。坑槽修补完成后,修补表面应呈中间略高于四周的弧形,以避免修补表面在行车荷载的二次碾压下形成凹槽。

表1 43 例MDS 患者检出33 种基因的突变情况
2.2 突变基因关联性分析
67.44%(29/43)携带≥2 个突变基因的患者,基因伴随突变发生在单一功能组内的比例(55.20%)高于发生在不同功能组内(44.80%)。本研究突变频率较高的基因中,U2AF1、ASXL1与DNMT3A往往与其他突变伴随出现。
表观遗传相关基因突变分析:表观遗传相关基因突变数占总突变数的37.07%(43/116)(表1),该类基因间伴随突变包括:ASXL1-BCOR、ASXL1-SETBP1、ASXL1-DNMT3A、ASXL1-EZH2、ASXL1-TET2、ASXL1-IDH1、BCOR-EZH2、IDH1-WT1、IDH2-TET2、DNMT3A-TET2、DNMT3A-IDH1、SETBP1-DNMT3A、SETBP1-TET2、SETBP1-IDH1。
非表观遗传相关基因突变分析:U2AF1与NRAS、CREBBP伴随突变的比例较高。剪接子相关基因突变常与转录调节相关基因突变常伴随出现,信号转导相关基因突变与本功能组内基因间伴随突变较常见。
2.3 基因突变个数与MDS 亚型的关系
不同亚型MDS 中,基因突变个数最多的是MDS-U,共8 个(图2A)。MDS-MLD、MDS-SLD、MDS-EB-1、MDS-EB-2 和MDS-U 中,携带3 个以上突变比例逐渐升高(图2B)。在各亚型中,伴有0个基因突变的比例分别为MDS-MLD 10%,MDSSLD 25%,MDS-EB-2 20%;伴有1 个基因突变的比例分别为MDS-MLD 30%,MDS-EB-1 30%,MDSEB-2 20%,MDS-RS-SLD 50%;伴有2 个基因突变的比例分别为MDS-MLD 40%,MDS-SLD 25%,MDS-EB-1 15%,MDS-RS-SLD 50%;伴有3 个基因突变的比例分别为MDS-MLD 10%,MDS-SLD 25%,MDS-EB-1 25%,MDS-EB-2 20%,MDS-5q-100%;伴有3 个以上基因突变的比例分别为MDSMLD 10%,MDS-SLD 25%,MDS-EB-1 30%,MDSEB-2 40%,MDS-U 100%(图2B)。
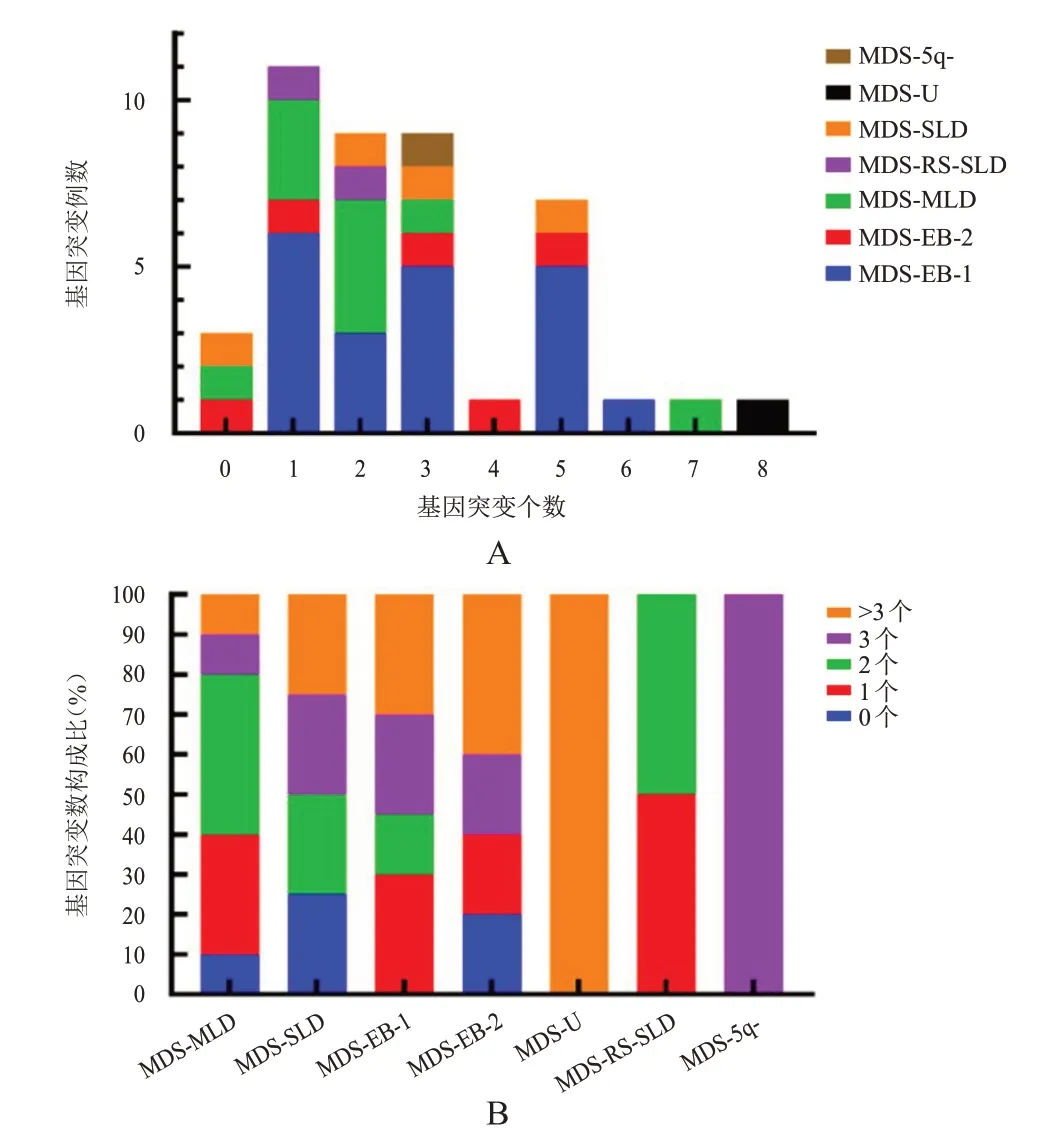
图2 基因突变个数和构成比与MDS亚型的关系
2.4 基因突变与IPSS-R 预后分层的关系
高危+极高危组MDS 患者基因突变个数和染色体异常数目均多于低危+中危组患者,NRAS突变率高于低危+中危组患者,差异均有统计学意义(P<0.05)(表2)。高危+极高危组6 例NRAS突变患者截至末次随访时,死亡5 例(83.33%)。

表2 低危+中危组与高危+极高危组MDS患者基因突变情况的比较
2.5 基因突变与染色体核型的关系
本研究中,异常核型患者基因突变比例为93.75%(15/16),与正常核型患者基因突变比例的92.59%(25/27)比较,差异无统计学意义(P>0.05)。其中5 例SETBP1突变均发生在异常核型患者中,截至末次随访,死亡4 例(80.00%)。
2.6 基因突变与年龄的关系
根据患者年龄分组,年龄≥70 岁MDS 患者SF3B1突变率为26.67%(4/15),高于<70 岁患者的0%(0/28),差异有统计学意义(P=0.011)。SF3B1突变患者中有1 例患者OS 最长达98 个月,截至随访结束之日仍生存。
3 讨论
MDS 的发生、发展是一个多步骤、复杂的病理过程,其发病机制目前尚未完全阐明。当前,二代测序技术的发展迅速,本研究旨在探讨MDS 基因突变特征与临床特征的关系。本研究对43 例MDS 患者进行分析发现,U2AF1突变频率最高,与李冰等[9]报道最高突变基因一致,并发现U2AF1突变组基因突变个数多于非突变组。Hosono[10]报道MDS 患者突变频率最高的基因为SF3B1。Tefferi等[11]通过对179 例MDS 患者的二代测序发现,ASXL1的突变频率最高。以上国内外研究的差异可能是由地理位置、生活习惯和环境等因素引起。
本研究共检测出MDS 突变基因33 种,根据功能不同,主要涉及表观遗传学、转录调节、剪接因子、信号转导和细胞凋亡增殖等相关基因[9-10,12],其中最常见的突变基因为表观遗传相关基因,与文献报道一致[9]。除表观遗传相关基因外,剪接子相关基因突变常与转录调节相关基因突变伴随出现,提示剪接子相关基因突变与转录调节相关基因突变之间可能有协同促进MDS 发生的作用。本研究突变频率较高的基因中,ASXL1往往与其他突变伴随出现,与既往报道一致[13]。本研究中1例老年男性患者存在ASXL1、SETBP1、NRAS、KRAS、IDH1、PTPN11、DNMT3A、CBL伴随突变,确诊14 个月后死亡。与文献报道的ASXL1和SETBP1共同突变可驱动MDS 转化为急性髓系白血病相符[14],提示联合基因突变患者的预后可能较差。
本研究中,93.02%的患者携带至少1 个基因突变,符合既往研究报道[1-3]。不同亚型MDS 中,基因突变个数最多的是MDS-U,共8 个。MDS-MLD、MDS-SLD、MDS-EB-1、MDS-EB-2 和MDS-U 中,携带3 个以上基因突变比例逐渐升高,与以往研究结果相近[15]。高危+极高危组有6 例NRAS突变患者,截至末次随访,死亡5 例(83.33%)。有文献报道,NRAS突变与较短的OS 相关,且向急性髓系白血病转化的风险较高[16]。结合本研究与既往文献分析,提示NRAS突变的不良预后可能由于其更多的骨髓原始细胞所致。
基因突变与染色体核型的相关分析中发现,SETBP1突变均发生在异常核型患者中,截至末次随访时间,死亡4 例(80.00%)。既往多项研究表明,表观遗传相关基因SETBP1在髓系肿瘤中发挥促癌基因的作用,提示SETBP1突变为MDS 患者OS 的独立危险因素,可促进MDS 向急性髓系白血病转化[11,17-19]。本研究与以上国内外研究报道一致,均表明伴有该基因突变的患者预后不良。
本研究4 例SF3B1突变患者均为老年人,有研究报道,SF3B1突变的MDS 患者发病年龄明显大于SF3B1未突变的患者[20-21]。本研究中,截至末次随访,1 例SF3B1突变患者OS 最长达98 个月,仍生存,符合Nazha 等[22]分析了508 例MDS 患者的临床数据显示SF3B1突变可能延长患者的OS。相关研究亦显示,SF3B1突变是一个有利预后的因素,可作为一种独特的疾病亚型,向急性髓系白血病转化的风险降低[23]。
综上所述,MDS 患者的基因突变可以通过二代测序在大多数(>90%)患者中检测到,67.44%的患者存在基因之间的伴随突变。MDS 相关基因突变特征可能与疾病亚型、IPSS-R 预后分层、染色体核型和患者年龄等临床特征有关。二代测序为MDS 患者预后评估和疗效预测提供依据,可考虑纳入MDS IPSS-R。

