ING4在结肠和直肠的胃肠间质瘤表达的研究
彭芳,钟斌,王建,张功亮,杨人泽
(1、赣州市人民医院病理科,江西赣州341000;2、赣南医学院第一附属医院药剂科,江西赣州341000)
ING4在结肠和直肠的胃肠间质瘤表达的研究
彭芳1,钟斌2,王建1,张功亮1,杨人泽2
(1、赣州市人民医院病理科,江西赣州341000;2、赣南医学院第一附属医院药剂科,江西赣州341000)
目的研究ING4与结肠和直肠的胃肠间质瘤的恶性程度的关系。方法收集原发于结肠和直肠的胃肠间质瘤共62例,并用RT-PCR方法和免疫组织化学方法检测ING4 mRNA和ING4蛋白在胃肠道间质瘤高危组、中危组、低危组和极低危组中的表达情况。结果RT-PCR技术测定胃肠道间质瘤高危组、中危组、低危组和极低危组中ING4与β-actin光密度比值平均值分别为0.32、0.51、0.56和0.78胃肠道间质瘤高危组、中危组、低危组和极低危组中ING4 mRNA的量也依次增加,差别有统计学意义(P<0.05)。62例ING4免疫组织化学结果:高危组阳性3例(阳性率18.8%);中危组阳性6例(阳性率26.1%);低危组阳性10例(阳性率55.6%);极低危组阳性3例(阳性率60%)。胃肠道间质瘤高危组、中危组、低危组和极低危组中ING4蛋白表达阳性率也依次增加,差别有统计学意义(P<0.05)。结论ING4可以作为一个新的评价胃肠道间质肿瘤恶性程度的指标。
ING4;胃肠间质瘤;RT-PCR;免疫组织化学
ING4基因是Shiseki M等[1]于2003年发现肿瘤抑制基因,它参与调节P53活性、肿瘤血管的增生、细胞对缺氧状态的适应、细胞接触抑制的丢失以及细胞对化学药物敏感性等影响肿瘤的发生、生长及对肿瘤治疗的多个方面[1-6]。胃肠间质瘤是胃肠道常见的间叶源性肿瘤,可发生于胃肠道的任何部位,这种肿瘤起源于间质的起搏细胞(Cajal细胞)[7],这些起搏细胞穿插在肠壁平滑肌组织和自主神经系统之间[4,8]。本实验在基因水平和蛋白水平探讨ING4与结肠和直肠的胃肠间质瘤的恶性程度的关系。
1 材料与方法
1.1 病例资料收集我院2005年至2016年10月间原发于结肠和直肠的胃肠间质瘤共62例。男性38例,女性24例,年龄31~79岁,平均年龄55岁。51例肿瘤位于结肠,11例肿瘤位于直肠。41例患者表现为反复发作腹痛,查体发现腹部包块,9例患者以消化道出血为首发症状就诊,4例以肿瘤破裂合并急腹症,8例患者体检发现肿块入院。肿瘤最大径0.5~12cm,平均最大径4cm。56例肿瘤边界尚清楚,6例肿瘤破裂。其中黏膜下3例,肌壁间32例,浆膜外27例。肿物切面实性,灰红色灰白色,部分区域呈鱼肉状,质中偏嫩,灶性区域囊性变伴出血坏死。根据肿瘤大小、核分裂像和有无肿瘤性坏死分为高危组、中危组、低危组和极低危组,其中高危组16例,中危组23例,低危组18例,极低危组5例。
1.2实验材料ING4和β-actin引物购自天为时代科技(北京)有限公司,2×Taq PCR MasterMix购自天根生化科技(北京)有限公司,Trizol和Prime ScriptTMRT reagent kit购自宝生物工程(大连)有限公司。一抗兔抗人ING4多克隆抗体购自英国Abcom公司,兔鼠通用型免疫组化SP法检测试剂盒及DAB显色剂均购自福建迈新生物技术有限公司。
1.3 实验方法
1.3.1 RT-PCR方法总RNA提取:取约200mg组织,放到1.5ml EP管中,加入1ml Trizol匀浆。震荡30s。加0.2ml氯仿,剧烈地摇动30s,静置3min。12000×g,4℃离心,15min。吸出上层无色水相,移入另一个EP管中(约0.5ml)。加入等体积的异丙醇,混匀,静置10min。12000×g,4℃离心,10min。在管底部可见微量RNA的沉淀,弃去上清,加75%乙醇1ml,振荡。7500×g,4℃离心,10min。弃去上清,用滤纸吸取残留液体,室温下干燥5~10min。沉淀溶于20μl DEPC水中,-70℃保存。
1.3.2 计算总RNA提取样品的纯度与质量所有标本的OD260nm/OD280nm值均在1.8~2.0之间,表明总RNA纯度较高,没有蛋白质残留。总RNA变性琼脂糖凝胶电泳结果显示:18S和28S的条带清晰,隐约可见5S。提示RNA提取完整,无降解。
1.3.3 逆转录合成cDNA用Prime ScriptTMRT reagent kit,进行逆转录反应:
在0.1%DEPC处理的EP管中依次加入以下试剂:
5×PrimeScript Buffer2μl
PrimeScript RT Enzyme MIX I0.5μl
Oligo dT Primer0.5μl
Random 6mers0.5μl
Total RNA4μl
Rnase Free dH2O2.5μl
反转录反应条件:37℃水浴15min(逆转录反应),后置于85℃5sec(使反转录酶的失活反应)。置于-20℃冰箱冻存备用。
1.3.4 聚合酶链式反应(PCR)ING4基因检测引物序列、产物长度和PCR反应条件,以β-actin作为对照。见表1、表2。
PCR反应体系
10×Buffer(15mM MgCl2)5.0μl
dNTP(2.0mM)4.0μl
上、下游引物各1.0μl
Taq酶0.5μl
模板(cDNA)5.0μl
用无核酶水定容至25.0μl
加无菌石蜡油25.0μl

表1 PCR引物序列

表2 PCR反应条件
1.3.5 琼脂糖凝胶电泳取扩增产物10μl点样,2%琼脂糖凝胶电泳,溴化乙啶染色显示,在透射紫外光分析仪下摄影,并用激光光密度图象扫描仪扫描。
1.3.6 凝胶分析定量计算方法为:所得ING4扩增产物的条带与β-actin扩增产物的条带的综合灰度之比代表mRNA的表达水平。
1.3.7 质量控制设立了空白对照组、阴性对照组和内对照组。空白对照:用DEPC水替代cDNA进行PCR扩增。阴性对照组:以RNA替代cDNA用于PCR扩增。内对照组:以β-actin引物,扩增的cDNA,证实提取的RNA产物是否可以用于扩增目的DNA。
1.3.8 免疫组织化学方法免疫组织化学试剂一抗采用英国Abcom公司生产的ING4多克隆抗体。检测系统也采用福建迈新公司的Elivision试剂盒。石蜡切片厚度3μm,60℃烤箱烤片1h,梯度二甲苯脱蜡,梯度乙醇水化,蒸馏水浸泡5min,3%过氧化氢室温孵育10min阻断内源性过氧化酶的活性,PBS液冲洗,高压锅抗原修复,自然冷却至室温。加入二步法Elivision试剂盒中试剂A,室温孵育20min,PBS冲洗3次,每次5min,加入试剂盒中试剂B,室温下孵育30min,PBS冲洗3次,每次5min。镜下控制DAB显色,蒸馏水冲洗终止反应。苏木素复染,盐酸酒精分化,自来水冲洗返蓝,脱水,透明,中性树胶封片,每次均做阳性对照及PBS代替一抗做阴性对照。
1.3.9 免疫细胞化学判断的标准定位准确,呈棕黄色颗粒为阳性,ING4阳性定位于细胞核,阳性细胞小于10%为(-),11%~25%为(+),26%~50%为(++),51%~75%为(+++),76%~100%为(++++)
1.4 统计分析方法RT-PCR实验重复3次,RTPCR实验的图片用Image tool软件进行灰度值分析,实验数据采用t检验分析,P<0.05为差别有统计学意义。实验数据采用SPSS 17.0统计软件进行处理。
2 结果
2.1 RT-PCR方法检测胃肠道间质瘤高危组、中危组、低危组和极低危组中ING4mRNA的表达情况RT-PCR技术测定胃肠道间质瘤高危组、中危组、低危组和极低危组中ING4mRNA表达情况(见图1)。各组中ING4与β-actin光密度比值平均值分别为0.32、0.51、0.56和0.78(见表3)。胃肠道间质瘤高危组、中危组、低危组和极低危组中ING4mRNA的量也依次增加,差异有统计学意义(P<0.05)。
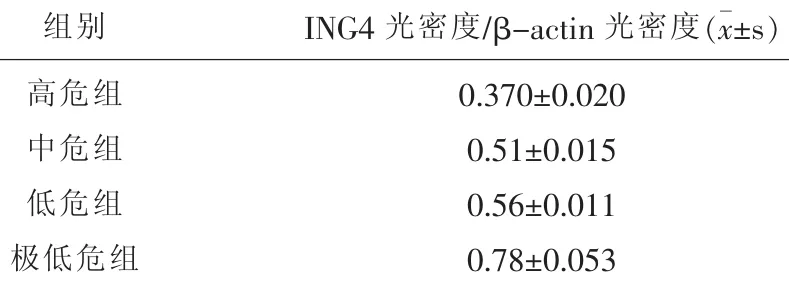
表3 胃肠道间质瘤高危组、中危组、低危组和极低危组中ING4 mRNA表达情况(x±s)

图1 胃肠道间质瘤高危组、中危组、低危组和极低危组中ING4 mRNA表达情况
2.2 免疫组织化学方法检测胃肠道间质瘤高危组、中危组、低危组和极低危组中ING4蛋白的表达情况62例ING4免疫组织化学结果(见图2):高危组阳性3例(阳性率18.8%);中危组阳性6例(阳性率26.1%);低危组阳性10例(阳性率55.6%);极低危组阳性3例(阳性率60%)。胃肠道间质瘤高危组、中危组、低危组和极低危组中ING蛋白表达阳性率也依次增加,差异有统计学意义(P<0.05)。
3 讨论
ING4是2003年新发现的抑癌基因[1-3]。它参与调节P53活性、肿瘤血管的增生、细胞对缺氧状态的适应、细胞接触抑制的丢失以及细胞对化学药物敏感性等影响肿瘤的发生、生长及对肿瘤治疗的多个方面[4-12]。ING4蛋白和p53形成转录复合物,从而激活p53基因,介导细胞的生长和修复;HIF的异常表达或者激活后通过促进血管形成、糖酵解、细胞增生和分裂等过程促进肿瘤的发展,ING4直接和HIF的羟化,而抑制肿瘤生长[13,14];过度表达ING4可以显著负性调节处于G2M停止期细胞,而促进细胞凋亡[12-15]。

图2 ING4免疫组织化学结果(×200)
本实验采用RT-PCR方法和免疫组织化学的方法检测ING4 mRNA和ING4蛋白在胃肠道间质瘤高危组、中危组、低危组和极低危组中的表达情况,发现胃肠道间质瘤高危组、中危组、低危组和极低危组中ING4 mRNA和ING4蛋白表达阳性率也依次增加,差别有统计学意义(P<0.05)。
胃肠道间质瘤目前评价恶性程度主要是依据肿瘤部位、大小、核分裂像和有无肿瘤性坏死,而缺乏免疫组织化学指标的支持,本实验结果证实随着胃肠道间质瘤恶性程度的增加,ING4 mRNA和ING4蛋白的表达降低。ING4可以作为一个新的评价胃肠道间质肿瘤恶性程度的指标。
[1]Shiseki M,Nagashima M,Pedeux RM,et al.p29 ING4 and p28 ING5 bind to p53 and p300,and enhance p53 activity[J].Cancer Res,2003,63(10):2373-8.
[2]Ren X,Liu H,Zhang M,et al.Co-expression of ING4 and P53 enhances hypopharyngeal cancer chemosensitivity to cisplatin in vivo [J].Mol Med Rep.2016 Sep;14(3):2431-2438.
[3]Rakshit N,Yang S,Zhou W,et al.Adenovirus-mediated co-expression of ING4 and PTEN cooperatively enhances their antitumor activity in human hepatocellular carcinoma cells[J].Acta Biochim Biophys Sin(Shanghai),2016,48(8):704-713.
[4]Zhao D,Liu X,Zhang Y,et al.Reduced expression and prognostic implication of inhibitor of growth 4 in human osteosarcoma[J].Oncol Lett,2016,11(4):2869-2874.
[5]Ma Y,Cheng X,Wang F,et al.ING4 Inhibits Proliferation and Induces Apoptosis in Human Melanoma A375 Cells via the Fas/Caspase-8 Apoptosis Pathway[J].Dermatology,2016,232(3):265-272.
[6]Yuan S,Jin J,Shi J,et al.Inhibitor of growth-4 is a potential target for cancer therapy[J].Tumour Biol,2016,37(4):4275-4279.
[7]Yun JH,Moon S,Lee HS,et al.MicroRNA-650 in a copy numbervariable region regulates the production of interleukin 6 in human osteosarcoma cells[J].Oncol Lett,2015,10(4):2603-2609.
[8]Sun J,Shen Q,Lu H,et al.Oncogenic Ras suppresses ING4-TDGFas axis to promote apoptosis resistance[J].Oncotarget,2015,6 (39):41997-2007.
[9]Cai L,Li X,Zheng S,et al.Inhibitor of growth 4 is involved in melanomagenesis and induces growth suppression and apoptosis in melanoma cell line M14[J].Melanoma Res,2009,19(1):1-7.
[10]陈斌,邓跃飞.ING4基因抗肿瘤作用的研究进展[J].中国微侵袭神经外科杂志,2008,13(3):141-143.
[11]Cui S,Gao Y,Zhang K,et al.The emerging role of inhibitor of growth 4 as a tumor suppressor in multiple human cancers[J].Cell Physiol Biochem,2015,36(2):409-422.
[12]彭芳,王建,张功亮,等.细针穿刺细胞块的制作和免疫细胞化学在乳腺癌诊断和术前化疗中的意义[J].实验与检验医学,2015,33(6):719-721.
[13]Yan R,He L,Li Z,et al.SCF(JFK)is a bona fide E3 ligase for ING4 and a potent promoter of the angiogenesis and metastasis of breast cancer[J].Genes Dev,2015,29(6):672-685.
[14]Li M,Zhu Y,Zhang H,et al.Delivery of inhibitor of growth 4 (ING4)gene significantly inhibits proliferation and invasion and promotes apoptosis of human osteosarcoma cells[J].Sci Rep,2014,4:7380.
[15]彭芳,张功亮,王建,等.BRCA-1和Topol l在乳腺癌中的表达及临床病理关系分析[J].实验与检验医学,2012,30(6):552-554.
R735.3,R446.62
A
1674-1129(2017)03-0337-03
2016-12-26;
2017-05-01)
10.3969/j.issn.1674-1129.2017.03.013
江西省卫计委资助课题,编号:20167204
彭芳,女,1985年生,主治医师,病理与病理生理学专业,硕士研究生。
杨人泽,男,1975年生,主任药师,硕士学位。研究方向为医院药学和临床药学。

