Rab25 沉默对转化生长因子-β诱导的前列腺癌LNCaP 细胞上皮-间充质转化的影响△
胡春晖,于磊,赵先诚,郁全胜,刘豪
宿迁市第一人民医院泌尿外科,江苏 宿迁 223800
前列腺癌是男性泌尿生殖系统常见的恶性肿瘤之一,在全球男性恶性肿瘤发病和死亡谱中,前列腺癌分别居第2 位和第5 位[1]。近年来,随着中国人口老龄化的加剧,前列腺癌的发病率和病死率均呈明显上升趋势[2]。2020 年全球癌症统计数据显示,中国前列腺癌发病例数占全球8.2%,死亡例数占全球13.6%[3]。前列腺癌的确切病因尚未阐明,因此,积极筛选前列腺癌侵袭转移的关键分子,对于寻求前列腺癌治疗新策略具有非常重要的意义。Rab 蛋白家族是Ras 超家族中最大的亚家族,由小分子鸟苷三磷酸(guanosine triphosphate,GTP)结合蛋白组成,参与细胞内吞作用和细胞囊泡转运中的许多关键过程,主要调节细胞中囊泡转运和蛋白质交换,Rab 表达失调被证实与包括恶性肿瘤在内的多种疾病关系密切[4]。Rab25 是Rab蛋白家族成员,在细胞内作为转运蛋白发挥关键作用,能够与GTP 结合后将GTP 水解,对细胞囊泡转运的各个阶段进行调控[5]。Rab25 表达水平与多种肿瘤的发生发展密切相关,其在头颈部肿瘤、胃癌、卵巢癌、宫颈癌、膀胱癌和肾癌中高表达并发挥致癌作用,但在食管鳞状细胞癌、三阴性乳腺癌和结直肠癌中低表达并发挥抑癌作用[6]。上皮-间充质转化(epithelial-mesenchymal transition,EMT)被认为是导致肿瘤转移的重要机制[7],也是致癌的关键标志[8]。转化生长因子-β(transforming growth factor-β,TGF-β)通路是激活肿瘤EMT 的一条关键通路[9]。研究表明,TGF-β通过诱导EMT 加速肿瘤转移[10]。已有研究表明,Rab25 在乳腺癌EMT 过程中具有至关重要的作用[11],然而Rab25 在前列腺癌中的功能和作用机制尚不清楚。本研究探讨Rab25沉默对TGF-β诱导的前列腺癌LNCaP 细胞EMT 的影响,现报道如下。
1 材料与方法
1.1 细胞及主要试剂
LNCaP 细胞株购自上海吉凯基因科技有限公司,293T 细胞购自南京科佰生物科技有限公司,DNA 内切酶和DNA marker 均购自美国Thermo Fisher Scientific 公司,DNA 连接酶购自日本Takara公司,DNA 凝胶回收试剂盒购自北京全式金生物技术股份有限公司,质粒抽提试剂盒购自美国Axygen 公司,反转录试剂盒和SYBR Green Mix 均购自南京诺唯赞生物科技股份有限公司,TRIzol 购自美国Invitrogen 公司,RPMI1640 培养基购自美国Corning 公司,结晶紫购自生工生物工程(上海)股份有限公司,聚凝胺(Polybrene)购自上海吉玛制药技术有限公司,Rab25 一抗购自美国CST 公司,辣根过氧化物酶标记的山羊抗兔免疫球蛋白G(immunoglobulin G,IgG)二抗购自上海碧云天生物技术有限公司。
1.2 PLKO.1-puro-Rab25-短发夹RNA(short hairpin RNA,shRNA)重组干扰质粒的构建及鉴定
1.2.1 shRNA 干扰序列的设计和合成本研究共设计3条靶向Rab25基因的干扰序列,干扰靶点见表1,过表达质粒是PLKO.1 质粒。载体PLKO.1 带有EcoRⅠ和AgeⅠ酶切位点。应用EcoRⅠ和AgeⅠ对载体PLKO.1 进行酶切后,使用T4 连接酶将经过双酶切的质粒和干扰靶点连接到一起,构建PLKO.1-puro-Rab25-shRNA-1、PLKO.1-puro-Rab25-shRNA-2、PLKO.1-puro-Rab25-shRNA-3 重组质粒,分别作为shRab25-1 组、shRab25-2 组、shRab25-3 组,并设置空白对照NC 组。
表1 针对Rab25基因的3个干扰靶点
1.2.2 细胞培养、慢病毒包装及病毒感染细胞培养:使用含10%胎牛血清(fetal bovine serum,FBS)的RPMI1640 培养基(含1.5 mg/L 谷氨酰胺、100 U/ml青霉素、100 μg/ml 链霉素)常规培养LNCaP 细胞,置于37 ℃、5% CO2饱和湿度培养箱中。慢病毒包装:培养293T 细胞,培养至80%~90%融合时,倾去培养液,采用3 ml 磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤细胞2 次,加入1 ml 胰蛋白酶-乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)溶液,再加入1 ml DMEM 培养液,平均铺到2 个10 cm2皿中。待细胞培养至60%~70%融合时进行转染:2 个1.5 ml 管中分别加入5 μg shRab25和5 μg NC 质粒,再加入包装质粒5 μg psPAX2 和2.5 μg pMD2.G,用1 ml 无血清RPMI1640 培养基稀释质粒,再加入20 μl Lipofectamine 2000 转染试剂,混匀。室温静置20 min 后加入细胞。转染8 h后换新鲜的DMEM 培养基,37 ℃、5% CO2培养箱中继续培养。48 h 后收集培养基上清,分装,感染LNCaP 细胞。
1.2.3 稳筛株构建将LNCaP 细胞按1×105/孔的浓度接种于6 孔板中,培养24 h,待细胞30%~40%融合时加入慢病毒2 ml,并加入终浓度为5 μg/ml的聚凝胺。待细胞80%~90%融合时加入嘌呤霉素,终浓度为2 μg/ml,同时设立空白对照组。维持嘌呤霉素浓度,隔天换液,连续观察4 天,至空白对照组细胞全部死亡后,可认为已经获得稳筛株。稳筛株细胞扩增收样。
1.3 定量逆转录聚合酶链反应(quantitation reverse transcription- polymerase chain reaction,qRT-PCR)检测Rab25 mRNA 相对表达量
收集各组细胞,TRIzol法提取总RNA,琼脂糖电泳检查RNA的完整性,采用逆转录试剂盒将总RNA逆转录合成互补DNA(complementary DNA,cDNA)。Rab25上游引物5'-GGGAATGGAACTGAGGAAGATTA-3',下游引物5'-CGTGAATCGGGAGAGTAGATTG-3';甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)上游引物5'-CTGGGCTACACTGAGCACC-3',下游引物5'-AAGTGGTCGTTGAGGGCAATG-3'。逆转录反应体系为20 μl,其中2×SYBR Green Mix 10 μl,总RNA 1 μg,加焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水至20 μl。逆转录反应条件:37 ℃15 min,85 ℃5 s。PCR 反应体系为20 μl,其中2×PCR Master Mix 10 μl,上游引物1 μl,下游引物1 μl,cDNA 模板0.5 μl,加ddH2O 至20 μl。PCR 反应条件:95 ℃5 min,95 ℃10 s,60 ℃30 s,共40 个循环。60~95 ℃缓慢升温,产生Rab25和GAPDH的溶解曲线。
1.4 蛋白质印迹法(Western blot)检测细胞中Rab25 蛋白表达水平
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白后,电转移至硝酸纤维素膜(350 mA 恒流1.5 h);用5%脱脂奶粉封闭液封闭1 h;加入一抗(1∶2000),室温孵育1.5 h;用TBST缓冲液冲洗3 次,每次5~10 min;加入相应的二抗,室温孵育30 min;用TBST 缓冲液冲洗3 次,每次5~10 min;用TBST 缓冲液润洗2 次;加入适量的电化学发光(electrochemiluminescence,ECL)液,借助凝胶成像系统显影。
1.5 Rab25 沉默对TGF-β介导的前列腺癌LNCaP细胞EMT 影响的实验研究
培养NC 组和shRab25-1 组细胞,加入TGF-β(5 ng/ml)或不加入TGF-β,分别作为NC 组、NC+TGF-β组、shRab25-1 组、shRab25-1+TGF-β组,使用相差显微镜观察各组LNCaP 细胞的形态学变化,采用Western Blot 检测EMT 生物标志物E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)的表达情况。具体实验步骤同1.4。
1.6 统计学方法
采用SPSS 21.0、Graphpad Prism9.0 软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用方差分析,多组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 重组shRNA 表达质粒的DNA 测序结果
本研究设计了针对Rab25基因的3 个干扰靶点,并成功地将目的基因片段克隆到载体PLKO.1中。测序结果显示,插入的碱基序列与设计的干扰靶点完全一致。PLKO.1-puro-Rab25-shRNA-1、PLKO.1-puro-Rab25-shRNA-2、PLKO.1-puro-Rab25-shRNA-3 插入序列部分测序图见图1~图3。

图1 PLKO.1-puro-Rab25-shRNA-1插入序列部分测序图

图2 PLKO.1-puro-Rab25-shRNA-2插入序列部分测序图
图3 PLKO.1-puro-Rab25-shRNA-3插入序列部分测序图
2.2 Rab25 mRNA 相对表达量的比较
RNA 电泳28S rRNA、18S rRNA 条带清晰可见,说明RNA 未降解(图4);Rab25和GAPDH扩增曲线呈现平滑S形状,熔解曲线主峰清晰,无杂峰出现,提示本次PCR 扩增产物较纯,并无非特异性扩增(图5)。shRab25-1 组、shRab25-2 组、shRab25-3组细胞中Rab25mRNA 相对表达量均低于NC 组,差异均有统计学意义(P<0.05),其中shRab25-1 细胞中Rab25mRNA 相对表达量最低(表2)。
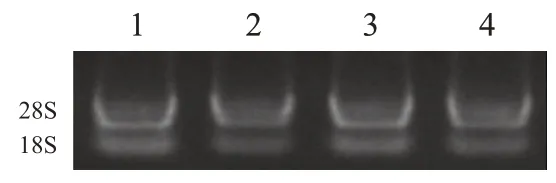
图4 RNA提取质量检测结果
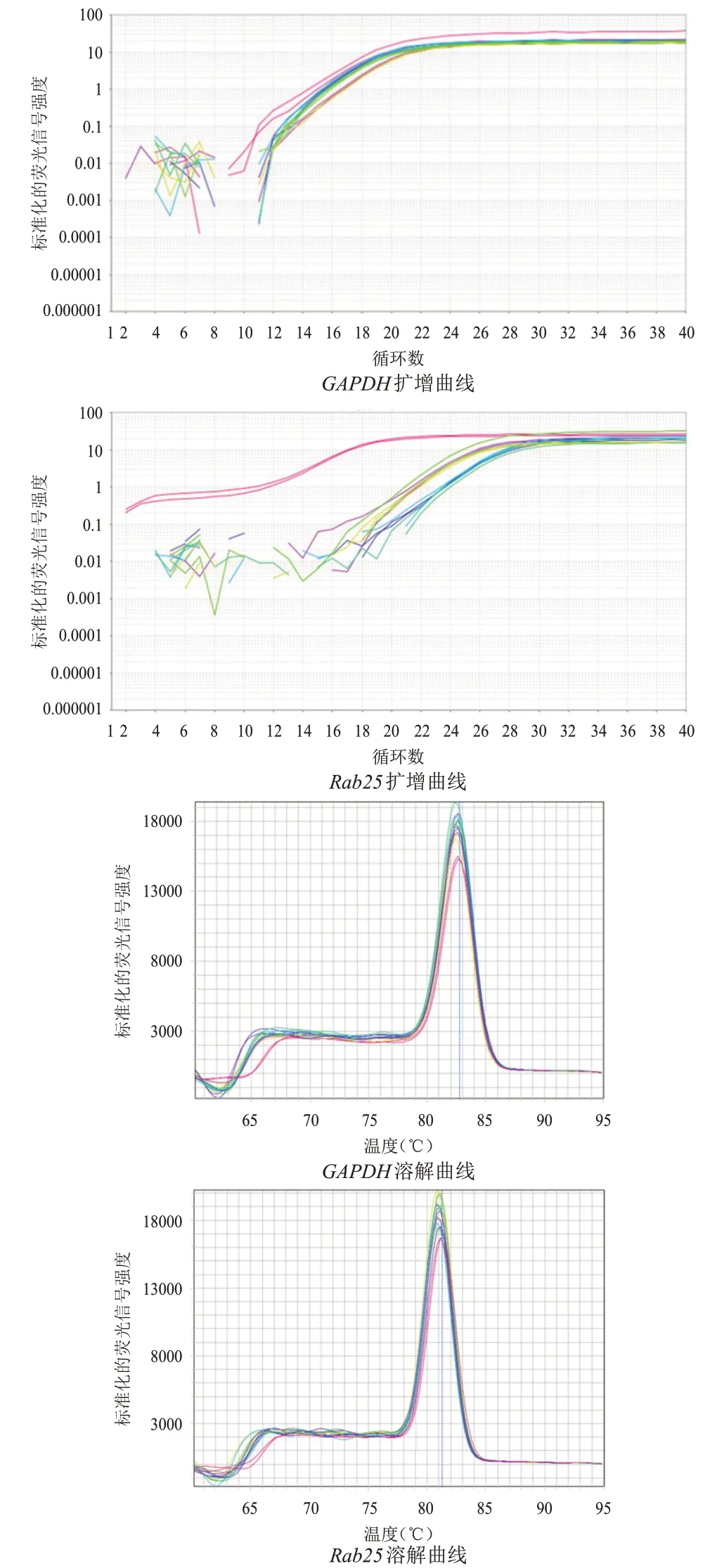
图5 Rab25和内参GAPDH扩增曲线及熔解曲线
表2 各组细胞中Rab25 mRNA 相对表达量的比较(±s)
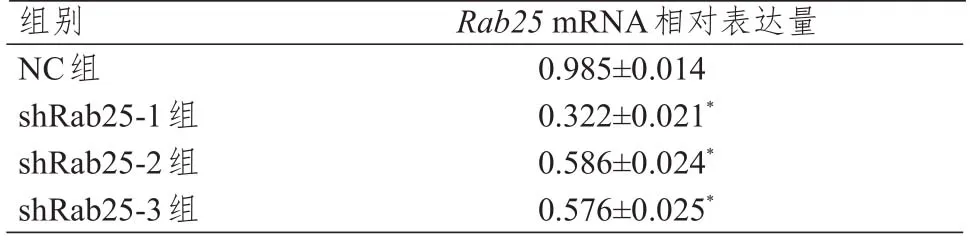
表2 各组细胞中Rab25 mRNA 相对表达量的比较(±s)
注:*与NC组比较,P<0.05
组别NC组shRab25-1组shRab25-2组shRab25-3组Rab25 mRNA相对表达量0.985±0.014 0.322±0.021*0.586±0.024*0.576±0.025*
2.3 Rab25 蛋白表达水平的比较
shRab25-1 组、shRab25-2 组、shRab25-3 组中Rab25 蛋白相对表达量均低于NC 组,差异均有统计学意义(P<0.05),其中shRab25-1 组Rab25 蛋白表达水平最低(图6、表3),故选取shRab25-1 作为后续实验用的干扰载体。

图6 Western blot检测各组细胞中Rab25蛋白表达情况
表3 各组细胞中Rab25 蛋白相对表达量的比较(±s)
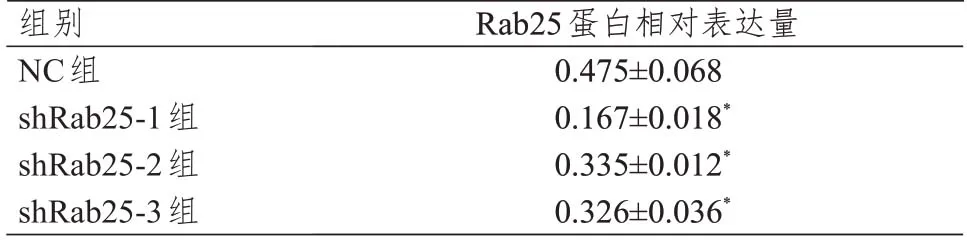
表3 各组细胞中Rab25 蛋白相对表达量的比较(±s)
注:*与NC组比较,P<0.05
组别NC组shRab25-1组shRab25-2组shRab25-3组Rab25蛋白相对表达量0.475±0.068 0.167±0.018*0.335±0.012*0.326±0.036*
2.4 Rab25 沉默对TGF-β介导的前列腺癌细胞EMT 的影响
Rab25沉默后会降低细胞密度,加入TGF-β会部分逆转这种抑制作用,同时各组细胞形态结构未见明显破坏(图7)。shRab25-1 组细胞中E-cadherin 蛋白相对表达量高于NC 组,N-cadherin 蛋白相对表达量低于NC 组,差异均有统计学意义(P<0.05);NC+TGF-β组细胞中E-cadherin 蛋白相对表达量低于NC 组,N-cadherin 蛋白相对表达量高于NC 组,差异均有统计学意义(P<0.05);shRab25-1+TGF-β组细胞中E-cadherin 蛋白相对表达量低于shRab25-1 组,N-cadherin 蛋白相对表达量低于NC+TGF-β组,差异均有统计学意义(P<0.05)。(图8、表4)

图7 相差显微镜观察LNCaP细胞经相应处理后的细胞形态学变化(×200)

图8 Western blot检测各组细胞中E-cadherin、N-cadherin蛋白表达情况
表4 各组细胞中E-cadherin、N-cadherin蛋白相对表达量的比较(±s)
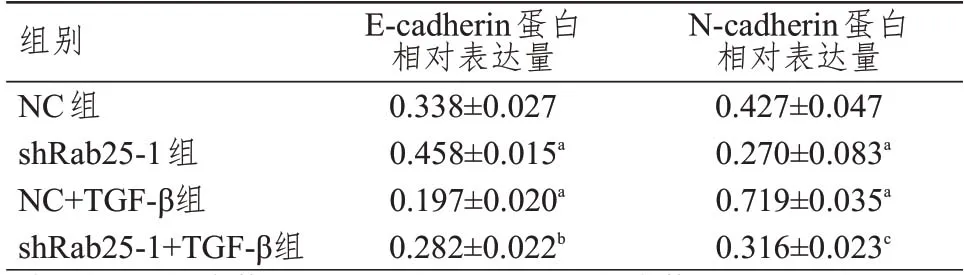
表4 各组细胞中E-cadherin、N-cadherin蛋白相对表达量的比较(±s)
注:a与NC组比较,P<0.05;b与shRab25-1组比较,P<0.05;c与NC+TGF-β组比较,P<0.05
E-cadherin蛋白相对表达量0.338±0.027 0.458±0.015a 0.197±0.020a 0.282±0.022b N-cadherin蛋白相对表达量0.427±0.047 0.270±0.083a 0.719±0.035a 0.316±0.023c组别NC组shRab25-1组NC+TGF-β组shRab25-1+TGF-β组
3 讨论
Rab25 是囊泡转运和膜动力学的主要调节因子,在细胞转运这一正常生理过程中发挥重要作用,其与配体相互作用的改变及其活性的改变均能引起细胞转导发生异常,从而影响肿瘤细胞生长、增殖、凋亡、迁移和侵袭[12]。目前的研究表明,Rab25 参与肿瘤细胞迁移和侵袭,在多种肿瘤细胞的转移过程中具有重要作用[13]。体外沉默Rab25可抑制高级别非小细胞肺癌[14]、成胶质细胞瘤[15]、肾细胞癌[16]和前列腺癌[17]细胞迁移和侵袭。在胃癌细胞中可以观察到沉默Rab25可以抑制肿瘤细胞侵袭[18]。在膀胱癌的研究中,沉默Rab25不仅能够抑制体外肿瘤细胞迁移,还能减少体内肿瘤转移[19]。
EMT是一种进化上保守的发育程序,与致癌有关,通过增强侵袭能力和对凋亡刺激的抵抗力赋予肿瘤细胞转移特性,被认为是肿瘤恶性转化中的一个基本事件[20]。随着对Rab25 及EMT 的不断深入研究,Rab25 被证实与多种肿瘤的EMT 密切相关。Yin等[21]研究报道,微小RNA(microRNA,miRNA)-577通过抑制乳腺癌中Rab25 的表达来抑制EMT。Jeong 等[22]研究报道,Rab25 可以通过血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)/血管内皮细胞生长因子受体1(vascular endothelial growth factor receptor 1,VEGFR1)信号通路诱导snail家族转录抑制因子1(snail family transcriptional repressor 1,SNAIL)表达,导致肿瘤细胞发生转移和EMT。Calvo等[23]在体外对前列腺癌小鼠模型的研究表明,Rab25的过表达与肿瘤细胞生长、侵袭和新生血管生成有关,并在体外保留了具有增加肿瘤进展的致瘤性特征。既往研究表明,Rab25在前列腺癌中表达升高,体外研究发现Rab25表达下调可抑制前列腺癌细胞增殖、迁移和侵袭,然而Rab25在前列腺癌侵袭转移过程中的作用机制尚无深入研究[17]。
在前列腺癌的发展过程中,上皮细胞可以发生EMT,其特点是表型从立方体到纺锤形的形态变化,导致细胞与细胞间黏附力丧失,从而使细胞迁移或转移到不同器官[24]。这种生物行为与生化改变有关,其中上皮细胞标志物如E-cadherin 表达下调,而间质标志物如波形蛋白和N-cadherin 表达上调[25]。上皮性肿瘤中最有效的EMT 诱导剂是TGF-β[26],TGF-β诱导肿瘤细胞发生EMT 常通过SMAD 介导或非SMAD 信号转导通路,并导致侵袭转移的发生[27]。TGF-β诱导的EMT 在多种肿瘤中已被证实可被一些特异的分子靶标通过靶向EMT 信号通路抑制[26]。因此,抑制EMT 过程是一种有希望的治疗肿瘤转移的策略。
本研究成功完成了沉默Rab25的PLKO.1-puro-Rab25-shRNA 重组干扰质粒的构建,并成功筛选出能够高效抑制LNCaP 细胞中Rab25 表达的重组干扰质粒。本研究发现,Rab25沉默后可以减少TGF-β介导的LNCaP 细胞的EMT,表明Rab25 是TGF-β诱导前列腺癌LNCaP 细胞EMT 的一个关键中间因子,目前的证据证明Rab25沉默后可以部分逆转TGF-β介导的前列腺癌细胞的EMT,具体机制有待进一步研究。
综上所述,Rab25沉默可逆转TGF-β介导的前列腺癌LNCaP细胞的EMT,这为Rab25成为评估前列腺癌发生发展的重要生物标志物提供了理论依据,Rab25可能成为治疗前列腺癌的新型分子靶标。

