思维模型在化学实验题“控制变量法”中的应用
林珠玲 杨唐靖(正高级教师、特级教师)
(1.广东省江门市新会第一中学 2.广东省江门市新会陈经纶中学)
控制变量法是化学实验的重要方法,在人教版新教材必修第二册“探究影响化学反应速率因素”的实验中应用了控制变量法,还增加了控制变量法的方法指导.本文利用思维模型法对控制变量类题型进行解题分析,为高考复习提供帮助.
1 控制变量法的概念模型
控制变量法是指在研究多个因素(变量)之间的关系时,先控制其他几个因素(“无关”变量)不变,集中研究其中一个因素(自变量)的变化所产生的影响.应用控制变量法首先要明确“三量”(自变量、因变量、“无关”变量)的关系.自变量是实验者要探究的因素,是一个变化的量;因变量是随自变量变化而改变的量;“无关”变量是除了自变量和因变量以外的量,是需要控制不变的量.控制变量法常用的思维模型如图1所示.

图1
2 控制变量法在实验方案设计中的应用
2.1 控制单一变量设计实验
例1某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.限选试剂与仪器:30% H2O2、0.1 mol·L—1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器.
(1)设计实验方案:在H2O2浓度不同的条件下,测定_________(要求所测得的数据能直接体现反应速率大小).
(2)参照表1格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示).

表1
分析(1)收集生成相同体积氧气所需的时间(或相同时间内产生氧气的体积).(2)根据思维模型分析,第一步:明确实验目的.由实验目的可知,自变量为H2O2的浓度,因变量为时间或氧气的体积.第二步:确定“无关”变量,即Fe2(SO4)3浓度、氧气体积、时间.第三步:定多变一.变量为H2O2浓度,通过加入不同体积H2O2控制H2O2浓度不同.固定不变量为Fe2(SO4)3浓度和氧气体积(或固定不变量为Fe2(SO4)3浓度和时间),通过加入相同体积Fe2(SO4)3来调控其浓度不变,通常用水调节溶液总体积不变.设计实验方案如下.
方案1在H2O2浓度不同条件下,测定收集相同体积氧气所需的时间.设计方案如表2所示.

表2
方案2在H2O2浓度不同的条件下,测定相同时间内产生氧气的体积.设计方案如表3所示.

表3
2.2 多变量改为单一变量设计实验
例2(2021年广东卷,节选)某合作学习小组进行以下实验探究.
①实验任务:通过测定溶液电导率,探究温度对AgCl溶解度的影响.
②查阅资料:电导率是表征电解质溶液导电能力的物理量.温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大.25 ℃时,Ksp(AgCl)=1.8×10—10.
③提出猜想:
a.较高温度的AgCl饱和溶液的电导率较大.
b.AgCl在水中的溶解度S(45℃)>S(35℃)>S(25℃).
④设计实验,验证猜想:取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的AgCl饱和溶液),在设定的测试温度下,进行表4中的实验1~3,记录数据如表4所示.

表4
⑤实验结果为A3>A2>A1.小组同学认为,此结果可以证明猜想a成立,但不足以证明猜想b成立.结合②中信息,猜想b不足以成立的理由有_________.
⑥优化实验:小组同学为进一步验证猜想,在实验1~3的基础上完善方案,进行实验4和5.请完成表5内容.

表5
⑦实验总结.根据实验1~5的结果,并结合②中信息,小组同学认为猜想b也成立.猜想b成立的判断依据是________.
分析结合②中信息可知:导致实验1~3导电率增大(A3>A2>A1)的因素有温度升高、AgCl溶液溶解度增大(即离子浓度增大),还有水电离程度增大,因此无法判断猜想b成立.明确实验目的为验证猜想.因无法确定自变量,故猜想b有两个变量,一个是温度,另一个是溶解度(离子浓度).温度不同,溶解度也不同,不符合定多变一的原则.因此,需要控制温度相同,从而将两个变量变为一个变量,设计实验方案如下.
方案1控制温度为45℃,测试试样Ⅰ、Ⅱ的电导率,比较试样Ⅰ、Ⅱ、Ⅲ的电导率,如表6所示.
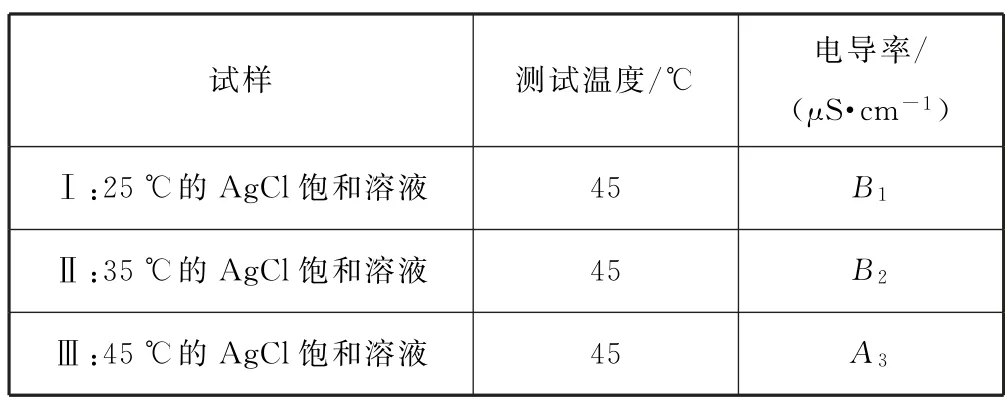
表6
猜想b成立的判断依据是:电导率A3>B2>B1.
方案2(1)控制温度为35℃,测试试样Ⅰ的电导率,比较试样Ⅰ、Ⅱ的电导率,如表7所示.
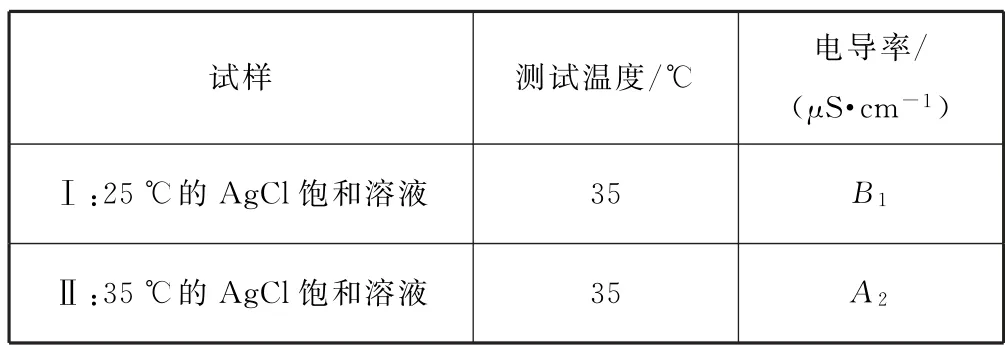
表7
(2)控制温度为45℃,测试试样Ⅱ的电导率,比较试样Ⅱ、Ⅲ的电导率,如表8所示.

表8
综合(1)(2)猜想b 成立的判断依据是:电导率A2>B1,A3>B2.
【解题策略】例1以课本素材人教版化学必修第二册第58页实验活动7“催化剂对化学反应速率的影响”为情境,实验目的明确,实验目的中能直接显示探究的自变量和因变量,控制单一变量,固定无关变量,根据思维模型的步骤分析便可顺利解决问题.例2以溶液电导率为情境,情境陌生、新颖,自变量在实验目的中没有很明确地表达出来,对学生判断有干扰,因此难度增加.巧用思维模型,将多个变量转变为一个变量,便可突破设计难点.
3 控制变量法在实验数据分析中的应用
3.1 正向思维在表格数据分析中的应用
例3某兴趣小组将表9中所给的混合溶液分别加入6个盛有过量Zn粒的反应瓶中,以研究硫酸铜的浓度对稀硫酸与锌反应生成氢气速率的影响.下列判断错误的是( ).

表9
A.V1=30,V6=10,V7=20
B.本实验利用了控制变量思想,变量为铜离子浓度
C.反应一段时间后,实验A 中的金属呈灰黑色,实验F的金属呈现红色
D.该小组的实验结论是硫酸铜的量与生成氢气速率成正比
分析本题探究目的明确,用正向思维模型分析法可解决问题.第一步,明确实验目的:研究硫酸铜的浓度对稀硫酸与锌反应生成氢气速率的影响,找出自变量为硫酸铜浓度.第二步,确定“无关”变量:硫酸的浓度.第三步,定多变一:变量为CuSO4的浓度,通过加入不同体积的CuSO4来调控其浓度,固定不变量为H2SO4的浓度,通过加入相同体积的H2SO4来调控其浓度不变,通常用水调节溶液总体积不变.由于不变量为H2SO4的浓度,加入相同体积H2SO4,因此6组实验H2SO4体积均为30 mL,V1=V2=V3=V4=V5=30mL,由F可知溶液的总体积为30mL+20mL=50 mL,则V6=50 mL—30 mL—10 mL=10mL,V7=50mL—30mL=20mL,选项A 判断正确.由分析可知,变量为铜离子浓度,选项B判断正确.实验A 中锌与稀硫酸反应后,锌的表面不光滑,因此呈灰黑色;实验F 中加入了硫酸铜溶液,Cu被Zn置换出来并覆盖在Zn的表面,金属呈现紫红色,选项C判断正确.氧化性Cu2+>H+,故锌先与硫酸铜反应,若硫酸铜量较少时,形成锌、铜、硫酸原电池,反应速率加快;若硫酸铜量较多时,生成的铜不断覆盖在锌片上,使锌与硫酸接触的表面积不断减小,导致生成氢气的速率不断下降,选项D 判断错误.答案为D.
3.2 逆向思维在表格数据分析中的应用
例4控制变量法是化学探究的重要方法,某同学利用1.0mol·L—1稀硫酸与铁反应,探究影响化学反应速率的因素时得到表10的实验数据.

表10
分析上述数据,回答下列问题:
(1)实验1 和2 表明,影响反应速率的因素是_________.表中x=_________,判断依据为_________.
(2)表明反应物浓度对化学反应速率影响的实验组是________(填实验序号).
(3)本实验中影响反应速率的因素还有________.
(4)实验3中若在铁片上放一根碳棒,金属消失的时间会远小于125s,其原因是________.
分析(1)寻找影响因素,用逆向分析法,从“定多变一”着手,对照实验1 和2 的数据,铁的形状不同,可找出影响反应速率的因素为与反应物接触的表面积.自变量为接触表面积,其他量不变,即硫酸浓度相同,体积相同,用水调节溶液总体积相同,由实验1可知V总=50mL,因此,x=50mL—40mL=10mL.(2)实验1、3中只有硫酸浓度不同,其他反应条件相同,探究浓度对反应速率的影响.(3)整个表格提供的变量有浓度、反应物接触表面积、温度.实验3和4只有温度不同,其他反应条件相同,探究温度对反应速率的影响.(4)形成铁、碳棒、硫酸原电池,加快反应速率,缩短反应时间.
【解题策略】在分析以表格形式给出多种实验数据的题目时,若题目给出了明确的实验目的,则用正向思维分析法,按思维模型的步骤进行分析;若题目没有给出明确的实验目的,而是要根据数据找出实验目的或探究影响因素,则用逆向分析法或正向逆向相结合的综合分析法进行分析.
证据推理与模型认知是探究物质及其变化的重要手段,教师帮助学生建立起实验探究的思维模型,并用思维模型去解决问题,让学生的实验探究、实验设计、实验数据的处理等有方法可依,有思路可循.
(完)

