霍山石斛不同部位总黄酮的含量比较及黄酮类成分分析
杨晓利,蒲天珍,李永华,陈畅,张秀桥,龚玲(湖北中医药大学药学院,湖北 武汉 430065)
霍山石斛DendrobiumhoushaneneseC.Z. Tang et S.J. Cheng是兰科石斛属多年生草本植物,为2020年版《中国药典》石斛项下原植物之一,具有益胃生津,滋阴清热等功效[1]。霍山石斛因其特殊而严苛的生长环境,加之过度采挖,导致其野生资源濒临灭绝。霍山石斛传统入药部位为茎,在加工的过程中除去生物产量较大的叶、根等非药用部位。霍山石斛的主要化学成分包括多糖、黄酮、生物碱、氨基酸及微量元素等[2],其中多糖类和黄酮类成分是其含量最高的主要活性成分[3]。已有研究[4-9]表明,石斛属植物中的黄酮及其糖苷类成分具有抗氧化、抗肿瘤、止血、免疫调节、抗阿尔兹海默症等药理作用,现已经被认为是其主要的药理活性物质之一。因此,有必要对霍山石斛不同部位中黄酮类化合物进行全面的分析研究,为霍山石斛的综合开发利用提供依据。超高效液相色谱-四级杆/飞行时间串联质谱(UHPLC-Q-TOF-MS)技术灵敏度高、分离能力强、分辨率高,能快速地进行结构表征,有效提供化合物的结构信息,是一种高效的分析检测工具,目前已在天然药物的成分分析与鉴定方面得到广泛应用[10]。本实验测定了霍山石斛不同部位的总黄酮含量,并采用UHPLC-Q-TOF-MS技术,分析比较霍山石斛不同部位的黄酮类成分,以期获得霍山石斛不同部位的药效物质基础信息,为霍山石斛药用资源的扩大与进一步开发利用提供科学依据。
1 仪器与材料
1.1 仪器AT-201型十万分之一电子分析天平(瑞士Mettler Toledo 公司);DHG-914385-Ⅲ型电热恒温鼓风干燥箱(上海新苗医疗器械制造有限公司);KX-350 型高速多功能粉碎机(浙江武义鼎藏日用金属制品厂);KQ3200B 型超声波清洗仪(昆山市超声仪器有限公司);UVmini-1240紫外可见分光光度计(日本岛津公司);高分辨飞行时间液质联用仪(美国Waters公司)。
1.2 材料与试剂3 年生霍山石斛于2021 年9 月采自湖北省英山县霍山石斛种植基地,经湖北中医药大学药学院张秀桥教授鉴定为霍山石斛Dendrobium huoshaneneseC. T. Tang et S. J. Cheng。芹菜素对照品,纯度>98%,上海胤珂生物科技有限公司,批号: 140312;甲醇为色谱纯,美国Sigma-Alorch 公司,批号:WXBC2770V;石油醚(30 ~60 ℃)、氯化铝、无水乙醇、甲酸,国药集团化学试剂有限公司。
2 方法
2.1 含量测定
2.1.1 供试品溶液的制备 霍山石斛样品清洗干净,将根、茎、叶分开,将茎剪成小段,将处理后的根、茎、叶于烘箱中60 ℃低温烘干,粉碎机粉碎为粉末,过60 目筛,-20 ℃保存备用。精密称取霍山石斛根、茎、叶的粉末各0.5 g,加入15 mL 石油醚,室温浸泡30 min,超声(100 W、40 Hz)提取30 min,滤过后取滤渣。待石油醚挥尽后,再加入80%乙醇25 mL,室温浸泡30 min,称质量,超声(100 W、40 Hz)40 min,取出室温放置冷却。再称质量,用80%乙醇补足损失的质量,摇匀。重复3次后过滤,取续滤液,即得根、茎、叶供试品溶液。
2.1.2 对照品溶液的制备 精密称取芹菜素对照品4.78 mg,用80%乙醇溶解,并定容至50 mL,摇匀,即得浓度为0.095 6 mg·mL-1的芹菜素对照品溶液[11]。
2.1.3 线性关系考察 精密量取芹菜素对照品溶液0.0、1.0、1.5、2.0、2.5、3.0、3.5、4 mL 分别置于10 mL 容量瓶中,加入1% AlCl3溶液1 mL。再加入80%乙醇,定容,摇匀,室温静置15 min。以未加芹菜素对照品溶液为空白对照,紫外可见分光光度仪在波长415 nm处测定吸光度值[12-13]。以浓度(X,mg·mL-1)为横坐标,吸光度(Y)为纵坐标,绘制标准曲线,得线性回归方程。
2.1.4 总黄酮含量测定 取3 批根、茎、叶粉末,按“2.1.1”项下方法制备供试品溶液。精密吸取1 mL分别置于10 mL容量瓶,按照“2.1.3”项下方法测定待测液中总黄酮含量。将吸光度代入标准曲线的回归方程中,计算得出各部位总黄酮含量。
2.2 成分分析
2.2.1 供试品溶液的制备 精密称定霍山石斛根、茎、叶粉末各1 g,置于锥形瓶中,加入80%甲醇30 mL,室温浸泡30 min,称质量。超声(100 W、40 Hz)40 min,室温静置冷却。再称质量,用80%甲醇补足损失的质量,摇匀。重复3次后过滤,滤液用0.45 μm 微孔滤膜过滤,取续滤液,即得供试品溶液。
2.2.2 色谱条件 液相条件:色谱柱为Altima UHPLC C18色谱柱(250 mm×4.6 mm,5 μm);检测波长:335 nm;柱温:35 ℃;流速:0.9 mL·min-1;进样量:2 μL;流动相:0.4%甲酸(A)-甲醇(B),梯度洗脱:0~35 min,25%~45% B;35~50 min,45%~95% B;50~55 min,95%~95% B;55~56 min,95%~25% B;56~60 min,25%~25% B。
质谱条件:扫描范围(m/z):100~1 200;采用加热电喷雾离子化源(H-ESI),负离子模式下采集数据;毛细管电压2.5 kV;样品锥孔电压30 V;脱溶剂气温度500 ℃;锥孔气的流量50 L·h-1;脱溶剂气流量500 L·h-1;离子源温度100 ℃;碰撞能量6.0 eV;分析时间60 min。使用MassLynx V4.1 软件处理数据。
3 结果
3.1 线性关系考察按照“2.1.3”项下操作绘制芹菜素标准曲线,得到回归方程Y=18.316X+0.001 5,r=0.999 9,结果显示在0.009 6~0.038 mg·mL-1范围内呈良好的线性关系。
3.2 方法学考察
3.2.1 稳定性试验 精密称取霍山石斛叶粉末0.5 g,按“2.1.1”项方法下制备供试品溶液,分别在制备后间隔0、10、20、30、40、50、60、70 min 测定吸光度[14]。结果显示吸光度的RSD 为1.91%(n=8),表明样品在70 min内基本稳定。
3.2.2 精密度试验 精密吸取“2.1.1”项下霍山石斛叶供试品溶液,在波长415 nm 下连续进样6 次,分别测定吸光度。结果吸光度的RSD 为0.192%(n=6),表明该方法的精密度良好。
3.2.3 重复性试验 精密称取霍山石斛叶粉末0.5 g各6份,按“2.1.1”项下方法分别制备供试品溶液。精密吸取1 mL,于415 nm下测定吸光度。结果吸光度的RSD为2.55%(n=6),表明该方法重复性良好。
3.2.4 加样回收试验 精密称取已知含量的霍山石斛叶粉末0.5 g 各6 份,分别加入一定体积的芹菜素对照品溶液,按“2.1.1”项下方法制备溶液。精密吸取1 mL,按“2.1.3”项下方法测定吸光度。结果见表1。平均回收率为98.54%,RSD为1.10%(n=6)。
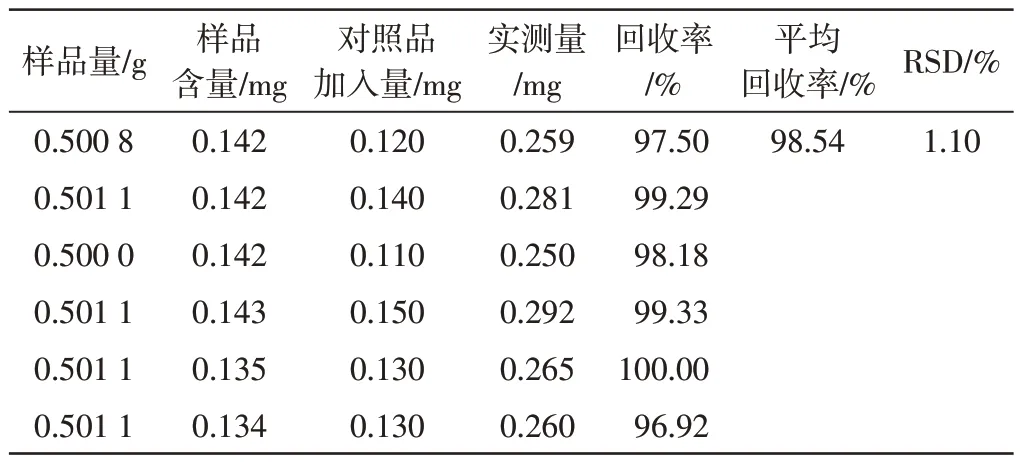
表1 霍山石斛总黄酮加样回收试验结果(n=6)Table 1 Results of recovery rate of total flavonoids in Dendrobium huoshanenese(n=6)
3.3 样品含量测定见图1。霍山石斛根、茎、叶3个部分总黄酮含量分别为0.477、0.630、2.06 mg·g-1。总黄酮在霍山石斛不同部位中的积累情况比较:叶>茎>根。其中,叶、茎部位总黄酮含量显著高于根部(P<0.05,P<0.01),叶中总黄酮含量又显著高于茎部(P<0.01)。

图1 霍山石斛根、茎、叶总黄酮含量比较(n=3)Figure 1 Comparison of total flavonoids contents in roots,stems and leaves of D. huoshanenese(n=3)
3.4 成分分析应用UHPLC-Q-TOF-MS 技术,使用负离子模式[15-16]进行扫描,根据保留时间、分子离子峰、主要碎片离子峰、裂解规律,并结合相关文献结果[17],最终在霍山石斛根、茎、叶中分别鉴定出53、61、68 种黄酮类化合物。霍山石斛根、茎、叶负离子模式下的总离子流图见图2。通过对霍山石斛的根、茎、叶中的黄酮类化合物进行鉴别,发现叶中的黄酮类化合物的数量是最多的。与叶相比,在根中未能鉴别出的化合物有15 种,分别是化合物34、53、56、37、65、67、68、57、62、63、64、66、40、49、60;在茎中未能鉴别出7种化合物,分别是化合物39、56、57、62、67、68、66。含量测定结果显示叶中总黄酮含量最高。因此,本研究重点阐述霍山石斛叶中黄酮类化合物的定性鉴别结果。见表2。

图2 霍山石斛根(A)、茎(B)、叶(C)负离子模式下总离子流图Figure 2 Total ion currents of D. Huoshanenese under negative ion mode in roots(A),stems(B)and leaves(C)

表2 霍山石斛叶的黄酮类成分鉴定结果Table 2 The identification results of flavonoid constituents in D. Huoshanenese leaves
3.5 化合物鉴定结果
3.5.1 黄酮氧苷类 在叶中鉴定出4 种黄酮氧苷类化合物,包括已被报道的柚皮苷、异鼠李素-3-O-β-D-葡萄糖苷、异鼠李素-3-O-β-D-芸香糖苷,以及推导得出的新橙皮苷。以化合物45新橙皮苷为例进行分析,保留时间17.16 min,母离子为m/z623 [M-H]-,可知其相对分子质量为624。推测其裂解途径为母离子失去一分子C14H28O72生成m/z315,表明该化合物的结构中有芸香糖基取代,其裂解规律与化合物异鼠李素-3-O-β-D-芸香糖苷相同。结合相关文献报道[18]推断,该化合物为异鼠李素-3-O-β-D-芸香糖苷的同分异构体新橙皮苷。其二级质谱图见图3,其余黄酮氧苷类化合物信息见表2。

图3 化合物45 的二级质谱图Figure 3 Secondary mass spectrum of compound 45
3.5.2 黄酮单糖碳苷 在叶中鉴定出7 种黄酮单糖碳苷类化合物。包括已经被报道的牡荆素-2”-O-鼠李糖苷、异牡荆素-2”-O-鼠李糖苷、金圣草黄素6-C-鼠李糖-(1→2)-六碳糖苷、芹菜素-8-C-鼠李糖-(1→2)-阿拉伯糖苷、芹菜素-6-C-β-D-鼠李糖-(1→2)-阿拉伯糖苷,以及推导得出的金圣草黄素-6-C-鼠李糖-(1→2)-五碳糖苷。以化合物53金圣草黄素-6-C-鼠李糖-(1→2)-五碳糖苷为例进行分析。化合物53 的保留时间20.72 min,母离子为m/z577[M-H]-,可知其相对分子质量为578。推测其裂解途径为母离子分别失去一分子C3H6O3、C6H12O5和C6H10O4,生成m/z487、m/z413 和m/z431,m/z431进一步失去一分子C3H6O3生成m/z341,脱去一分子C2H4O2和一分子H2O 生成m/z371 和m/z353。推断化合物53 为金圣草黄素-6-C-鼠李糖-(1→2)-五碳糖苷。其二级质谱图及可能的裂解过程见图4。其余未见报道的黄酮单糖碳苷化合物30、56信息见表2。

图4 化合物53 的二级质谱图(A)及可能的裂解途径(B)Figure 4 Secondary mass spectrum(A)and possible cleavage pathway(B)of compound 53
3.5.3 黄酮双糖碳苷 在叶中鉴定出57种黄酮单糖碳苷类化合物,推导得出可能的化合物共25 种,包括芹菜素-6,8-二-C-六碳糖苷、芹菜素-6-C-六碳糖-8-C-五碳糖苷、芹菜素-6,8-二-C-五碳糖苷、金圣草黄素-6,8-二-五碳糖苷等。以化合物33 芹菜素-6-C-鼠李糖-(1→2)-五碳糖-8-C-五碳糖苷为例进行分析。化合物33 的保留时间12.88 min,母离子为m/z679 [M-H]-,可知其相对分子质量为680。裂解途径为母离子分别失去一分子C3H6O3、C2H4O2和C6H12O5生成m/z619、m/z589和m/z515,m/z515 进一步失去一分子C3H6O3生成m/z425,m/z425 分别失去一分子C3H6O3和C2H4O2生成m/z335 和m/z365。推断化合物33 可能为芹菜素-6-C-鼠李糖-(1→2)-五碳糖-8-C-五碳糖苷。其二级质谱及可能的裂解途径见图5。其余未见报道的黄酮双糖碳苷化合物2、4、5、29、33、34、35、36、37、40、41、49、52、54、55、57、58、62、63、64、65、66、67、68 信息见表2。
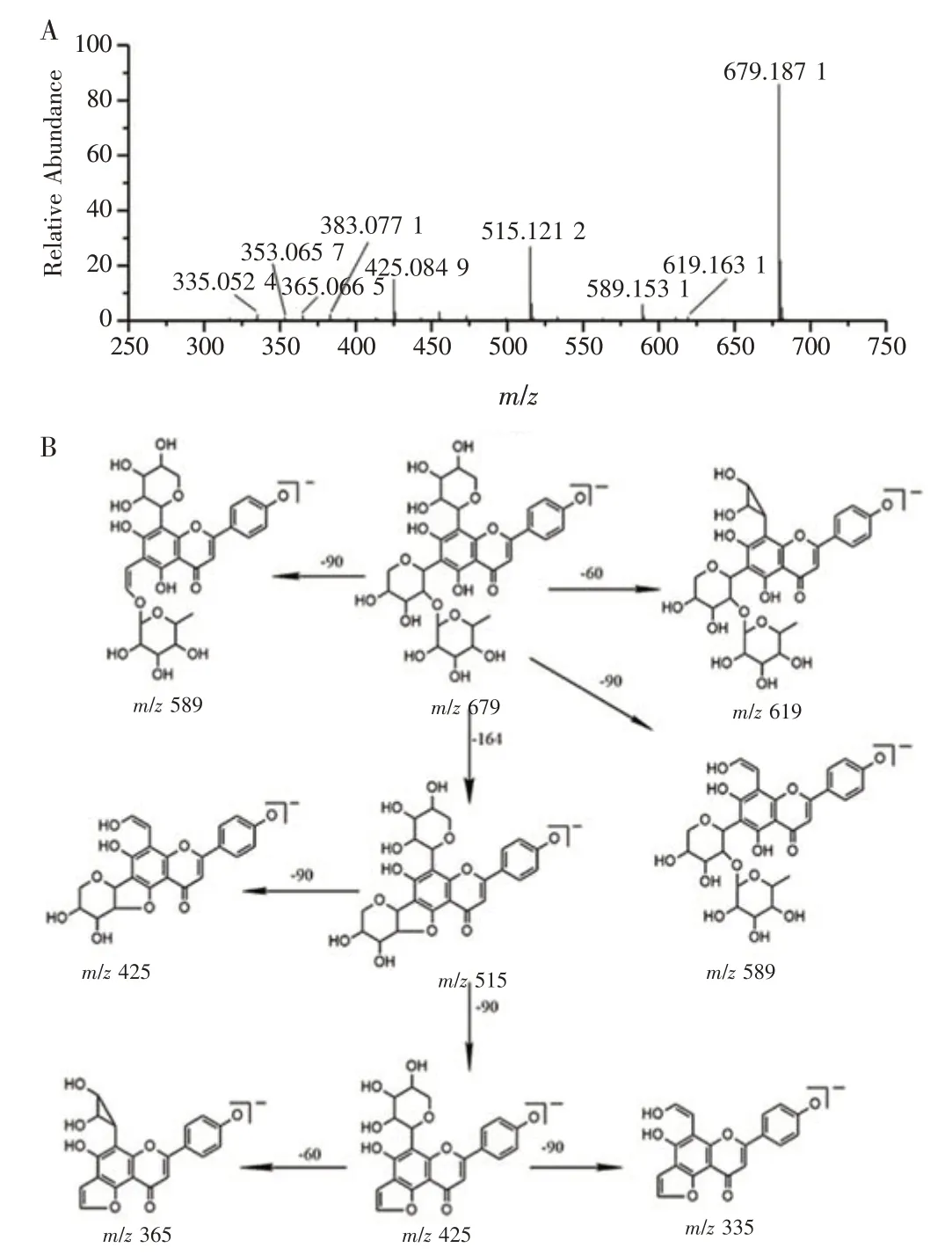
图5 化合物33 的二级质谱图(A)及可能裂解途径(B)Figure 5 Secondary mass spectrum(A)and possible cleavage pathway(B)of compound 33
4 讨论
本研究采用AlCl3比色法测定霍山石斛根、茎、叶3个部位黄酮类化合物的积累情况,结果显示不同部位中总黄酮的含量有显著性差异,黄酮的积累情况比较:叶>茎>根,且叶中总黄酮显著高于其他部位。通过UHPLC-Q-TOF-MS 对霍山石斛3 个部位黄酮类化合物进行定性鉴别分析,在负离子模式下叶中共鉴定出68 种黄酮类化合物、根53 种和茎61 种。在本研究中,从霍山石斛叶片中鉴定出68 种黄酮类化合物,其中64 种为黄酮碳苷,苷元主要有芹菜素、金圣草素及木犀草素。4种为黄酮氧苷,苷元为异鼠李素和柚皮素。连接糖基的类型有葡萄糖、鼠李糖、木糖、阿拉伯糖等。在68 种黄酮类化合物中,已有23 种在霍山石斛中被发现,如新西兰牡荆苷Ⅰ[19]、夏佛塔苷[20]、异夏佛塔苷等[21]。有16种在石斛的其他品种中已报道,但在霍山石斛中首次被发现,如新夏佛塔苷[22]、佛莱心苷[23]、异佛莱心苷[24]等。而根据裂解规律首次推导获得的29 种黄酮类化合物,如新橙皮苷、木犀草素-6-C-六碳糖-8-C-五碳糖苷等在霍山石斛的成分研究中尚未见报道。而新橙皮苷具有抗炎活性[25],木犀草素-6-C-六碳糖-8-C-五碳糖苷对肿瘤细胞具有抑制作用[26]。
本研究结果显示,与霍山石斛传统入药部位茎部相比,叶中的黄酮含量更高且数量更多,既丰富了霍山石斛黄酮类化合物的信息,也为减少霍山石斛加工过程中产生的资源浪费,提高非药用部位的利用,从而促进霍山石斛产业的绿色可持续发展奠定了理论基础。

