维生素D联合门冬胰岛素治疗妊娠糖尿病患者对胰岛素抵抗及母婴结局的影响
杨智敏,张艺羡,刘亚芬
福建医科大学附属漳州市医院药学部,福建漳州 363000
妊娠糖尿病(gestational diabetes mellitus, GDM)妊娠期首次出现的糖代谢异常疾病,可严重影响母体及胎儿健康[1-2]。GDM主要特征为胰岛素抵抗,临床上主要通过外源性补充胰岛素治疗,门冬胰岛素因其改善血糖效果明显,起效快已广泛使用[3]。近年有研究发现,GDM患者体内广泛缺乏维生素D,维生素D可保护胰岛细胞功能[4]。因此,本研究为探讨维生素D联合门冬胰岛素治疗GDM患者对胰岛素抵抗及母婴结局的影响,选取2022年1—8月到福建医科大学附属漳州市医院妇产科就诊的GDM患者94例为研究对象。现报道如下。
1 资料与方法
1.1 一般资料
选取到本院妇产科就诊的GDM患者94例为研究对象,根据治疗方案将患者分为观察组(n=47)和对照组(n=47),两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。本研究经过医院医学伦理委员会的批准,研究所选患者或家属知情同意。

表1 两组患者基线资料对比
1.2 纳入与排除标准
纳入标准:①符合《2019 SOGC 临床实践指南:妊娠期糖尿病》[5]相关诊断标准;②年龄20~40岁;③单胎产妇;④妊娠期间临床资料完整,有获得完整母婴结局。排除标准:①近1个月内接受过治疗者;②合并妊娠高血压者;③对本研究药物过敏者;④孕前糖尿病史者;⑤合并有免疫功能障碍者;⑥合并精神疾病或无法沟通者。
1.3 方法
两组均予以饮食、有氧运动及疾病相关知识教育等基础干预,对照组给予门冬胰岛素注射液(国药准字S20210040,规格:3 mL∶300 U)皮下注射治疗,初始剂量为0.2~0.3 U/(kg·d),晚餐前30 min空腹注射,1次/d,后根据患者血糖情况调整剂量,直至血糖恢复正常,连续给药4周。观察组在此基础上给予维生素D滴剂(国药准字H20113033,规格:400 U×24粒)治疗,口服,2粒/次,1次/d,连续给药4周,治疗期间连续检测孕妇血清25(OH)D3水平,以防止出现维生素D中毒。
1.4 观察指标
①血糖水平达标时间及胰岛素用量:统计给药后血糖水平达标时间及胰岛素用量。②血糖水平及糖化血红蛋白(glycosylated hemoglobin, HbA1c):分别于治疗前及治疗4周后取患者晨间空腹静脉血5 mL,离心并静置后取上层清液,室温20℃保存(8 h内使用完毕),采用高效液相色谱检测并记录空腹血糖(fasting plasma glucose, FPG)、餐后2 h血糖(2-hour postprandial blood glucose, 2 hPG)水平,使用离子交换层析法检测并记录HbA1c水平。③血清空腹胰岛素(fasting insulin, FINS)、HOMA胰岛素抵抗指数(HOMA-insulin resistance, HOMA-IR)及β细胞功能指数(homeostasis model assessment-β,HOMA-β)水平:取上述血清,使用购于上海酶联生物科技的ELISA试剂盒检测并记录FINS水平,根据已检测的FPG及FINS水平计算HOMA-β及HOMA-IR。④随访并记录母婴不良结局,包括羊水过多、胎膜早破、巨大儿、低血糖等。
1.5 统计方法
采用SPSS 20.0统计学软件分析数据。符合正态分布的计量资料用()表示,采用t检验;计数资料用例数(n)和率(%)表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者FPG达标时间、2 hPG达标时间、胰岛素用量比较
观察组FPG达标时间、2 hPG达标时间、胰岛素用量均优于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组患者FPG达标时间、2 hPG达标时间、胰岛素用量比较()
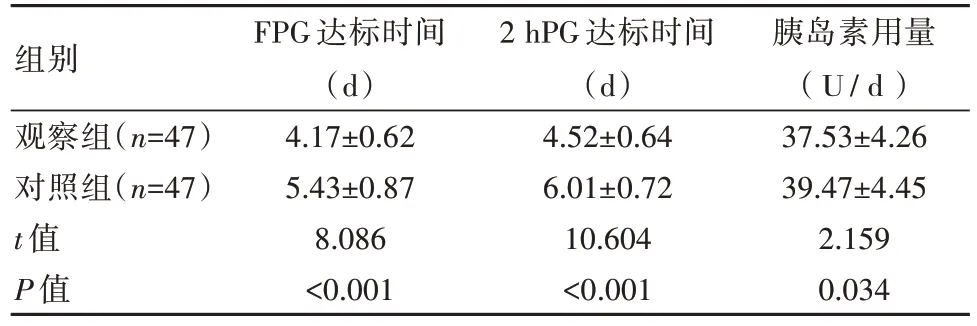
表2 两组患者FPG达标时间、2 hPG达标时间、胰岛素用量比较()
组别观察组(n=47)对照组(n=47)t值P值FPG达标时间(d)4.17±0.62 5.43±0.87 8.086<0.001 2 hPG达标时间(d)4.52±0.64 6.01±0.72 10.604<0.001胰岛素用量(U/d)37.53±4.26 39.47±4.45 2.159 0.034
2.2 两组患者血糖水平及HbAlc比较
治疗后,两组FPG、2 hPG、HbAlc均下降,观察组FPG、2 hPG、HbAlc均低于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患者血糖水平及HbAlc比较()
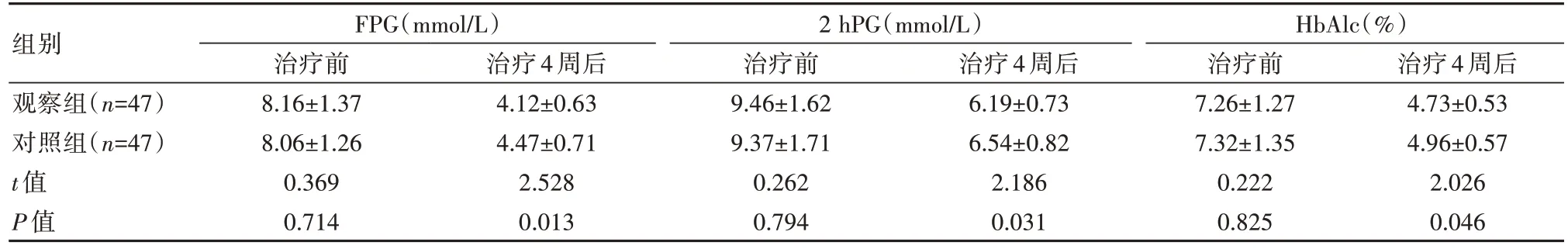
表3 两组患者血糖水平及HbAlc比较()
组别观察组(n=47)对照组(n=47)t值P值FPG(mmol/L)治疗前8.16±1.37 8.06±1.26 0.369 0.714治疗4周后4.12±0.63 4.47±0.71 2.528 0.013 2 hPG(mmol/L)治疗前9.46±1.62 9.37±1.71 0.262 0.794治疗4周后6.19±0.73 6.54±0.82 2.186 0.031 HbAlc(%)治疗前7.26±1.27 7.32±1.35 0.222 0.825治疗4周后4.73±0.53 4.96±0.57 2.026 0.046
2.3 两组患者血清FINS、HOMA-IR及HOMA-β水平比较
治疗后,两组FINS、HOMA-β水平均上升,HOMA-IR水平下降,观察组FINS、HOMA-β水平均高于对照组,HOMA-IR水平低于对照组,差异有统计学意义(P<0.05),见表4。
表4 两组患者血清FINS、HOMA-IR及HOMA-β水平比较()
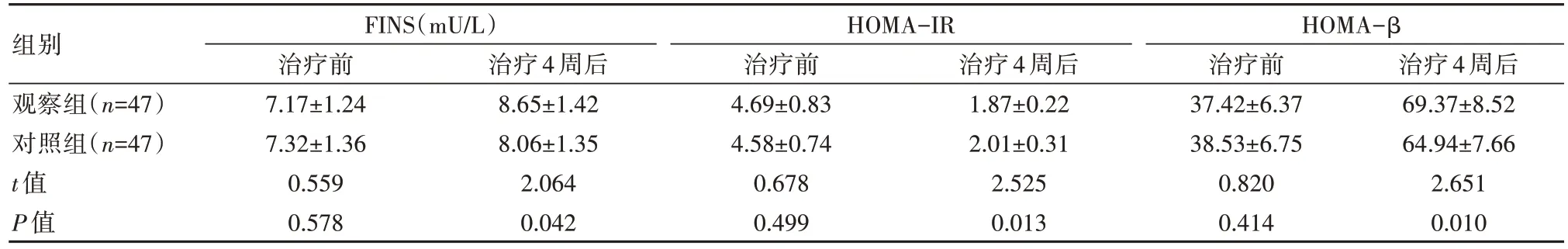
表4 两组患者血清FINS、HOMA-IR及HOMA-β水平比较()
组别观察组(n=47)对照组(n=47)t值P值FINS(mU/L)治疗前7.17±1.24 7.32±1.36 0.559 0.578 HOMA-IR治疗4周后8.65±1.42 8.06±1.35 2.064 0.042治疗前4.69±0.83 4.58±0.74 0.678 0.499治疗4周后1.87±0.22 2.01±0.31 2.525 0.013 HOMA-β治疗前37.42±6.37 38.53±6.75 0.820 0.414治疗4周后69.37±8.52 64.94±7.66 2.651 0.010
2.4 两组患者不良母婴结局发生情况比较
观察组不良母婴结局共计1例,胎膜早破1例(2.13%),不良母婴结局发生率为2.13%;对照组不良母婴结局共计8例,其中羊水过多2例(4.26%),胎膜早破2例(4.26%),巨大儿2例(4.26%),低血糖2例(4.26%),不良母婴结局发生率为17.02%,差异有统计学意义(χ2=3.416,P<0.05)。
3 讨论
GDM主要由于孕期孕激素等分泌异常增多,对胰岛素敏感度降低,导致糖代谢异常,产后可恢复,但部分患者最终会发展成2型糖尿病。妊娠期若未及时发现并给予降血糖治疗,会增加孕妇剖宫产、羊水过多及妊娠期高血压发生风险,同时还会增加围产儿巨大儿、死胎、畸形儿等不良母婴结局的风险,新生儿将来发生糖尿病、代谢异常的概率也会增加[6]。
目前主要通过饮食控制、有氧运动以及人工合成胰岛素治疗GDM,门冬胰岛素具有起效迅速、应用方便、餐后血糖控制效果好等优势,但单一使用孕妇易出现低血糖症状,此外,存在胰岛素抵抗的患者疗效不明显,需与其他药物联合使用减少不良反应[7]。维生素D可促进胰岛β细胞分泌,增强胰岛素敏感性,降低胰岛素抵抗程度[4]。FPG及2 hPG是最常用的糖尿病检测指标,HbAlc可反映过去8~12周血糖平均水平,HbAlc越高,GDM患者不良母婴结局风险越大[8]。本研究中,治疗后观察组FPG、2 hPG、HbAlc、胰岛素用量优于对照组,FPG达标时间、2 hPG达标时间均短于对照组,观察组不良母婴结局发生率(2.13%)低于对照组(17.02%)(P<0.05),结果表明维生素D联合门冬胰岛素可改善GDM患者血糖代谢水平,降血糖效果显著,这与维生素D可增加外周组织敏感性,增加胰岛素受体及胰岛素分子工作效率,提高葡萄糖转运效率同时抑制肝脏葡萄糖的释放有关,与黄香坤等[9]研究一致。
GDM发生及发展的根本原因在于患者机体内发生胰岛素抵抗和胰岛β细胞分泌异常,胰岛素主要由胰岛β细胞分泌,FINS可反映胰岛β细胞分泌功能,HOMA-IR主要反映胰岛素抵抗程度,其数值越大,胰岛素抵抗越严重,HOMA-β可反映胰岛β细胞活性,其数值越大,胰岛β细胞活性越高[10]。薄琦[11]发现,胰岛β细胞中存在维生素D受体,高浓度维生素D可促进胰岛素受体表达。本研究中,观察组FINS、HOMA-β水平均高于对照组,HOMA-IR水平低于对照组(P<0.05),结果表明维生素D联合门冬胰岛素可程度减轻胰岛素抵抗程度,增加胰岛β细胞分泌活性,这与维生素D的作用机制有关,维生素D可通过抑制过氧化物的生成提高胰岛素敏感程度,调节钙离子流动性结合胰岛β细胞上的自身受体增加胰岛β细胞活性,促进胰岛素的分泌,同时还可促进过氧化物的表达,降低胰岛素的抵抗作用。崔广树等[12]发现,高剂量维生素D可减轻胰岛素抵抗程度,改善血糖控制效果,本研究与其一致。
综上所述,维生素D联合门冬胰岛素可提高GDM患者降血糖效果,减轻胰岛素抵抗程度,改善母婴结局。

