甘肃省大白菜叶斑病菌分离鉴定及生物学特性测定
王一丹,魏立娟,杨成德
(甘肃农业大学 植物保护学院,甘肃省农作物病虫害生物防治工程实验室,兰州 730070)
大白菜(Brassicapekinensis)属于十字花科芸薹属两年生草本植物,又称结球白菜和黄芽菜,味道鲜美可口,营养丰富,含有丰富的粗纤维,食用方法多种多样,并且具有益胃生津,清热除烦的功能。大白菜原产于中国北方地区,是农民秋季收入的重要来源,其种植面积和消费量在国内居各类蔬菜之首,19世纪传入日本、东南亚和欧洲各国[1]。近年来,由于人们对大白菜需求的不断增长,常连作种植,导致多种病害加重发生。目前报道的大白菜病害有立枯丝核菌(Rhizoctoniasolani)引起的大白菜褐腐病(茎基腐病)[2],链格孢属真菌(Alternariaspp)引起的大白菜黑斑病,野油菜黄单胞菌(Xanthomonasecampestris)引起的大白菜黑腐病,大丽轮枝菌(Verticilliumdahliae)引起的大白菜黄萎病[3],丁香假单孢菌(Pseudomonassyringae)引起的大白菜细菌性角斑病等[4]。这些病害的发生严重影响了大白菜的产量和品质,阻碍了大白菜产业的发展。
油菜黑胫病菌是一种真菌性病害,被分为高毒力强侵染型的Leptosphaeriamaculans和低毒力弱侵染型的Leptosphaeriabiglobosa[5]。研究表明,这两个复合体是独立的Leptosphaeria种[6-7],其中L.maculans致病力强,主要分布于西欧,北美洲,南美洲和澳大利亚,在亚洲和俄罗斯还未发现[5,8]。因此,为了防止由L.maculans引起的油菜茎基溃疡病传入中国,将其列为检疫性病害[9]。相对于L.maculans而言,L.biglobosa的致病力较弱,最先于欧洲,北美等地发现,危害范围非常广泛,在世界各地均有分布,在一定条件下会造成产量和经济损失[5, 10-11],其主要侵染十字花科芸薹属,豆科菜豆属、桑科葎草属和龙胆科獐牙菜等[12]。Cai等[13]的研究表明,在中国L.biglobosa只侵染十字花科植物,如萝卜、红菜薹、甘蓝和油菜等,其中油菜是被侵染最严重的植物[14]。由L.biglobosa引起的油菜黑胫病在中国的油菜产区分布非常广泛,造成其产量下降[15-16],如荣松柏等[17]报道L.biglobosa导致油菜籽产量下降10%~50%。但目前还没有关于L.biglobosa引起大白菜病害的报道。因此,对采自甘肃省陇南市武都区的叶斑病标本进行病原菌的分离、致病性测定和鉴定,并测定生物学特性,以期明确武都区大白菜叶斑病的病原种类及生物学特性,为该病害的诊断和综合防治提供依据。
1 材料与方法
1.1 试验材料
1.1.1 供试样本 于2018年10月在甘肃省陇南市武都区采集的具有明显叶斑症状的大白菜叶片。
1.1.2 供试培养基 PDA培养基、PSA培养基、Czapek培养基、NA培养基、SA培养基、SDA培养基和RBA培养基,参考文献[18]配置。
自行设计的培养基包括:PDA和白菜叶汁液混合培养基(葡萄糖15 g,土豆200 g,琼脂15 g,白菜叶汁液,加水至1 000 mL)及PSA和大白菜叶汁液混合培养基(蔗糖15 g,土豆200 g,琼脂15 g,大白菜叶汁液,加水至1 000 mL)。
1.2 病原菌的分离
采用组织分离法[18]。将具有典型叶斑病症状的大白菜叶片于病健交界处切成1 cm×1 cm的小方块,在75%乙醇中消毒1 min后,用无菌蒸馏水冲洗3次,再用无菌滤纸吸干水分后,置于PDA培养基上,25 ℃培养36~72 h,挑取病组织周围的菌丝进行纯化,获得纯培养的分离物,将其命名并转接于PDA斜面上置于4 ℃冰箱中保存,备用。
1.3 致病性测定
将所得分离物接种于PDA培养基,25 ℃培养7 d后用无菌蒸馏水配制孢子悬浮液,孢子浓度达5×106mL-1。用无菌水清洗大白菜叶片并用无菌针头在大白菜叶片表面造成微伤口,将孢子悬浮液喷洒于伤口处,以无菌水为对照[19], 3次重复,置于25 ℃、湿度大于80%的人工气候室中培养48 h后,置于室内观察发病情况。待大白菜出现明显叶斑症状时,重新分离病原菌。
1.4 病原菌的鉴定
1.4.1 形态学鉴定 将所获得的致病菌株转接于PDA培养基上,25 ℃黑暗培养7 d后,观察菌落颜色和形态,在光学显微镜(Axio Lab.A1, Carl Zeiss, Germany)下观察菌丝、分生孢子和分生孢子器的形态特征并测量分生孢子和分生孢子器大小(n=50)。
1.4.2 特异性基因序列鉴定 基因组DNA的提取:将致病菌株转接于PDA培养基,25 ℃黑暗培养,当菌落生长到接近培养皿边缘时,从菌落表面刮取菌丝体,并在加有液氮的无菌研钵中快速冷冻和研磨,后按照OMEGA BIO-TEX DNA试剂盒的说明提取基因组DNA, -20 ℃保存,备用。
PCR扩增:使用通用引物ITS(序列为:ITS15′-TCC GTA GGT GAA CCT GCG-3′,ITS45′-TCC TCC GCT TAT TGA TAT GC-3′)[20],特异性引物Actin(序列为:ActinF5′-GAG CAG GAG ATC CAG ACT GC-3′,ActinR5′-TTC GAG ATC CAC ATC TGC TG-3′)和β-tubulin(序列为:β-tubulinF5′-GTC GAG AAC TCC GAC GAG AC-3′,β-tubulinR5′-ATC TGG TCC TCG ACC TCC TT-3′)[21]进行PCR扩增(引物合成由西安擎科生物有限公司 完成)。
PCR反应体系如下:ITS的反应体系为:Mix(2×)10 μL,ITS1和ITS4(10 μmol/L)各 0.5 μL,模板DNA 1 μL,ddH2O 8 μL。PCR扩增程序为:预变性95 ℃ 5 min;变性95 ℃ 30 s,退火54 ℃ 30 s,延伸72 ℃ 1 min,30个循环;再延伸72 ℃ 7 min,4 ℃保存。特异性引物Actin的反应体系为:Mix(2×)10 μL,ActinF和ActinR(10 μmol/L)各0.5 μL,模板DNA 1 μL,ddH2O 8 μL。PCR扩增程序为:预变性94 ℃ 5 min;变性94 ℃ 30 s,退火55 ℃ 30 s,延伸 72 ℃ 1 min,35个循环;再延伸72 ℃ 10 min, 4 ℃保存。β-tubulin的反应体系为:Mix(2×) 10 μL,β-tubulinF和β-tubulinR(10 μmol/L)各 0.5 μL,模板DNA 1 μL,ddH2O 8 μL。PCR扩增程序为:预变性 94 ℃ 5 min;变性94 ℃ 30 s,退火 55 ℃ 30 s,延伸72 ℃ 1 min,35个循环;再延伸72 ℃ 10 min,4 ℃保存。
扩增后取6 μL PCR产物进行1%琼脂糖凝胶电泳检测,将产生特异性条带的PCR产物送往西安擎科生物有限公司进行测序。将所得序列提交至NCBI的GenBank中进行Blast比较,筛选出与病原菌高度相似的基因序列,用Mega(7.0)软件中的邻接法构建系统发育树,确定病原菌的分类地位。
1.5 生物学特性的测定
1.5.1 培养基对菌丝生长的影响 选用PDA+大白菜叶汁液、PSA+大白菜叶汁液、PDA、PSA、Czapek、NA、SA、SDA和RBA培养基,将致病菌株接种于培养基中央,每种培养基重复3次,在25 ℃恒温培养箱黑暗培养 7 d,采用十字交叉法测量菌落直径。
1.5.2 温度对菌丝生长和孢子萌发的影响 将病原菌接种于PDA培养基中央,在不同温度 (5 ℃、10 ℃、15 ℃、20 ℃、25 ℃、30 ℃、35 ℃、 40 ℃)下培养,每个温度重复3次。25 ℃黑暗培养 7 d后,采用十字交叉法测量菌落直径,使用悬滴法计算孢子萌发率,每2 h记录1次,直到孢子萌发率达到90%[18]。
1.5.3 pH对菌丝生长和孢子萌发的影响 将致病菌株接种于不同pH(4.0, 5.0, 6.0, 7.0, 8.0, 9.0和10.0)的PDA平板上,重复3次,并在25 ℃的恒温培养箱黑暗培养7 d。其余方法同“1.5.2”。
1.5.4 碳源对菌丝生长和孢子萌发的影响 将Czapek培养基作为基础培养基,分别用蔗糖、D-果糖、葡萄糖、乳糖、麦芽糖、可溶性淀粉、L-鼠李糖、木糖、L-阿拉伯糖、甘露醇和棉子糖替换基础碳源,重复3次,并在25 ℃下培养7 d。其余方法同“1.5.2”。
1.5.5 氮源对菌丝生长和孢子萌发的影响 Czapek培养基作为基础培养基,分别将硝酸钾、硝酸钠、蛋白胨、酵母膏、甘氨酸、脯氨酸、氯化铵、磷酸氢二铵、组氨酸、尿素、硝酸铵、酵母浸粉和亚硝酸钠作为替换氮源,重复3次,并在25 ℃下培养7 d。其余方法同“1.5.2”。
1.5.6 数据分析 IBM SPSS Statistics 25,采用最小显著性差异(LSD)法检验差异的显著性 (P<0.05);Microsoft Office Excel 2019用于数据的图形表示;MEGA 7.0用于建立系统发育树。
2 结果与分析
2.1 大白菜叶斑病的症状
大白菜叶斑病主要危害白菜的叶片,在叶片表面形成圆形和不规则的病斑,边缘明显。病斑为灰色或灰白色,且密布黑色小点(分生孢子器)(图1)。

图1 大白菜叶斑病的田间症状Fig.1 Field symptoms of leaf spot on Brassica pekinensis
2.2 病原菌的分离和致病性测定
采用组织分离法得到8株分离物,分别编号为BCA、BCB、BCC、BCD、BCE、BCF、BCG和BCH。经致病性测定,只有编号为BCG的分离物可以引起与田间病害相似的症状,接种7 d后开始发病,叶片上出现褐色小斑点,14 d后褐色小点逐渐扩展为不规则病斑,边缘明显呈黑褐色,中央为灰白色,30 d后,病斑扩大至整个叶面,边缘明显且病斑中央有黑色小点,与田间发病症状基本一致,且再次分离得到与分离物BCG形态特征一致的分离物,但对照未发病,说明分离物BCG为大白菜叶斑病的病原菌(图2)。

a.接种7 d的发病症状;b.接种14 d的发病症状;c.接种30 d的发病症状;d.CK(无菌水处理)
2.3 病原菌的鉴定
2.3.1 形态特征观察 病原菌BCG菌落呈圆形,中央扁平,呈褐色,边缘白色绒毛状,气生菌丝发达;菌落底部产生黄褐色色素并从中心向四周扩散(图3-a)。当培养一段时间后,气生菌丝上会产生大小不一致的黄色或红棕色液珠(图3-c)。在PDA培养基上大量产生分生孢子,单细胞,壁光滑,透明,梭形或圆柱形,具油球且分生孢子两端逐渐变细(图3-d),大小为(1.56~ 2.77)μm×(3.23~6.10)μm,分生孢子器扁平,深褐色(图3-e),大小为204.20 μm×140.88 μm。其形态特征均与L.biglobosa[20]相似。
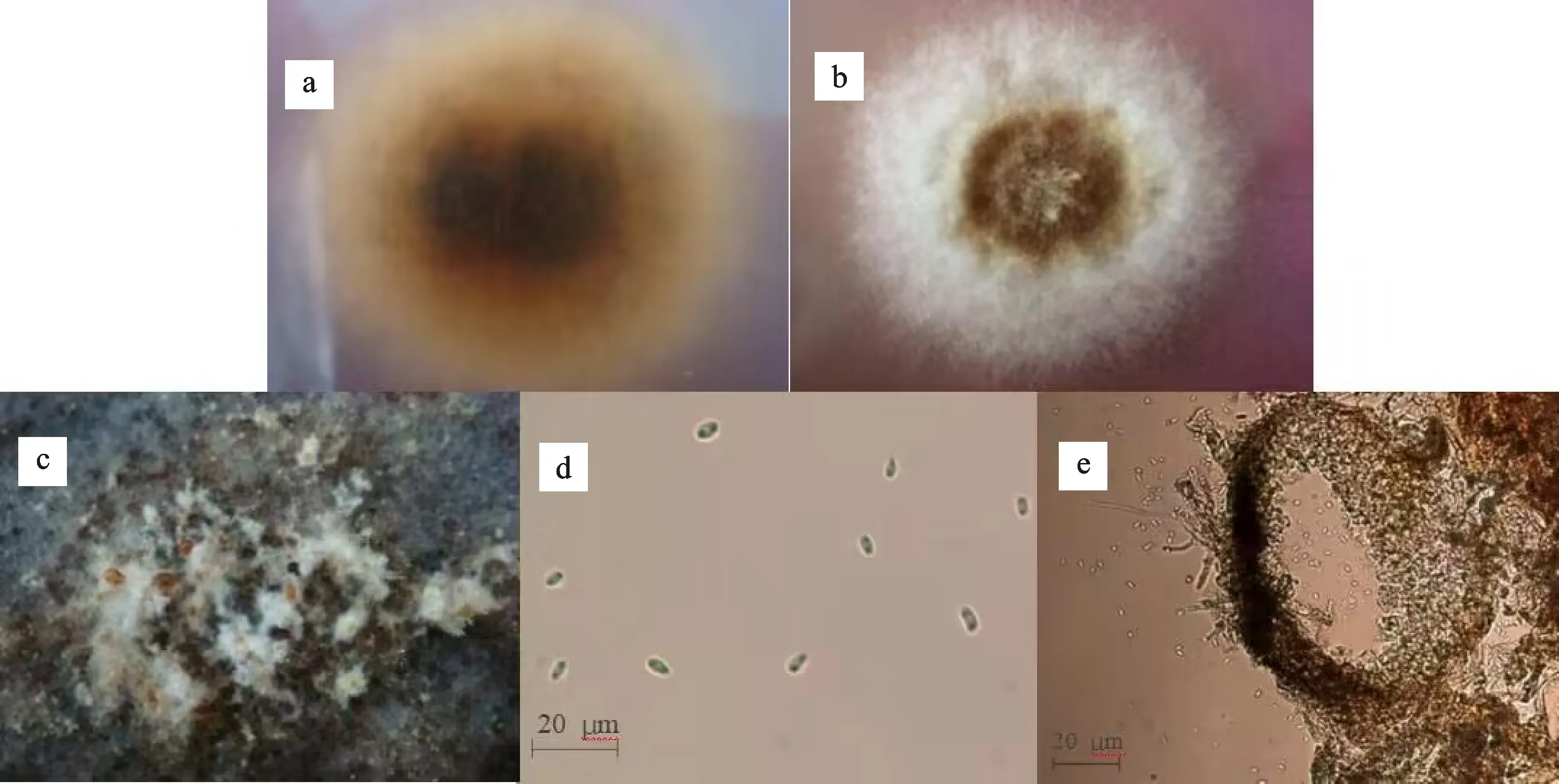
a.BCG菌落背面;b.BCG菌落正面;c.BCG菌丝上的黄色和红棕色的液珠;d.BCG分生孢子形态;e.BCG分生孢子器形态
2.3.2 特异性基因序列分析 以菌株BCG的总DNA为模板,使用通用引物ITS、特异性引物Actin和β-tubulin基因序列进行扩增和测序,分别得到大小为578 bp、446 bp和471 bp的基因片段(登录号:MW357737,MW524113和MW524114),将所得序列提交至GenBank中进行比对并构建多位点系统发育树(表1)。结果表明,菌株BCG与L.biglobosabrassicae(Lb1129)聚在一起,其bookstrap值为99(图4),结合形态特征将菌株BCG鉴定为油菜黑胫病菌(L.biglobosa)。
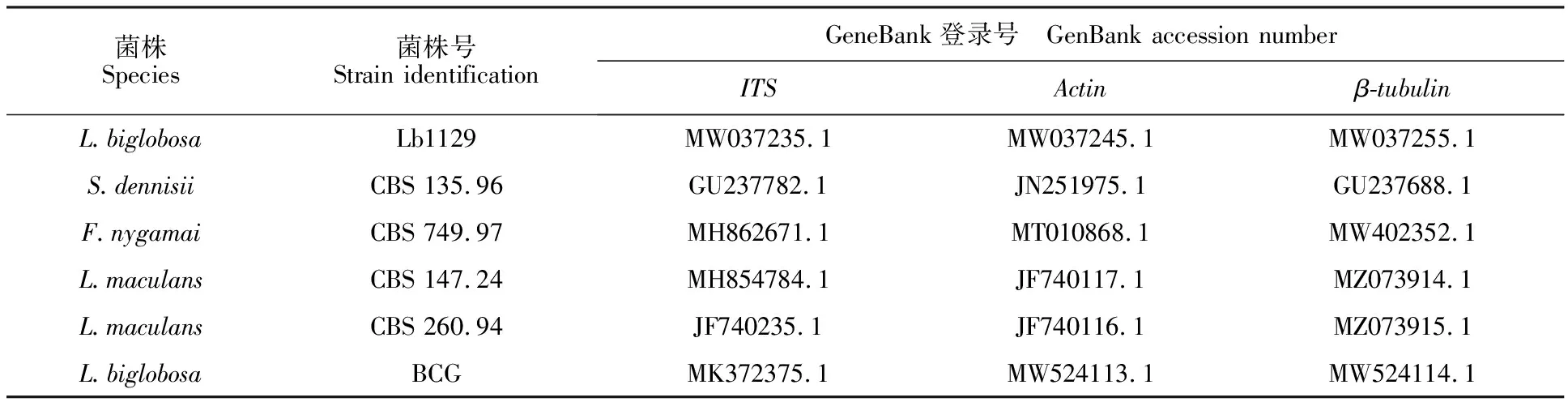
表1 油菜黑胫病菌的多位点系统发育分析登录号Table 1 L.biglobosa used in multilocus phylogenetic analysis and their GenBank accession numbers

图4 基于ITS、Actin和β-tubulin的多位点系统发育树Fig.4 Phylogenetic tree based on ITS,Actin and β-tubulin multilocus phylogenetic analysis sequences
2.4 生物学特性测定
2.4.1 培养基对菌丝生长的影响 病原菌BCG在9种供试培养基上均能生长,且在PDA培养基上菌丝生长最好,菌落直径最大,达6.17 cm,显著高于其他培养基(P<0.05);供试培养基为SDA时,菌丝生长稀疏、缓慢,菌落直径最小,仅为3.30 cm,显著低于其他培养基(P<0.05),说明菌株BCG生长最适培养基为PDA(图5)。
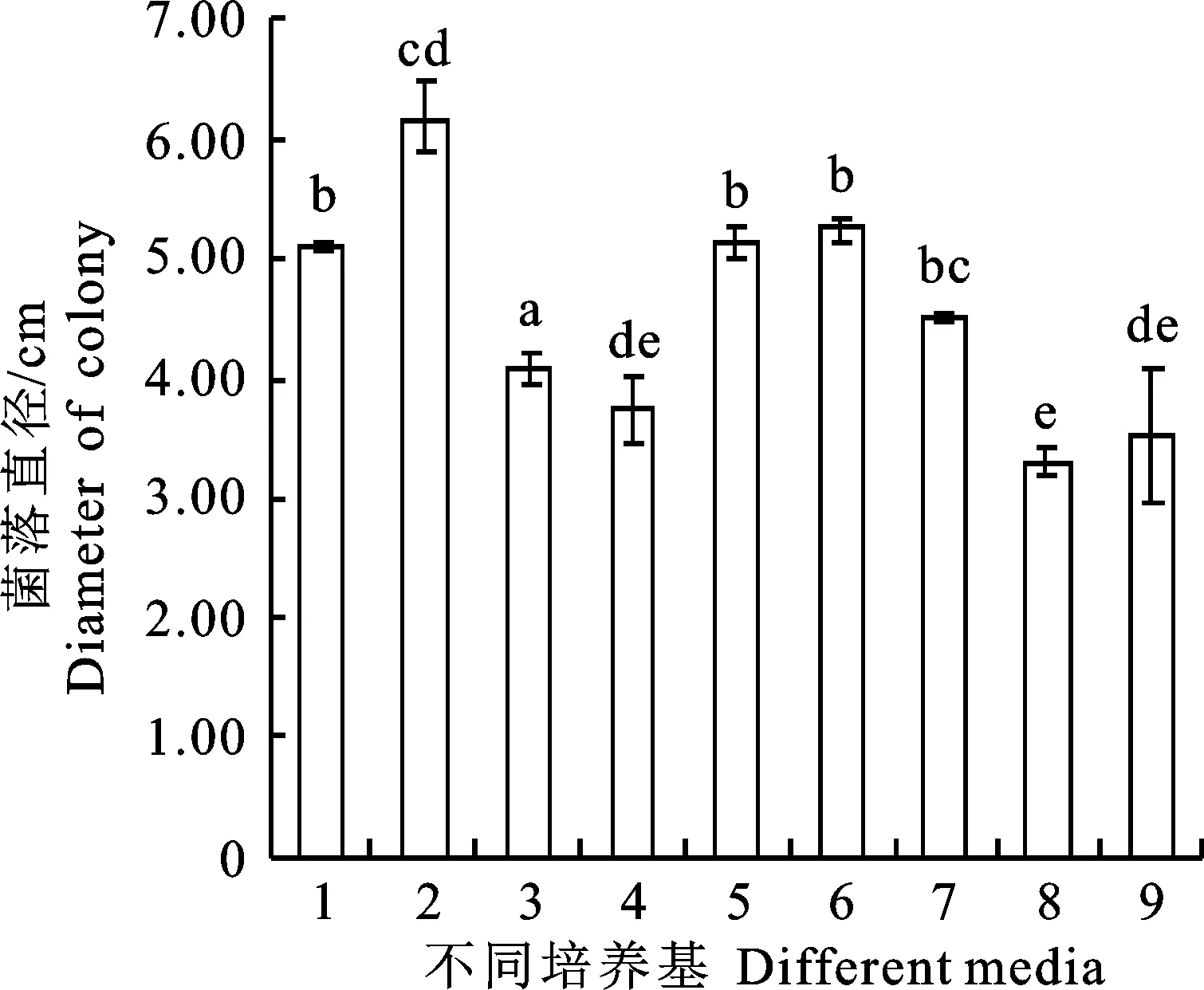
标不同小写字母者表示样本间显著差异(P<0.05),下同。1.马铃薯葡萄糖琼脂培养基+大白菜叶汁液;2.马铃薯葡萄糖琼脂培养基;3.马铃薯蔗糖琼脂 培养基+大白菜叶汁液;4.马铃薯蔗糖琼脂培养基;5.察氏培养基;6.牛肉膏蛋白胨琼脂培养基; 7.淀粉琼脂培养基;8.萨布培养基;9.虎红琼脂培养基
2.4.2 温度对菌丝生长和孢子萌发的影响 在10~35 ℃的温度范围内均能生长,5 ℃和40 ℃时不生长,在25 ℃时菌落直径最大,为4.53 cm,显著高于其他处理(P<0.05)(图6-A),表明菌丝生长的最适温度为25 ℃。在20 ℃时孢子的萌发率达98%(图6-B),显著高于其他温度(P< 0.05),说明孢子萌发的最佳温度为20 ℃。
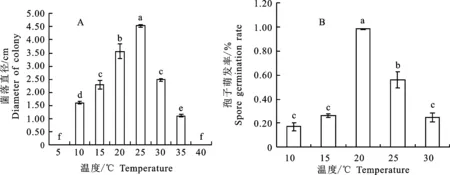
图6 温度对菌株BCG生长和孢子萌发的影响Fig.6 Effect of temperature colony size and spore germination rate of strain BCG
2.4.3 pH对菌丝生长和孢子萌发的影响 病原菌BCG在pH为5.0~10.0的条件下,其菌丝和孢子均能正常生长和萌发。在pH为6.0时,菌落直径最大,达4.75 cm,在pH为10.0时,菌落直径最小,仅为3.30 cm,差异显著(P< 0.05),当pH为5.0~8.0时差异不显著(P< 0.05)(图7-A),但当pH为6.0时,孢子萌发率最高,达80%(图7-B),说明菌丝生长和孢子萌发最适宜的pH为6.0。
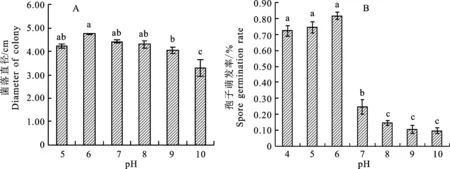
图7 pH对菌株BCG生长和孢子萌发的影响Fig.7 Effect of pH on colony size and spore germination rate of strain BCG
2.4.4 碳源对菌丝生长和孢子萌发的影响 以L-阿拉伯糖、L-鼠李糖和木糖作为碳源时,菌株BCG生长最快,菌落直径达4.7 cm,显著高于其他碳源(P<0.05)(图8-A)。以甘露醇为碳源时孢子萌发率达90%,显著高于其他处理(P< 0.05)(图8-B),表明菌株BCG生长的最适碳源为L-阿拉伯糖、L-鼠李糖和木糖,孢子萌发的最适碳源为甘露醇。

A:1.可溶性淀粉;2.蔗糖;3.葡糖糖;4.乳糖;5.麦芽糖;6.甘露醇;7.L-阿拉伯糖;8.L-鼠李糖;9.D-果糖;10.木糖
2.4.5 氮源对菌丝生长和孢子萌发率的影响 以酵母浸粉为氮源时,菌株BCG生长最快,菌落直径达4.75 cm;以硝酸钾为氮源时,菌丝生长最慢,菌落直径仅为1.27 cm,显著低于其他氮源(P<0.05)(图9-A)。以尿素为氮源时萌发率最高,达73%(图9-B),显著高于其他处理(P< 0.05),表明菌株BCG菌丝生长的最适氮源为酵母浸粉,孢子萌发的最适氮源为尿素。
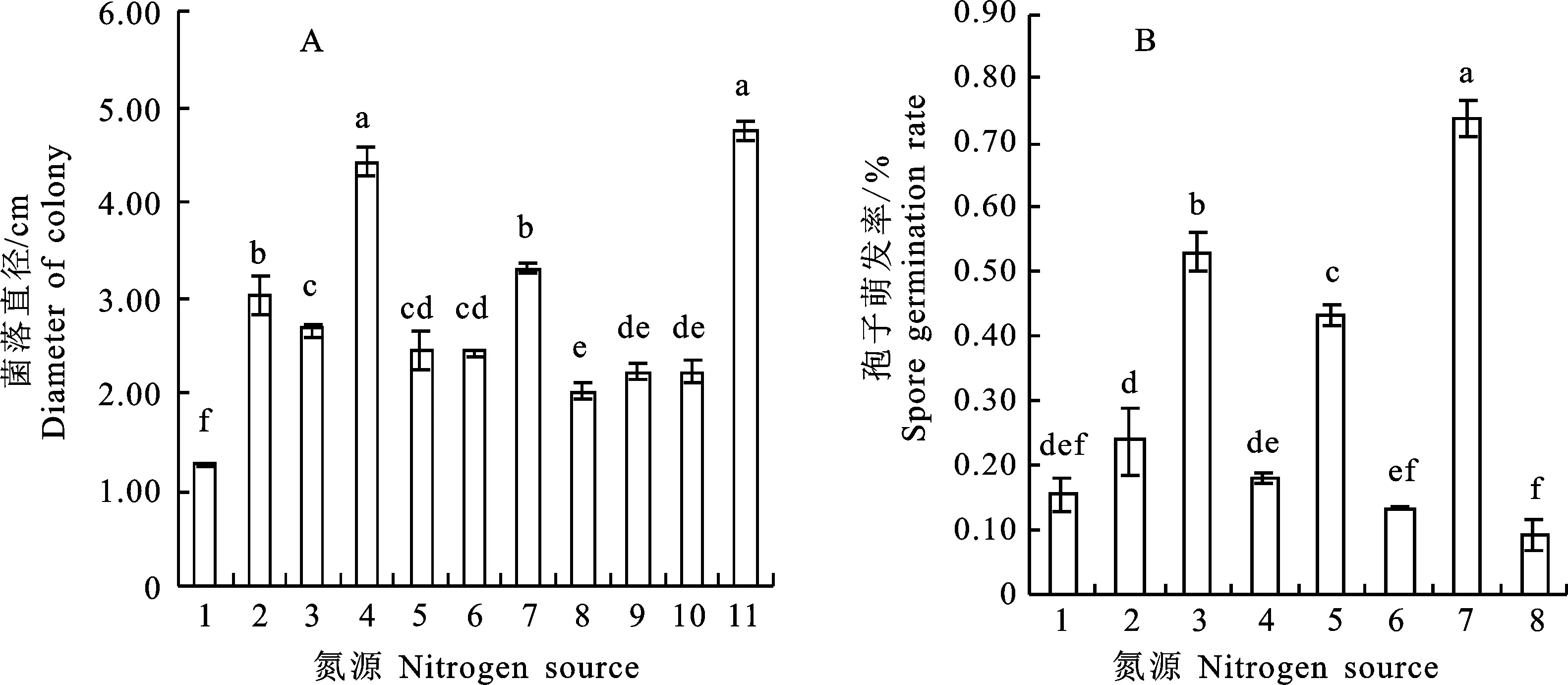
A:1.硝酸钾;2.酵母膏;3.甘氨酸;4.蛋白胨;5.组氨酸;6.脯氨酸;7.尿素;8.磷酸氢二铵;9.氯化铵;10.硝酸铵;11.酵母浸粉
3 讨 论
油菜黑胫病(L.biglobosa)是危害十字花科的重要病害之一,主要侵染寄主植物的叶片和茎秆。在甘肃省陇南市发现的大白菜标本上,其病斑症状与杨龙等[22]所报道的由L.biglobosa引起油菜叶片上的病斑症状相似,均产生了具有明显边界的枯死斑且病斑上有小黑点,但是病斑颜色稍有区别,油菜叶片病斑呈黄褐色,而大白菜叶片病斑呈灰白色,这可能是由于寄主植物、发病程度和环境的不同所导致。本试验中,分离物BCG在致病性测试中其发病症状与田间采集症状基本一致,并再次分离得到接种物,其菌落特征与Deng等[23]所报道的基本一致,分生孢子器和分生孢子形态与宋培玲等[24]所报道一致, 因此将菌株BCG初步鉴定为L.biglobosa。一般研究者仅依靠形态学特征很难将病原菌准确鉴定到种,随着分子生物学技术的发展,为了更准确鉴定病原菌,通常将PCR技术和多基因鉴定方法用于复杂物种的鉴定,可以根据其亲缘关系快速鉴定物种[25-27]。本试验采用通用引物ITS,特异性引物Actin和β-tubulin进行测序,将所得序列进行多基因比对并构建系统发育树,结合形态特征将菌株BCG鉴定为油菜黑胫病菌(L.biglobosa)。
生物学测定结果表明,菌株BCG于供试的9种培养基上均能正常生长,表明供试培养基类型不影响其生长。此外,菌株BCG在10~35 ℃均可生长,其最适温度为25 ℃,与郝丽芬等[28]的报道一致;菌株BCG在pH 5.0~10.0均可生长,且在pH为5.0~8.0时差异不显著(P<0.05),说明菌株BCG具有较强的pH适应性,在弱酸至中性再至弱碱环境中均可正常生长。另外,菌株BCG的最适pH、最适碳源和最适氮源与郝丽芬等[28]的报道有所差异,可能由于地理位置、寄主和自然环境的不同,导致菌株的适应性不同,使得其生物学特性存在差异。
本试验通过分离与鉴定,确定了引起甘肃省大白菜叶斑病的病原菌为油菜黑胫病菌(L.biglobosa),为国内首次证实由L.biglobosa引起大白菜叶斑病,并对该病原菌进行了生物学特性测定,为该病害的诊断和综合防治提供了依据。

