甘肃省黄芩白粉病病原鉴定及对黄芩叶片生理特性的影响
蒋晶晶,陈爱昌,杜 蕙,李继平,李雪萍,漆永红
(1.甘肃省农业科学院 植物保护研究所,兰州 730070;2.定西市植保植检站,甘肃定西 743000)
黄芩(ScutellariabaicalensisGeorgi)为唇形科(Labiatae)黄芩属(Scutellaria)多年生草本植物,以根入药,味苦,性寒,有消炎、健胃、清凉、解热等功效[1]。黄芩主产于中国北方的甘肃、陕西、山西、河北、内蒙、吉林等省[2]。近年来,由于市场需求量的增加,黄芩种植面积逐年扩大,连年种植导致连作障碍凸显,生产上黄芩病害明显加重。甘肃省农业科学院植物保护研究所经济作物病害研究室于2020-2021年7-8月在甘肃省定西市陇西县对黄芩病害进行调查时发现,白粉病病田率达60%,病株率达80%~100%。田间大面积黄芩叶片普遍初生白色小粉状斑,随病情加重逐渐扩大呈不规则粉状斑,严重时白粉病菌覆盖叶片正反两面,后期白粉斑中产生黄褐色或黑色小颗粒物,导致整个植株光合作用受阻,严重影响黄芩的产量和品质。
国内对黄芩白粉病的研究较少,陈秀蓉[3]对黄芩白粉病的发病症状、病原、发生条件和防治技术进行了研究,同时报道了该病害的病原菌为真菌界白粉菌属(Erysiphesp.);陈君等[4]研究发现,黄芩白粉病的病原菌为白粉菌属(Erysiphesp.)二孢白粉菌(Erysiphecichoracearum),它的无性世代为粉孢属(Oidiumsp.)脉革粉孢菌(Oidiumambrosiae);常瑾等[5]报道,引起陕西黄芩白粉病的病原菌为白粉菌属(Erysiphesp.)真菌,病菌以闭囊壳在田间病残体上越冬,6-8月为发病盛期;Zhang等[6]对河北承德黄芩白粉病的发生规律及防治进行了研究,病原菌形态学鉴定为白粉菌属(Erysiphesp.)蓼白粉菌(Erysiphepolygoni),上述研究均是通过形态学特征进行黄芩白粉病病原菌鉴定,但关于甘肃黄芩该病害病原菌分子生物学特征的研究和鉴定鲜见报道。因此,本试验结合形态学和rDNA-ITS序列分析技术对甘肃省黄芩白粉病的病原菌进行鉴定,旨在明确该病害的病原菌种类,为科学诊断、研究发生规律和田间绿色防控提供科学依据;同时,测定白粉病对黄芩叶片叶绿素、电解质渗漏电导率、主要营养元素和微量元素含量的影响,为明确白粉病菌对黄芩胁迫的响应机制提供理论依据。
1 材料与方法
1.1 试验材料
2020-2021年7-8月,在甘肃省定西市陇西县黄芩主产区白粉病严重发生的田块,观察并记录病害相关的症状,采集病症明显的病枝将其置于保鲜袋中,保持新鲜状态,及时带回实验室,编号以BF表示(表1),共获得8份病样。

表1 黄芩白粉病样品采集地Table 1 Sample collection of Scutellaria baicalensis powdery mildew
1.2 病原菌分离纯化及致病性测定
在采集的田间发病黄芩叶片上选取典型的白粉病病斑,将附着新鲜白粉病菌分生孢子的叶片置于待接种温室培育的黄芩苗叶片上方4~7 cm处,轻轻刮取并振动叶片,使孢子抖落在黄芩幼苗叶片上。5 min后在花盆上方50 cm处喷雾保湿,以直接喷雾作为空白对照[7]。接种后在25 ℃左右的正常温室隔离保湿管理,逐天观察叶片发病情况。待出现明显白粉病病症后,挑取病原菌,观察是否与原接种菌株形态相同。重复以上接种方法,获得纯化的白粉菌菌株,保存于室内活体黄芩苗植株上。
1.3 病原菌形态学观察
无性态观察:用透明胶带粘取少量叶片上的白色粉状物,将其置于滴有蒸馏水的载玻片上,盖上盖玻片制成临时玻片。在显微镜下观察分生孢子、分生孢子梗等形态,拍照并测量相关数据 (n=30)。
有性态观察:取干净的载玻片滴一滴无菌水于载玻片中心,选取发病症状典型的病叶,用无菌针挑取病叶上的白粉层和黄褐色闭囊壳至无菌水中,盖上盖玻片,轻轻按压盖玻片使子囊果破裂,溢出子囊和子囊孢子,观察闭囊壳、子囊、附属丝等形态,同时统计数目,拍照并测量相关数据 (n=30)。参考刘铁志[8]和Braun等[9]的相关资料进行白粉菌形态学鉴定。
1.4 病原菌rDNA-ITS序列鉴定
用软毛笔刷轻轻地将接种病叶表面的白粉菌刷至硫酸纸上,收集于无菌离心管中,采用CTAB法[10]提取病原菌基因组DNA,用1%琼脂糖凝胶电泳检测所提取总DNA的完整性。利用白粉菌专用鉴定引物[11]ITS1和PM6进行PCR扩增,引物序列分别为:ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和PM6(5′-GYCRCYCTGTCGCGAG-3′),引物合成及测序均由生工生物工程(上海)股份有限公司完成。PCR反应体系25 μL:2×PCR Master Mix 12.5 μL,DNA 1 μL,ITS1和PM6各1 μL,ddH2O 9.5 μL。PCR反应程序:95 ℃预变性5 min;95 ℃变性30 s,55 ℃复性45 s,72 ℃延伸1 min,共循环30次;最后 72 ℃延伸5 min,4 ℃保存,备用。制备1.2%琼脂糖凝胶,120 V电泳30 min,0.5 mg·L-1EB溶液中染色10 min,置于凝胶成像仪进行拍照并保存。
把具特异性条带PCR产物送生工生物工程(上海)股份有限公司测序,将测序得到的序列与NCBI的GenBank数据库中已知核苷酸序列进行相似性比较。下载与其高度同源的10个高氏白粉菌属的代表种序列,以穆氏节丝壳菌(Arthrocladiellamougeotii)为外群,采用DNAMAN 7软件对核苷酸序列进行多重比对,然后使用MEGA 5.2软件以邻接法构建系统发育树,自展法进行检验,重复1 000次,确定病原菌的分类地位。
1.5 白粉病对黄芩叶片生理特性的影响
1.5.1 叶片电解质渗漏电导率测定 采用电导率法[12]测定黄芩叶片电解质渗漏电导率,具体为:采集同一田块中自然发病和健康的黄芩叶片,带回实验室后剪成约1 cm×1 cm小片,称取发病和健康样品各2份,每份1 g,分别将一份加入50 mL蒸馏水后在常温放置,另一份加入50 mL蒸馏水称量后于电磁炉上煮沸15 min,冷却后再称量并补充蒸馏水至原质量;将上述处理后的样品在室温下浸提1 h,然后将叶片夹出,采用DDS-11A电导率仪分别测定不同处理的电导率。每个处理重复3次,分别取平均值。
1.5.2 叶片叶绿素含量测定 采用丙酮浸渍法[13]测定叶片叶绿素含量,具体为:采集同一田块中自然发病和健康的黄芩叶片,带回实验室后剪成约1 cm×1 cm的小片,分别称取0.1 g鲜样浸泡在10 mL 80%丙酮中,直至叶组织完全变白。利用UV-8420紫外分光光度计分别测663、645、440 nm的光密度A663、A645和A440;每处理重复3次,取其平均值作为测定值,计算叶绿素含量
叶绿素a含量=12.7A663-2.59A645,叶绿素b含量=22.9A645-4.67A663,叶绿素a+b含量=20.3A645-8.04A663。
1.5.3 黄芩叶片主要营养元素含量测定 分别称取0.05 g自然发病的病叶和健康叶片,烘干粉碎过40目筛(孔径0.425 mm),置于消煮管中。采用550 ℃灼烧法(GB 5009.4-2016)、凯氏定氮法(GB 5009.5-2016)、酸水解法(GB 5009.9-2016)、直接滴定法(GB 5009.7-2016)分别测定总灰分、蛋白质(Kjeltec8200半自动定氮仪)、总糖和可溶性糖含量;采用自动定氮仪法(NY/T 2419-2013)、酸溶-钒钼黄比色法(NY/T2421-2013)和酸溶-火焰光度法(NY/T2420-2013)分别测定全氮(Kjeltec8200半自动定氮仪)、全磷(Cary50紫外可见分光光度计)和全钾(M410型火焰光度计)含量。以上每个处理重复3次,取其平均值。
1.5.4 黄芩叶片微量元素含量测定 分别称取0.05 g自然发病的病叶和健康叶片,烘干粉碎过40目筛(孔径0.425 mm),置于消煮管中。采用原子吸收分光光度法(GB/T 5009.90-2003食品中铁、镁、锰的测定,GB 5009.92-2003食品中钙的测定)测定Fe、Mg、Mn、Ca微量元素含量(iCE3500原子吸收光谱仪);采用原子吸收光谱法(GB/T 5009.14-2003 食品中锌的测定,GB/T 5009.13-2003 食品中铜的测定)测定Zn和Cu微量元素含量(iCE3500原子吸收光谱仪);采用干灰化—甲亚胺比色法(LY/T 1273-1999 森林植物与森林枯枝落叶层全硼的测定)测定全B含量(Cary50紫外可见分光光度计)。以上每个处理重复3次,取其平均值。
1.6 数据处理
采用DPS 2002软件[14]进行数据统计分析和处理,用“平均值±标准误”表示测定结果,分别对健康叶片和发病叶片生理特性进行单因素方差分析,依Duncan’s新复极差法检验差异显著性 (P<0.05)和差异不显著(P>0.05);采用Excel 2010制图。
2 结果与分析
2.1 黄芩白粉病田间发病症状
黄芩白粉病病菌的菌丝体在叶、茎和萼片上双生,致密,形成明显的不规则白色斑块。发病初期在叶片正面产生放射状圆形斑(图1-A),随后病斑逐渐扩大连成一片,很快整个叶片正反面布满了厚厚的一层白色粉状物(图1-B),即病原菌的分生孢子;发病后期白色粉层扩散至整个植株,叶片白色粉层上产生黄褐色或黑色小颗粒(图1-C),即病原菌的闭囊壳。

A.田间发病症状;B.发病叶片正反面;C.发病后期症状
2.2 致病性测定
室内盆栽纯化及致病性结果表明,接种培养20 d后,在接种黄芩叶片上观察到大量白粉病菌,发病症状和自然发病类似(图2-A),但对照叶片没有发病(图2-B)。将发病叶片上的白粉菌重新进行病原菌形态学鉴定,得到的病原菌和原来接种的病原菌种类一致,表明该菌是引起黄芩白粉病的病原菌。

A.室内接种后发病症状;B.对照 A.Symptoms after indoor inoculation; B.CK
2.3 病原菌形态特征鉴定结果
2.3.1 无性形态特征 菌丝宽4~7 μm,透明、薄壁且光滑;附着胞乳突状,直径4~8 μm;分生孢子梗37.5~47.5 μm×7.5~10 μm,足细胞柱状直立,足细胞的基部隔高于与菌丝母细胞的连接处,上接1~3个短细胞;分生孢子串生,圆柱形或椭圆柱形,脐处有缢缩,大小为25~40 μm× 15~20 μm,长/宽为1.4~2.0;初生分生孢子顶部圆形,基部近截形;芽管短,前端具有膨胀的附着胞(图3)。

A.分生孢子梗和分生孢子;B.分生孢子梗;C.分生孢子;D.初生孢子;E.分生孢子萌发;F.附着胞;比例尺:A~B为50 μm,C~F为20 μm
2.3.2 有性形态特征 闭囊壳球形,褐色,直径85~150 μm,常聚生或少量散生于菌丝中;附属丝呈菌丝状,多数着生在子囊果一侧,大多数弯曲不分支,基部颜色为褐色,向上逐渐变为无色;子囊球形、卵形或囊状,通过短柄着生在闭囊壳内侧,大小为45~75 μm×25~40 μm;1个子囊内含有2~8个子囊孢子,子囊孢子圆形或椭圆形(图4)。病原菌有性和无性形态特征与文献中琉璃草高氏白粉菌(Golovinomycescynoglossi)描述基本一致。

A.闭囊壳聚生;B.闭囊壳和附属丝;C.破裂的闭囊壳;D.一个闭囊壳中含有6个子囊;E.未成熟的子囊;比例尺:A为100 μm,C和D为50 μm,B和E为20 μm
2.4 rDNA-ITS序列鉴定结果
用白粉菌专用鉴定引物ITS1和PM6对2020和2021年收集并完成回接的8个黄芩白粉菌的基因组DNA进行rDNA-ITS区扩增,并对扩增产物进行测定与分析,结果显示:菌株碱基序列完全相同(核酸同源性100%),选取2020年采集的菌株BF-1序列进行后续分子生物学分析。将测序得到的序列经过BLASTn分析,结果显示:该序列(GenBank登录号:OL440406)与报道的高氏白粉菌属(Golovinomycessp.)序列相似性达99%以上。下载和比对高氏白粉菌属的10个代表种的序列,以穆氏节丝壳菌(A.mougeotii)为外群构建系统发育树,发现菌株BF-1的序列与琉璃草高氏白粉菌(Golovinomycescynoglossi)(GenBank登录号:MH189701)聚在同一支,同源性达98%(图5)。综合白粉菌无性和有性形态学特征以及rDNA-ITS分子生物学特征,将引起甘肃省黄芩白粉病的病原菌鉴定为琉璃草高氏白粉菌(G.cynoglossi)。
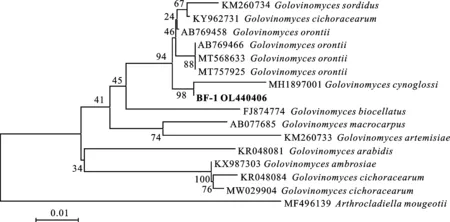
图中分支上数值为1 000次自展检验置信度,标尺示遗传距离
2.5 白粉病对黄芩叶片生理特性的影响
2.5.1 叶片电解质渗漏电导率 黄芩病叶电解质渗漏电导率为36.45 μS·cm-1,而健康叶片电解质渗漏电导率为19.27 μS·cm-1,两者差异显著(P<0.05)(图6),结果表明,黄芩白粉病发生后叶片电解质渗漏电导率升高。

不同字母表示不同处理间差异显著(P<0.05),下同
2.5.2 叶绿素含量 黄芩发病叶片叶绿素含量为1.84 mg·g-1,而健康叶片叶绿素含量为 3.08 mg·g-1,两者差异显著(P<0.05)(图7),结果表明,黄芩白粉病发生后叶片叶绿素含量降低。

图7 白粉病对黄芩叶片叶绿素含量的影响Fig.7 Effect of G.cynoglossi on chlorophyll content of Scutellaria baicalensi leaves
2.5.3 叶片主要营养元素含量 黄芩白粉病发生后,叶片主要营养元素总灰分和全P含量升高,而蛋白质、总糖、可溶性糖、全N和全K均降低(表2)。方差分析结果表明,黄芩病叶和健康叶片之间总灰分、蛋白质、总糖、可溶性糖、全N、全P和全K主要营养元素含量差异不显著 (P>0.05),表明白粉病对黄芩叶片主要营养元素含量的影响不大。

表2 白粉病对黄芩营养元素含量的影响Table 2 Effect of G.cynoglossi on nutrient elements of Scutellaria baicalensi leaves
2.5.4 叶片微量元素含量 黄芩白粉病发生后,病叶微量元素Zn、Mn、Cu、Fe、Ca、Mg和B的含量均升高(表3)。方差分析结果表明,黄芩病叶和健康叶片之间Mn、Fe和B的含量差异显著 (P<0.05),而Zn、Cu、Ca和Mg的含量差异不显著(P>0.05)。
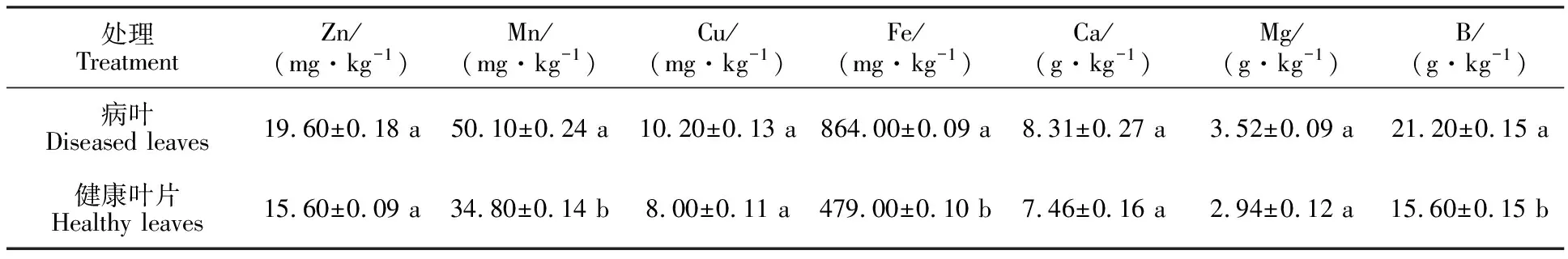
表3 白粉病对黄芩叶片微量元素含量的影响Table 3 Effect of G.cynoglossi on micro element of Scutellaria baicalensi leaves
3 讨论与结论
白粉病在世界各地广泛分布,在蔬菜、花卉、果树和牧草等植物上均可发生;白粉菌寄主范围广,为害较大,对植物的产量造成重大损失。白粉菌是一类植物专性寄生性真菌,人工培养困难,仅依靠形态鉴定在分类上存在很大争议,近年来分子生物技术广泛应用于白粉菌种类鉴定、系统发育和进化研究[15-18]。
关于黄芩白粉病的病原菌国内一些学者仅通过形态学特征鉴定为白粉菌属(Erysiphesp.)、二孢白粉菌(E.cichoracearum)、脉革粉孢菌(O.ambrosiae)和蓼白粉菌(E.polygoni)等[3-6]。本试验通过2年时间在陇西县不同地区调查和采集黄芩白粉病发病叶片,观察其无性和有性时期的形态特征,同时首次采用白粉菌专用鉴定引物ITS1和PM6对其ITS区域进行扩增测序及系统发育分析,鉴定出黄芩白粉病的病原菌为琉璃草高氏白粉菌(G.cynoglossi),该结果与以上学者的不一致,这可能与目前关于黄芩白粉病病原研究少,且均为早年研究结果,未进行分子生物学方面的鉴定,结果可能不准确有关,另一方面也与中国不同地区的气候条件存在明显差异等因素有关。例如,丁卓等[19]研究发现引起葫芦科作物的白粉病菌有很多,不同地区致病的菌种并不相同;李金鸿等[20]发现黄芪白粉病的病原菌也因地区差异而不同。据报道,琉璃草高氏白粉菌(G.cynoglossi)可引起紫草科(Boraginaceae Juss.)长叶微孔草(Microulatrichocarpa)、毋忘草(Myosotissylvatica)和西亚琉璃草(Omphalodescappadocica)白粉病[21-23],本研究发现该病原菌也可以侵染唇形科(Lamiaceae)中药材黄芩,导致黄芩白粉病发生。一些研究表明,白粉菌以闭囊壳和菌丝体随着病残体在地表越冬,翌年温湿度条件适宜时侵染寄主植物,病部产生的分生孢子借风雨传播进行再侵染,加重病害的发生;田间栽培的植株在郁闭、阴湿等环境条件下发病较重,这表明在白粉病发病初期及时进行有效防治和收获期彻底清除田间病叶、病株残体对切断病原菌的传播有重要作用[24]。
病原菌侵染不但影响植物叶片的光合作用,而且破坏叶片内部的组织[25]。本试验得出,黄芩发病叶片电解质渗漏电导率升高,叶绿素含量降低,这是由于白粉菌侵染黄芩叶片后,叶片内部细胞结构发生很大变化,叶绿素分解速率高于合成速率,导致叶片叶绿素的含量降低;同时叶片内部细胞壁破坏和细胞膜受到损伤,叶片细胞的透光性增强,大量水分从细胞内部流出,导致电解质渗漏电导率升高。病原菌不仅造成植物叶片光合作用受阻,还会影响叶片主要营养元素(N、P、K)和微量元素(Fe、Zn、Cu、Mn、Ca、Mg、B等)的吸收与含量变化。营养元素和微量元素在植物生长发育过程中对细胞结构的构成、调节生命活动、维持内部环境稳定、参与能量转化和物质运输等起到十分重要的作用[26]。当植物缺乏一种或多种营养元素和微量元素时,往往在不同程度上导致一些生理性病害和病理性病害发生[27]。朱锦惠等[28]和王如月等[29]研究发现,植物体内氮含量增加,相应的可溶性氮化物容易增多,通常会诱发病原菌发生,导致白粉病加重发生;植物体内钾含量不足,淀粉合成过程会减弱,酚类化合物减少,气孔开关调节能力下降,导致植物的发病率升高;植物体内磷含量不足,核酸与蛋白质的合成受阻,老叶最先受到危害,快速脱落;同时植物通过不同的机理、途径和方式等吸收一些微量元素来激活抗菌物质,进而达到提高抗病力;相反,当植物遭到病原菌侵染,总会导致一些营养元素和微量元素的含量发生相应的变化。本试验首次得出黄芩白粉病发生后,主要的营养元素全N、全K的含量降低,而全P的含量增加;一些微量元素Zn、Mn、Cu、Fe、Ca、Mg和全B的含量升高,关于这些营养元素和微量元素与白粉菌之间的发病机制有待于进一步研究。

