大灰象甲非典型气味受体基因SvelOrco的克隆及组织表达谱分析
翟颖妍,张 锋,杨艺炜,王天舒,洪 波
(1.陕西省生物农业研究所,西安 710043;2.西安市农产品质量安全检测中心,西安 710000)
昆虫利用嗅觉器官识别环境中的气体分子,在此基础上进行觅食、求偶、交配、产卵、躲避天敌等复杂生命活动[1-2]。气味受体(odorant receptors,ORs)和非典型气味受体(odorant receptor co-receptor,Orco)是两类在昆虫嗅觉神经元(olfactory receptor neuron,ORN)上表达的气味受体蛋白,非典型气味受体Orco又称气味共同受体[3]。两类气味受体在昆虫嗅觉识别过程中发挥的功能不同,OR负责感受气味分子,Orco则通过异源二聚化与OR结合形成复合体,构成配体门控离子通道,激活信号传导过程[4-5]。Orco不具有气味识别功能,但能促进OR的合成、运输、定位及构象稳定,提高气体分子与OR的结合效率,在昆虫嗅觉识别过程中发挥重要作用[6-7]。在敲除了Orco基因的果蝇中,出现嗅觉受体定位缺失及嗅觉功能严重损伤的情况[8],对赤拟谷盗(Triboliumcastaneum)进行类似试验也得到相似结果[9],敲除烟草天蛾(Manducasexta)的Orco基因后发现其对寄主植物气味的响应大幅减弱[10]。Orco在几乎所有嗅觉神经元中表达,且不同昆虫的Orco序列高度保守[11]。
大灰象甲(Sympiezomiasvelatus)俗称尖嘴猴、灰老道,属鞘翅目(Coleoptera)象甲科(Curculionidae)杂食性害虫[12],能够危害多种农作物及林木[13-14]。该虫在国内分布较广,主要分布在东北、华北、华中及西北地区。2021年大灰象甲在陕西和山西两省交界处黄河沿岸一带的冬枣种植区发生严重危害,其成虫喜食枣树新芽,常将枣芽完全吃秃,造成枣树二次发芽,开花坐果推迟,导致产量大幅下降甚至绝产,给当地农户带来巨大的经济损失。目前,对于大灰象甲多使用联苯菊酯、定虫隆、辛硫磷或毒死蜱等化学农药进行防治[15],由于该虫成虫体型较大(体长8~10 mm)且抗逆性较强,传统农药对其防治效果不佳,若提高施药剂量及次数,不仅会造成成本增加,还会对环境及人类健康带来威胁。因此,亟需探索一种高效环保的大灰象甲绿色防治新技术。
Orco基因已在多种鞘翅目昆虫中被鉴定出来,包括华北大黑鳃金龟(Holotrichiaoblita)、华山松大小蠹(Dendroctonusarmandi)、红棕象甲(Rhynchophorusferrugineus)、广聚萤叶甲(Ophraellacommuna)、云杉八齿小蠹(Ipstypographus)等[16-20]。而有关大灰象甲Orco基因及其组织特异性表达的研究报道较少,基于大灰象甲成虫触角转录组测序数据,采用反转录PCR(reverse transcription polymerase chain reaction,RT-PCR)克隆出Orco基因,对Orco蛋白进行结构分析和系统发育分析,同时利用实时荧光定量PCR(quantitative real-time PCR,qPCR)测定并分析大灰象甲成虫不同性别及不同组织中Orco基因的表达谱,以期为进一步研究大灰象甲气味受体功能提供理论依据。
1 材料与方法
1.1 供试虫源
大灰象甲初羽化成虫于2021年4月采集自山西省永济市冬枣园(110.60°E,34.95°N),将雌雄成虫分开后在人工气候箱内(温度25 ℃± 1 ℃,相对湿度60%±5%,光周期16L∶8D)以新鲜枣芽饲养直至试验使用。枣芽采集自陕西省科学院大荔生物农业研究示范基地,品种为‘冬枣’。
1.2 总RNA的提取及cDNA的合成
选取羽化后3日龄大灰象甲雌雄成虫各200头解剖,分别收集触角、头(去除触角)、胸、腹、足、翅不同组织于1.5 mL离心管内,立即置于液氮中冷冻。采用Trizol法利用总RNA提取试剂RNAiso Plus(TaKaRa,北京)提取不同组织的总RNA,使用微量分光光度计(杭州奥盛仪器有限公司)检测,确保OD260/OD280值为1.8~2.0,RNA样品浓度>100 ng/μL,并记录各样本RNA浓度。使用PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit反转录试剂盒(TaKaRa,北京)按合成方法去除基因组DNA后反转录合成cDNA第1链,使用微量分光光度计检测并记录cDNA浓度,-20 ℃保存,备用。
1.3 PCR产物的回收、克隆及测序
根据前期获得的大灰象甲雌雄成虫转录组unigene序列构建核苷酸本地BLAST数据库。参考洪波等[21]的方法,使用近源种枣食芽象甲(Pachyrhinusyasumatsui)的Orco氨基酸序列(Genbank登录号:UUW42911),通过tBlastn检索获得大灰象甲候选Orco的mRNA全长unigene序列,根据该序列使用Primer Premier 5软件设计Orco基因的特异性引物SvelOrco-F/SvelOrco-R(表1)。所用引物均由生工生物工程(上海)股份有限公司完成。

表1 引物信息Table 1 Primer information
以“1.2”节合成的cDNA为模板,SvelOrco-F/SvelOrco-R为引物进行PCR扩增。RT-PCR反应体系(20 μL):2×TaqMasterMix(康为世纪生物科技股份有限公司) 10 μL、上下游引物各 1 μL、ddH2O 7 μL、cDNA模板1 μL。RT-PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s, 60 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃终延伸10 min。使用1%琼脂糖凝胶电泳检测PCR产物,经过切胶纯化来回收大小相符的目的DNA条带,将回收的PCR产物连接到pMD19-T载体(TaKaRa,北京)后转化到大肠杆菌(Escherichiacoli) DH5α感受态细胞(天根生化科技(北京)有限公司)内,摇菌1 h后将菌液涂在LB平板上, 37 ℃过夜培养12 h以上,挑取白色单菌落进行PCR检测,选择阳性克隆摇菌4~5 h,送生工生物工程(上海)股份有限公司测序验证。
1.4 大灰象甲Orco基因的生物信息学分析
对“1.3”节中获得的大灰象甲Orco基因序列进行生物信息学分析:用ORFfinder在线工具查找大灰象甲Orco基因开放阅读框(Opening Reading Frame,ORF)并预测翻译的氨基酸序列(https://www.ncbi.nlm.nih.gov/orffinder);用expasy在线软件预测Orco蛋白质分子质量及等电点等理化性质(https://web.expasy.org/protparam/);用Signal P在线软件预测Orco蛋白是否存在信号肽(https://services.healthtech.dtu.dk/service.php?SignalP-5.0);用TMHMM在线软件预测Orco蛋白跨膜结构域(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0);用NetPhos在线软件分析其磷酸化位点(https://services.healthtech.dtu.dk/service.php?NetPhos-3.1);用SOPMA在线软件分析Orco蛋白的二级结构(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html);用Swiss-Model在线软件预测并分析其三级结构(https://swissmodel.expasy.org)。
使用NCBI在线工具BLAST (http://blast.ncbi.nlm.nih.gov) 对大灰象甲Orco核苷酸序列进行同源比对;利用DNAMAN 8.0 软件对大灰象甲Orco基因编码的氨基酸序列进行同源分析。为明确大灰象甲Orco与其他昆虫Orco氨基酸序列之间的亲缘关系,使用Mrbayes 3.2.6软件采用贝叶斯推理法[22-23]构建系统进化树,运用GTR模型,运算至分裂频率分支频率的标准偏差小于0.01,舍去250个老化样本进行分析,对得到的系统发育树在FigTree 1.4.3软件中进行编辑。
1.5 大灰象甲Orco基因的表达谱分析
同理,根据枣食芽象甲内参基因EF1α氨基酸序列(Genbank登录号:UUW42912),在本地BLAST数据库中检索出同源unigene序列并设计引物SvelEF1α-F/SvelEF1α-R,经过PCR扩增后得到大灰象甲EF1α基因全长序列(GenBank登录号:OM417063)。选取大灰象甲EF1α和β-actin(GenBank登录号:MH717233)作为双内参基因[14],利用qPCR测定并分析大灰象甲成虫不同性别和不同组织中Orco基因的表达量差异,qPCR所用的特异性引物见表1。qPCR反应体系(20 μL):TB Green Premix ExTaqⅡ(TaKaRa,北京)10 μL、10 μmol/L上下游引物各1 μL、 ddH2O 7 μL、 cDNA模板1 μL。qPCR反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火 30 s,72 ℃延伸30 s,共40个循环。设置3次生物学重复及3次技术重复。
1.6 数据分析
以大灰象甲雌虫腹部Orco基因的表达量为基准[24],采用2-△△Ct方法[25]计算各组织中Orco基因的相对表达量,使用SPSS 22软件进行数据处理分析,利用独立样本t检验(Independentt-test)检测同一组织不同性别间的表达量差异,利用单因素方差分析法(one-way ANOVA)检验同一性别不同组织间的表达量差异。
2 结果与分析
2.1 大灰象甲Orco基因的序列分析
通过克隆测序获得大灰象甲Orco基因序列,将该基因命名为SvelOrco(GenBank登录号:OM417062)。其cDNA序列全长为2 027 bp,其中开放阅读框为1 449 bp,5′端和3′端非翻译区(Untranslated region,UTR)分别为169 bp和409 bp。SvelOrco基因编码482个氨基酸,其中亮氨酸(Leu)含量最高,达12.4%。预测SvelOrco基因编码蛋白的分子质量为53.49 ku,等电点为5.66,不稳定指数为30.04,亲水性平均值为 0.329,为稳定的疏水性蛋白。
氨基酸序列分析发现,SvelOrco蛋白无信号肽,7个跨膜区分别位于第38~60位、第75~97位、第136~158位、第196~218位、第343~365位、第385~407位和第456~478位氨基酸处, N端在膜内,C端在膜外。磷酸化位点预测发现共有47个氨基酸为潜在的蛋白激酶磷酸化位点,包括5个酪氨酸(Tyr)、12个苏氨酸(Thr)和30个丝氨酸(Ser)。根据SOPMA分析结果,SvelOrco蛋白二级结构中α-螺旋占比54.98%,无规则卷曲占比26.76%,延伸链占比14.73%,β-转角占比3.53%,α-螺旋是SvelOrco蛋白的主要结构形式(图1)。利用Swiss-Model在PDB蛋白数据库中对SvelOrco序列进行同源性搜索,选取同源性最高(sequence identity=64.86%)的寄生性榕小蜂(Apocryptabakeri)的Orco(PDB ID:6c70.1.A)作为模板进行同源建模[26],预测出的SvelOrco蛋白三级结构与二级结构相符,主要由7个 α-螺旋和无规则卷曲组成(图2)。

蓝色、红色、绿色和紫色分别表示α-螺旋、延伸链、β-转角和无规则卷曲
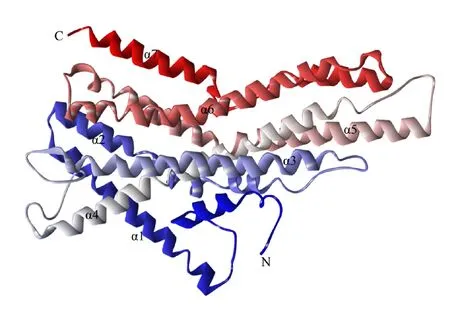
N和C分别表示SvelOrco蛋白的N端和C端,α1~α7表示7个α-螺旋
使用NCBI的BLAST工具进行核苷酸序列比较,比对结果发现大灰象甲SvelOrco与鞘翅目昆虫的Orco基因序列同源性很高,和亚棕象甲(Rhynchophorusvulneratus)基因序列相似性达76.32%,和米象(Sitophilusoryzae)基因序列相似性达76.27%。在DNAman里将SvelOrco氨基酸序列与鞘翅目2种昆虫及其他目的6种昆虫Orco氨基酸序列进行比对,结果表明SvelOrco与红棕象甲RferOrco序列一致度为80.72%,和云杉八齿小蠹(Ipstypographus)的Orco序列一致度为79.12%,和黄地老虎(Agrotissegetum)、烟蚜茧蜂(Aphidiusgifuensis)、绿盲蝽(Apolyguslucorum)、亚洲小车蝗(Oedaleusasiaticus)、栖北散白蚁(Reticulitermessperatus)、桔小实蝇(Bactroceradorsalis)的Orco氨基酸序列一致度分别为57.03%、58.84%、55.42%、55.62%、 55.02%、58.43%。其中高度保守的区域集中在序列的后半部分(C端),位于第6至第7跨膜区之间(图3)。
2.2 大灰象甲SvelOrco蛋白序列的系统发育分析
基于贝叶斯法构建系统发育树(图4),对包括大灰象甲SvelOrco在内的共7个目89种昆虫的Orco氨基酸序列进行同源性比较,可以看出,同一目昆虫的Orco聚为一类,不同目之间具有同源性但存在一定差异,鞘翅目、双翅目和鳞翅目聚为一簇,亲缘关系最近,半翅目、直翅目和蜚蠊目聚为一簇,膜翅目单独为一簇。大灰象甲SvelOrco位于鞘翅目分支中,与云杉八齿小蠹ItypOrco亲缘关系最近,其次为中欧山松大小蠹(Dendroctonusponderosae)的DponOrco。

此系统发育树中显示了不同物种的Orco名称及其GenBank登录号。星号代表SvelOrco所在位置
2.3 大灰象甲SvelOrco基因的表达谱分析
根据qPCR的检测结果(图5),SvelOrco在大灰象甲雌、雄成虫触角中的相对表达量均显著高于其他组织中的表达量,分别为雌虫腹部表达量的513倍和624倍。SvelOrco在雄虫触角的表达量显著高于雌虫,是雌虫触角表达量的1.22倍。SvelOrco在雌、雄成虫翅部组织中也有少量表达,表达量分别为雌虫腹部表达量的43.23倍和17.64倍,SvelOrco在雌虫翅部的表达量显著高于雄虫,是雄虫翅部表达量的2.45倍。SvelOrco在雌、雄成虫的头、胸、腹和足部组织仅微量表达,且差异不显著。

图中数据为平均值±标准差;柱上不同大写和小写字母分别表示大灰象甲雌成虫和雄成虫在不同组织中SvelOrco基因的相对表达量的差异显著性(P<0.05,Tukey法);柱上**、ns分别表示SvelOrco基因相对表达量在大灰象甲同一组织不同性别之间差异显著(P<0.05)和差异不显著(P>0.05)(t测验法)
3 结论与讨论
本研究首次克隆大灰象甲SvelOrco基因,分析了SvelOrco的理化性质、序列同源性及与其他昆虫Orco的亲缘关系,明确了SvelOrco基因在大灰象甲不同性别、不同组织中的表达谱模式。大灰象甲SvelOrco基因编码482个氨基酸,这与红棕象甲Orco基因编码482个氨基酸、松树蜂(Sirexnoctilio)的SnocOrco基因编码481个氨基酸、云杉八齿小蠹Orco基因编码480个氨基酸[18,20,27]数量类似。SvelOrco蛋白主要由α-螺旋和无规则卷曲组成,有7个跨膜α-螺旋,N端在膜内,C端在膜外,是稳定的疏水性蛋白,符合昆虫非典型气味受体特征。氨基酸序列比对发现,SvelOrco除与同为鞘翅目的红棕象甲和云杉八齿小蠹的序列相似性很高(分别为80.72%和79.12%)外,与其他目昆虫Orco的相似性都在50%以上,表明尽管昆虫经过漫长进化,不同目之间的Orco序列仍保持很高的保守性,且不同目昆虫Orco的后半部分氨基酸序列更是高度保守,表明该高度保守的区域可能是在Orco和OR互作中不可或缺的功能区[28]。

Rfer.红棕象甲Rhynchophorus ferrugineus(AOO35283.1);Svel.大灰象甲Sympiezomias velatus(UVZ35314);Ityp.云杉八齿小蠹Ips typographus(QOI12086.1);Aseg.黄地老虎Agrotis segetum(AGS41440.1);Agif.烟蚜茧蜂Aphidius gifuensis(AZQ24921.1);Aluc.绿盲蝽Apolygus lucorum(AHC72290.1);Oasi.亚洲小车蝗Oedaleus asiaticus(QAB43939.1);Rspe.栖北散白蚁Reticulitermes speratus(BAU20240.1);Bdor.桔小实蝇Bactrocera dorsalis(XP_011203778.1)
从系统发育树中可以看出,鞘翅目、双翅目和鳞翅目聚为一簇,亲缘关系最近,这与枣食芽象甲[21]系统发育分析结果一致。系统发育分析结果表明,大灰象甲SvelOrco与同属鞘翅目象甲科的云杉八齿小蠹的同源性最高,亲缘关系最近,其次是中欧山松大小蠹。Li 等[29]基于二代测序的大灰象甲触角转录组数据,采用最大似然法得到的系统发育结果认为大灰象甲Orco和中欧山松大小蠹的亲缘关系最近,其次是红棕象甲,与本研究结果有所区别。推测原因一方面可能由于该研究参与比对的Orco序列较少,除大灰象甲Orco序列之外仅用了其他4种鞘翅目昆虫的Orco[中欧山松大小蠹、红棕象甲、赤拟谷盗和厚垫黄带蜂天牛(Megacyllenecaryae)]进行分析;另一方面可能与样本采集地和寄主植物有关,Li等[29]研究所用大灰象甲采集自吉林省扶余市花生,而本研究所用虫源为山西省永济市冬枣上采得,两者之间大灰象甲Orco氨基酸序列经比对,同源性仅为87.16%,表明不同地区的气候环境及寄主差异可能导致SvelOrco基因发生变异。另外Li 等[29]仅根据FPKM值(Fragments Per Kilobase of exon model per Million mapped fragments)对比了Orco在大灰象甲雌、雄成虫触角上的表达情况,未对Orco在大灰象甲成虫不同组织的表达谱进行具体分析。
本研究qPCR结果表明,SvelOrco在大灰象甲成虫触角中的相对表达量显著高于其他组织,这与对二点委夜蛾(Athetislepigone)、茶翅蝽(Halyomorphahalys)[24,30]等的研究结果一致,表明Orco主要在昆虫触角中表达。大灰象甲雄虫触角SvelOrco的表达量高于雌虫,是雌虫触角的1.22倍,与桃蛀螟(Conogethespunctiferalis)雄虫触角CpunOrco的表达量是雌虫触角的 1.32倍[31],双委夜蛾(Athetisdissimilis)雄蛾触角AdisOrco的表达量是雌蛾触角的4.2倍[32]等结果一致;而大猿叶甲(Colaphellusbowringi)、柑橘大实蝇(Bactroceraminax)的Orco在雌虫触角的表达量却高于雄成虫[33-34];棉铃虫(Helicoverpaarmigera)、麦蛾(Sitotrogacerealella)则是雌雄成虫Orco在触角上的表达差异不显著[35-36]。Orco在触角上的表达出现性别差异可能与雌、雄成虫触角上嗅觉感受器的数量、种类、感受不同信息物质和功能有关[37]。SvelOrco除了在触角大量表达外,在大灰象甲的翅部组织中也有少量表达,且雌虫翅部的表达量显著高于雄虫,在头、胸、腹和足部表达极低。枣食芽象甲PyasOrco在翅部也有少量表达,且雌虫翅部表达量也显著高于雄虫,不过PyasOrco在足部还有少量表达[21]。申建梅等[38]研究表明瓜实蝇(Bactroceracucurbita)的Orco除了在翅部有少量表达外,在头和前足还有少量表达。还有研究发现Orco在味觉器官如冈比亚按蚊(Anophelesgambiae)及东亚飞蝗(Locustamigratoriamanilensis)[39-40]的喙中表达。Orco除了在嗅觉感受器丰富的触角上高表达之外,在其他器官也有表达,推测是由于Orco蛋白可能参与了气味感受之外的其他生理生化反应,具有气味感受外的其他功能[41]。
Orco的高度保守特性和普遍表达特点使其在昆虫嗅觉识别过程中起着重要作用,能够作为切断嗅觉通讯的作用靶标来开发新型广谱高效药剂。如利用RNA干扰(RNA interference,RNAi)技术向华山松大小蠹体内注射Orco基因的外源双链RNA(Double-stranded RNA,dsRNA),Orco基因的表达量与对照相比显著降低,同时华山松大小蠹对寄主挥发物的感受能力下降[17,42]。Jones等发现Orco的兴奋剂VUAAI能够激活Orco从而激活嗅觉神经元,使昆虫丧失对不同化学感受的区分,影响昆虫相关行为[43]。后续研究将以SvelOrco为靶标利用RNA干扰技术降低大灰象甲体内Orco的表达,或开发Orco的兴奋剂及抑制剂,干扰其嗅觉相关行为,减轻对寄主的危害程度。本研究不仅为SvelOrco蛋白功能及大灰象甲嗅觉分子识别机制的深入研究奠定了基础,还为以Orco为靶标的大灰象甲绿色防控提供了参考。

