根部内生真菌—寄生疫霉—拟南芥互作模式体系的构建与鉴定
金 明,张彩虹,董晨曦,史青尧,张 飞,单卫星,强晓玉
(1.西北农林科技大学 农学院,陕西杨凌 712100;2.西北农林科技大学 园艺学院,陕西杨凌 712100)
马铃薯(SolanumtuberosumL.)是茄科多年生草本植物,是中国第四大粮食作物。马铃薯在国内经济和粮食供应中具有重要作用[1],西北地区是中国马铃薯主要种植区之一,然而该地区生产条件差,普遍缺水少肥,导致其病害问题突出,其中以马铃薯晚疫病尤为严重,每年造成巨大的产量损失[2]。由于马铃薯晚疫病持久抗病基因的挖掘和利用研究有所欠缺[3],导致马铃薯品种抗病性丧失问题极为突出。因此,晚疫病害防控高度依赖化学农药,进而导致耕地地力下降和生态污染[4]。近年来,随着高通量测序技术的发展,越来越多的研究从微生态视角探究马铃薯晚疫病发生的驱动因素。
有关马铃薯根际土壤细菌群落结构和多样性与晚疫病之间的相关性已有报道,与健康马铃薯相比,感染晚疫病的马铃薯根际土壤细菌群落多样性显著降低;同时,部分细菌门、属丰度占比变化导致根际细菌群落结构也发生改变[5]。此外,康利娟等[6]的研究揭示了耕作模式能够影响马铃薯根内真菌多样性及群落结构变化,与单一连续种植马铃薯模式相比,马铃薯与小麦轮作模式下马铃薯根内真菌多样性水平更高,Mortierella和Trichoderma等根内有益真菌丰度明显升高,推测轮作模式下丰度更高的根内有益真菌对马铃薯生长和抗逆性提高有促进作用。在此研究基础上进一步分离培养获得93株根部内生真菌,经过比较分析,明确了连作和轮作模式下在属水平上存在丰度显著差异的一类真菌,如微座孢属(Microdochium)、镰孢菌属(Fusarium)、炭疽菌属(Colletotrichum)和球腔菌属(Mycosphaerella)等[7]。
内生真菌是一类能够在植物组织中定殖、通常不会引起植物明显疾病症状、且对植物产生有益作用的真菌[8]。内生真菌与其他微生物及宿主植物之间密切的相互作用对于植物的健康生长具有重要意义[9]。内生真菌有助于宿主植物从周围环境中获取营养物质,从而促进其生长[10];此外,内生真菌还可能提高宿主植物对干旱、低温等非生物逆境以及病虫害等生物逆境的适应能力[11-12],如从印度西北部塔尔沙漠的灌木根部分离获得的内生真菌印度梨形孢(Piriformosporaindica)具有广泛的寄主范围,能够定殖于多种植物的根部细胞。P.indica不仅能够促进植物生长、提高植物抗逆性[13-15],还有助于诱发寄主植物的系统抗病性,从而有效抵御病原菌的入侵[16]。本研究前期分离获得的微座孢属(Microdochium)是一种较常见的生防真菌,可抑制禾谷类作物的多种病害[17-18]。有益内生真菌及其代谢产物在生物医学、能源和生物催化剂等方面也具有很广泛的应用前景[19]。然而,内生真菌与植物和病原菌的互作机制尚不甚明了。寄生疫霉(P.parasitica)寄主范围非常广泛,侵染包括马铃薯、番茄(SolanumlycopersicumL.)、烟草(NicotianatabacumL.)和拟南芥(Arabidopsisthaliana)等多种植物[20]。同时,寄生疫霉具有较为成熟的遗传转化体系,利用稳定表达绿色荧光蛋白的寄生疫霉转化子,可观察病菌侵染植物细胞的整个过程[21]。因此,寄生疫霉被作为一种重要模式卵菌进行植物与病原卵菌的互作机制研究。西北农林科技大学单卫星教授实验室前期已建立了拟南芥与寄生疫霉的模式互作体系[22],可以快速、大规模筛选遗传材料,并用于开展植物抗病分子遗传机制研究。基于此,已经筛选并鉴定一系列影响植物抗疫霉菌的关键免疫调控因子及其作用机制[23-24]。但是,目前尚缺乏成熟的植物—疫霉菌—内生真菌三方互作研究体系。
植物—疫霉菌—内生真菌三方互作研究体系的建立有助于快速而准确地筛选分析大量候选真菌影响植物与疫霉菌互作的功能,从而鉴定获得关键候选真菌。此外,利用该模式体系完备的基因组信息、遗传材料及技术优势,有助于深入解析植物—有益真菌—病原菌多方互作机制。因此,本试验以潜在影响晚疫病菌变化的真菌M.bolleyi为例,构建根部内生真菌—寄生疫霉—拟南芥三方互作模式研究体系,为深入解析益生真菌影响植物抗病抗逆生物学功能以及互作机制奠定基础。
1 材料与方法
1.1 材 料
植物材料 拟南芥野生型Col-0。
菌株材料 真菌M.bolleyi、寄生疫霉(带绿色荧光蛋白GFP的转化子,1121)以及致病疫霉。以上材料由西北农林科技大学单卫星教授实验室保存。
主要试剂 20%次氯酸钠、75%乙醇、β-谷甾醇、碳酸钙、胡萝卜汁、蔗糖、琼脂粉、1/2MS。
主要仪器 荧光显微镜、超净工作台、智能植物培养箱、生化培养箱、打孔器、高压灭菌锅、超低温冰箱。
主要培养基 马铃薯葡萄糖琼脂培养基(PDA):PDA培养基粉末23 g,加水定容至1 L,121 ℃高压蒸汽灭菌30 min。燕麦培养基(RSA):黑麦65~70 g,蔗糖20 g,琼脂粉8 g,溶于去离子水中,加水定容至1 L,121 ℃高压蒸汽灭菌30 min。 胡萝卜培养基(CA):取胡萝卜200 g切成小块,于500 mL水中煮沸,过滤,留取汁液,加入20 g琼脂,加水定容至1 L,121 ℃灭菌30 min。1/2MS培养基:2.75 g 1/2MS培养基粉末,5 g蔗糖,3.75 g琼脂,去离子水定容至500 mL,pH调制为6.0,121 ℃灭菌30 min。
1.2 方 法
1.2.1 平板拮抗试验 致病疫霉的活化:于 20 ℃黑暗条件下,在RSA培养基上培养致病疫霉10 d左右,用打孔器取直径7 mm的菌饼, 备用。
平板对峙分析:用灭菌接种针挑取疫霉菌放入PDA培养基一侧,在培养基另一侧对称接种经PDA平板20 ℃活化培养4~5 d的真菌菌饼,病原真菌和内生真菌的菌饼接在同一直径上, 20 ℃恒温暗培养。对照试验,将致病疫霉的菌饼单独接种在另一个PDA培养基中,菌饼距离培养基边缘的距离与上述试验保持一致,不接种真菌,于相同条件下进行培养,随时观察菌株生长情况。
真菌评测标准:待单独接种的致病疫霉长满培养基后,取出PDA培养基,用直尺测量单独培养病原菌菌落直径和对峙培养病原菌菌落生长直径,按下式计算抑菌率。
抑菌率=(单独培养病原菌菌落直径-对峙培养病原菌菌落生长直径)/单独培养病原菌菌落直径×100%
1.2.2 真菌M.bolleyi侵染植物根部的细胞学观察分析 拟南芥种子的消毒:取适量的拟南芥种子于20 mL离心管中,先用75%酒精清洗30 min,再用灭菌的ddH2O清洗1 min,重复5次,接着用1% NaClO清洗10 min,之后转移至 2 mL离心管中于4 000 g离心1 min,最后用灭菌的ddH2O清洗1 min,重复5次,将冲洗干净的种子转移到滤纸上于超净台中烘干。
拟南芥种子的培养:将消毒处理后的拟南芥种子种植于1/2MS培养基中,于4 ℃黑暗条件下处理24 h,再于22 ℃培养箱中光照12 h/黑暗 12 h培养7 d,用于后续试验。
真菌孢子悬浮液的制备:取适量0.002%Tween 20加入培养真菌1周左右的培养基中,用涂布器将真菌孢子轻轻刮下来,并用滤布过滤,最终制备成浓度为2.5×105spores/mL真菌M.bolleyi孢子悬浮液,将其接种于拟南芥根部,并于3 hpi、12 hpi、24 hpi、36 hpi和48 hpi时采集根样品进行固定及WGA染色。
根样品的固定及WGA染色:将根样品固定在含有氯仿(20%,体积比)、乙醇(80%,体积比)和三氯乙酸(0.15%,质量与体积比)的溶液中至少24 h。染色前,用蒸馏水冲洗根样品3次,每次5 min,之后将根在10% KOH中洗涤30 s,然后用1×PBS缓冲液(pH 7.4)洗涤3次,每次 5 min。
将根样品固定在含有10 μg/mL WGA Alexa Fluor○R488(Sigma)和0.02% Silwet L-77的1×PBS(pH=7.4)染色液中,并与真空下渗洗 3次,每次1 min,最后在染色液中于真空下渗洗 10 min。
分别将M.bolleyi接种3 hpi、12 hpi、24 hpi、36 hpi和48 hpi的根样品制片后,运用荧光显微镜观察真菌M.bolleyi侵染植物根部的细胞学 特征。
1.2.3 真菌M.bolleyi影响植物抗疫霉菌的功能分析 拟南芥幼苗的培养:于22 ℃培养箱中光照12 h/黑暗12 h培养拟南芥幼苗7 d,之后挑选长势相同的拟南芥苗每8株于同一培养皿中,用于后续试验。
寄生疫霉的培养:于20 ℃黑暗条件下,在CA培养基上培养寄生疫霉10 d左右。
接种处理:取上述拟南芥,如表1所示,首先,对拟南芥根部分别进行真菌M.bolleyi孢子悬浮液和对照溶液预处理;并于预处理24 h后再分别对根部进行寄生疫霉菌丝块接种和空白对照处理。最终,选取不同处理组合下长势相似的10株拟南芥用于后续分析,共进行3次独立重复试验。

表1 试验的处理设计Table 1 Treatment design of experiment
真菌悬浮液的接种:取适量浓度为2.5×105spores/mL的真菌M.bolleyi孢子悬浮液置于无菌的培养皿中,将待接菌处理的拟南芥幼苗根部浸入真菌悬浮液中,持续30 s~1 min,之后放回原培养皿中内,封口放置于22 ℃,12 h光照/12 h黑暗交替的植物培养箱中培养24 h。
寄生疫霉的接种:用打孔器在长满新鲜菌丝的寄生疫霉CA培养基打孔,选取大小一致的菌丝块,用牙签将菌丝块接种于真菌M.bolleyi孢子悬浮液和对照溶液(0.002% Tween 20)预处理的拟南芥幼苗根部,封口放置于22 ℃,12 h光照/12 h黑暗交替的植物培养箱中培养。
寄生疫霉侵染观察:在寄生疫霉接种24 hpi和48 hpi时,在荧光显微镜下观察拟南芥根内细胞中寄生疫霉丝荧光强度。
寄生疫霉侵染量化分析:分别在寄生疫霉接种24 hpi、36 hpi和48 hpi时,在荧光显微镜下对寄生疫霉菌丝块侵染的两侧对根部末端绿色荧光位置,即为寄生疫霉侵染位置进行划线,并划线标记总的根长位置,用ImageJ对根部受侵染的根长度及总根长进行测量,并计算侵染根长比。
侵染根长比(IRLR):IRLR=IL/TL
IL为拟南芥根部受寄生疫霉侵染的长度(cm);TL为拟南芥根总长(cm)。
试验数据处理:用图像处理软件ImageJ测量每株拟南芥根部受侵染的长度和根部总长,经Excel 2019对数据进行整理统计后,用SPSS 19.0软件对3次独立重复试验中的真菌M.bolleyi孢子悬浮液和对照溶液(0.002% Tween 20)预处理组的8对侵染根长比数据进行差异分析,采用t检验进行差异显著性验证。
2 结果与分析
2.1 真菌M.bolleyi对致病疫霉的拮抗作用 分析
结果表明,与单独培养致病疫霉的菌落相比(图1-a),对峙培养皿中致病疫霉的菌落生长受到明显抑制(图1-b),培养1周后,M.bolleyi对致病疫霉的抑菌率达到63.55%(表2)。该结果揭示了真菌M.bolleyi对致病疫霉具有拮抗作用。

a.单独培养1周的致病疫霉菌落生长状况; b.培养1周的真菌M.bolleyi菌落与致病疫霉菌落对峙生长状况

表2 内生真菌M.bolleyi对致病疫霉的抑菌率Table 2 Inhibitory rate of endophytic fungus M.bolleyi against P.infestans
2.2 真菌M.bolleyi与拟南芥根部互作的细胞学特征分析
结果表明,接种3 hpi,真菌M.bolleyi在拟南芥根细胞表面形成侵染钉(图2-a);接种 12 hpi,真菌菌丝进一步在根细胞中扩展(图2-b);接种24 hpi和36 hpi,可以观察到菌丝侵染进入根部伸长区细胞,并在皮层组织的细胞间隙和细胞内定殖(图2-c,图2-d);接种48 hpi,致密的真菌菌丝已完全定殖并扩展至拟南芥根部的皮层组织(图2-e);同时,明场观察并未发现维管束解体或细胞坏死的现象(图2-f)。由此表明,真菌M.bolleyi可成功侵染并定殖于拟南芥根部,并且具有典型的内生真菌侵染特征。

接种真菌M.bolleyi后,分别于3 hpi(a),12 hpi(b),24 hpi(c),36 hpi(d)和48 hpi(e)进行WGA染色,并利用荧光显微镜观察真菌M.bolleyi侵染拟南芥根部的细胞学特征,标尺为50 μm;f.真菌M.bolleyi定殖于拟南芥根部的明场图像,标尺为50 μm;a图中白色箭头所指为侵染钉;c和d图中白色箭头所指为真菌M.bolleyi在细胞间隙或胞内的扩展和定殖
2.3 拟南芥根部—内生真菌—寄生疫霉互作的细胞学特征分析
结果表明,对照溶液预处理后接种带有GFP的寄生疫霉转化子24 hpi,可以在拟南芥根部细胞间隙发现大量寄生疫霉菌丝扩展(图3-a);至48 hpi,菌丝已完全扩展并定殖于根组织内,并可观察到强烈的绿色荧光信号(图3-b)。相较之下,真菌M.bolleyi孢子悬浮液预处理后接种寄生疫霉转化子24 hpi(图3-c)和48 hpi(图3-d),根内寄生疫霉的菌丝生长和扩展均受到明显抑制,绿色荧光强度也明显减弱,且扩展范围更小。该结果表明,真菌M.bolleyi在一定程度上可减轻寄生疫霉对植物根部的侵染。由此揭示拟南芥根部—内生真菌—寄生疫霉互作体系的建立,而该模式互作体系将有助于进一步探究内生真菌影响植物抗疫霉菌的功能与作用机制。
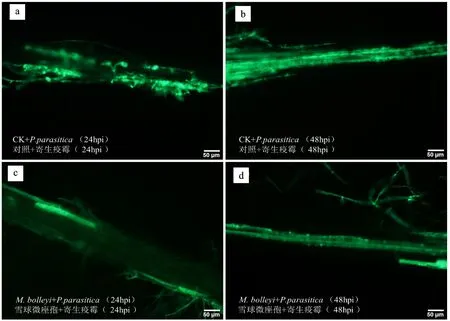
分别在真菌M.bolleyi孢子悬浮液和对照溶液预处理的拟南芥根部接种带有GFP的寄生疫霉转化子菌丝块,并利用荧光显微镜分别于24 hpi和48 hpi观察寄生疫霉侵染根组织的细胞学特征。a和b.对照溶液(0.002% Tween 20)预处理后接种寄生疫霉菌丝块24 hpi和48 hpi寄生疫霉侵染状况;c和d.真菌M.bolleyi孢子悬浮液预处理后接种寄生疫霉菌丝块24 hpi和48 hpi寄生疫霉侵染状况。GFP信号在特定激发光下(488 nm)进行观察,标尺为50 μm
2.4 真菌M.bolleyi影响植物与寄生疫霉互作的鉴定分析
利用内生真菌—寄生疫霉—拟南芥三方互作模式体系,进一步鉴定分析真菌M.bolleyi影响寄生疫霉与拟南芥根部互作的生物学功能。首先,对10 d苗龄的拟南芥根部分别进行对照溶液(0.002% Tween 20)(图4-a)和真菌M.bolleyi孢子悬浮液预处理(图4-b),并于处理24 h后在根部接种带有GFP的寄生疫霉转化子菌丝块。分别于接菌24 hpi、36 hpi和48 hpi测量并计算寄生疫霉侵染拟南芥根部的根长比,以评估鉴定拟南芥与寄生疫霉亲和互作的状态。侵染根长比值越小,表明植物受寄生疫霉菌侵染的程度越弱,即感病性越弱。结果表明,对照预处理的拟南芥根部接种寄生疫霉后,从24 hpi至48 hpi,寄生疫霉侵染根长比从19.51%增至42.66%,说明疫霉菌在拟南芥根部成功定殖和扩展。与之相比,真菌M.bolleyi孢子悬浮液预处理的拟南芥根部接种寄生疫霉24 hpi至48 hpi,寄生疫霉侵染根长比亦从14.23%增至29.43%;然而,相较于对照预处理组,其寄生疫霉侵染根长比于24 hpi、 36 hpi和48 hpi分别降低27.1%、11.6%和 45.0%,且差异显著(P<0.05)(图4-c)。该结果初步揭示真菌M.bolleyi有助于减轻拟南芥对寄生疫霉的感病性。由此亦表明,通过内生真菌—寄生疫霉—拟南芥三方互作体系,可实现快速鉴定与分析真菌影响植物与疫霉菌亲和互作的 功能。

生长于1/2 MS培养基10 d的拟南芥根部分别于对照溶液(0.002% Tween 20)预处理(a)和真菌M.bolleyi孢子悬浮液预处理(b)24 h后,接种带有GFP的寄生疫霉菌丝块,用于后续测量并计算侵染根长比值;c.对照溶液(0.002% Tween 20)与真菌M.bolleyi孢子悬浮液预处理24 h后,分别于接种寄生疫霉24 hpi、36 hpi和48 hpi选取根样,利用荧光显微镜测量寄生疫霉侵染根长及根总长,并计算侵染根长比率。误差线代表标准差,利用t检验进行差异显著性验证,*.P<0.05;**.P<0.01;***.P<0.001。3次独立试验均获得相似结果
3 讨论与结论
中国是世界上最大的马铃薯生产国[1],但在实际生产中病害严重,目前在农业生产中使用化肥与化学药剂仍是农业生产者的首选[4],然而长期使用化学肥料和药剂对土壤的微生物群落结构和土壤的理化性质造成严重破坏[3]。植物内生真菌不仅对宿主植物不会产生危害,还能够增强植物的抗逆性[11],抵抗外来病原菌的侵害[12]。然而在以往的研究中缺乏成熟的植物—疫霉菌—内生真菌三方互作研究体系,导致不能深入解析有益真菌影响植物抗病抗逆生物学功能及互作 机制。
在本研究中,以影响马铃薯晚疫病害发生的潜在内生真菌M.bolleyi为例,通过荧光显微镜观察分析M.bolleyi侵染植物根部的细胞学特征,表明其能入侵植物根部,刚开始形成侵染钉定殖在根部细胞中,并逐渐扩展至根部皮层细胞,且未观察到维管束解体和细胞坏死的现象,具有典型的内生真菌特征。这与之前研究报道一致,M.bolleyi是一种能够广泛定殖在植物根内的内生真菌,尤其是在小麦、大麦、燕麦等禾本科植物的根内最为常见[25]。通过观察分析拟南芥根部与真菌M.bolleyi和寄生疫霉三方互作的细胞学特征,揭示真菌M.bolleyi能够影响植物与寄生疫霉的亲和互作,从而构建根部内生真菌—寄生疫霉—拟南芥三方互作模式研究体系。基于该互作体系,进一步分析真菌M.bolleyi影响寄生疫霉侵染根长比的水平变化,鉴定到候选真菌M.bolleyi有助于减轻植物对寄生疫霉的感病性。这与其他研究报道一致,M.bolleyi是一种潜在的有益内生真菌,它对镰孢菌等病原菌起到良好的抑制效果[26]。这些结果表明真菌M.bolleyi在植物抗疫霉属卵菌病害中具有潜在的应用价值。但有关多方互作的机制尚不明确,因此,该模式体系的建立有助于深入解析植物—病原菌—益生真菌互作机制。
在整个植物—疫霉菌—内生真菌三方互作研究体系建立中,本研究采用蘸根法接种内生真菌M.bolleyi孢子悬浮液,保证了拟南芥根部可以充分接种试验真菌,增加了后续试验的可靠性;并且试验选用稳定表达GFP的寄生疫霉转化子作为指示病菌,即将寄生疫霉菌丝在拟南芥根部侵染的长度转化为荧光显微镜下准确观察到绿色荧光的长度,既使得寄生疫霉对拟南芥根部的侵染可视化,增加了试验数据的准确性;在数据测量方面,试验使用图像处理软件ImageJ来拟合根部形态测量寄生侵染长度,大大降低以往通过肉眼估计抗性产生的主观因素误差。从试验方法上考虑,本研究采用了菌丝块皿内接菌野生型拟南芥Col-0根部的方法,该方法操作简便,且可通过测量并计算拟南芥Col-0的侵染根长比来比较寄生疫霉对拟南芥Col-0的侵染程度,可量化寄生疫霉侵染程度,且可操作性强。此外,选用模式植物拟南芥主要原因是其具有丰富的遗传转化材料,生长周期短,可直接在培养皿内进行试验,能节省培养空间,试验的环境因素稳定可控,因此所得的测试结果相对可靠。
综上所述,本研究以马铃薯根部内生真菌M.bolleyi为例,构建马铃薯根部内生真菌—寄生疫霉—拟南芥三方互作模式研究体系。基于此,初步揭示了真菌M.bolleyi侵染植物根部的细胞学特征,并鉴定分析了真菌M.bolleyi影响植物抗疫霉菌的生物学功能。这为后续挖掘马铃薯根内生有益真菌资源,并深入解析植物与病原菌和有益真菌的互作机制奠定了基础。

