褪黑素对心肌缺血再灌注损伤的保护作用及机制
郑君毅,李晓凤,郭绪昆
心肌梗死是临床常见病,具有很高的发病率和病死率。尽早恢复缺血区域血流,减少心肌细胞死亡是最行之有效的方法,但血流恢复可引起缺血再灌注损伤(ischemic reperfusion injury,IRI),这也是亟需解决的问题。褪黑素(N-乙酰-5-甲氧基色胺)是一种主要由松果体产生的高度保守的分子,除了具有激素功能外,还参与机体多种系统的调控。褪黑素具有高度的亲脂性,可以自由穿过细胞膜,在心肌细胞内发挥抗氧化、抗炎和抗凋亡作用,保护心肌细胞[1-2]。叉头盒O亚型(FOXO)是一个转录因子蛋白家族,在进化上高度保守,包括FOXO1、FOXO3、FOXO4 和FOXO6[3]。FOXO4 是FOXO 家族重要的成员,广泛参与多种生理过程,如细胞增殖、分化、氧化应激反应和凋亡等。已有研究表明,FOXO4是蛋白激酶B(Akt)通路的下游分子,参与缺血性疾病的发生发展[4]。FOXO4可以特异性结合B细胞淋巴瘤2样11蛋白(BIM)启动子,促进其转录,抑制细胞增殖,诱导细胞凋亡。但Akt/FOXO4/BIM 通路是否参与褪黑素对心肌细胞IR损伤的保护作用,目前少见报道。本实验旨在建立大鼠心肌细胞IRI模型,基于Akt/FOXO4/BIM信号通路探讨褪黑素对心肌细胞保护作用的机制。
1 材料与方法
1.1 材料与试剂 凋亡试剂盒购自万类公司,兔源FOXO4、p-FOXO4、p-Akt、Akt 和BIM 一抗均购自CST 公司,小鼠源GAPDH 一抗、辣根过氧化物酶(HRP)标记的羊抗兔和羊抗小鼠二抗购自Proteinteck 公司,ECL 化学发光试剂盒购自Millipore 公司。Akt 抑制剂MK2206 购自Selleck 生物公司。细胞培养液、胎牛血清(FBS)、胰蛋白酶、Ⅰ型胶原酶、青/链霉素、无糖DMEM培养液、TRIzol试剂购自赛默飞公司。MTT细胞增殖检测试剂盒和褪黑素购自Sigma-Aldrich 公司。LDH 检测试剂盒、RIPA、5×loading buffer、蛋白酶抑制剂和磷酸酶抑制剂购自索莱宝公司。SYBR Green 实时荧光定量PCR(qRT-PCR)试剂盒购自罗氏公司;IL-6、TNF-α、MCP-1和GAPDH 引物购自生工生物工程(上海)股份有限公司。1~3 日龄的新生SPF 级C57L/6 小鼠购自斯贝福(北京)生物技术有限公司,生产许可证号:SCXK(京)2019-0010。
1.2 缺血再灌注模型的制作和分组 C57BL/6 新生小鼠40只,无菌条件下开胸取出心脏,PBS 冲洗以完全去除血迹。将心肌充分剪碎,加入0.08%胰蛋白酶和0.05%Ⅰ型胶原酶溶液,采用酶消化法提取小鼠原代心肌细胞[5]。将细胞分为正常对照组(CTRL 组,细胞在正常培养液中培养,不进行任何处理);IRI 组:在实验前将细胞培养液换为不含FBS 的DMEM 培养液,在缺氧培养箱(95%N2、5%CO2)中处理45 min后取出细胞,补充20%FBS后在正常培养条件下培养6 h;褪黑素组(IRI+MEL 组):在IRI 实验前12 h 加入褪黑素溶液(终浓度5 μmol/L),37 ℃培养12 h 后进行IRI 实验;Akt抑制剂组(IRI+MEL+MK2206 组):在褪黑素溶液加入前2 h加入MK2206(终浓度10 μmol/L),37 ℃培养2 h 后加入褪黑素继续培养12 h,然后进行IR实验。
1.3 细胞存活率检测 各组实验结束后,每孔加入MTT 溶液(5 g/L,pH=7.4)20 μL,37 ℃继续孵育4 h,吸弃孔内上清液。每孔加150 μL二甲基亚砜(DMSO),室温下置于水平摇床上至结晶完全溶解。用酶标仪测定溶解液在490 nm波长处的吸光度(A)值。以CTRL 组的细胞存活率为100%,实验组细胞存活率(%)=实验组A值/CTRL组A值×100%。
1.4 细胞上清液LDH 含量检测 实验结束后,将细胞培养板用离心机400×g离心5 min。分别取各孔上清液120 μL,加入到新的96 孔板中。根据LDH 检测试剂盒说明书,各孔分别加入60 μL 新鲜配制的LDH 检测工作液,充分混匀,用铝箔包裹后置于水平摇床上缓慢摇动,室温孵育30 min 后,用酶标仪测定混合液在490 nm波长处A值,并计算各组LDH释放量。
1.5 流式细胞术检测细胞凋亡率 根据凋亡试剂盒说明书,在实验结束后,收集各组细胞上清液,用PBS 清洗细胞并收集清洗液。胰蛋白酶消化各组细胞后,将收集到的细胞上清液、PBS清洗液和细胞消化液合并,以1 000 r/min离心10 min以获得细胞沉淀。用PBS洗涤细胞2次,弃掉上清液,将细胞沉淀重悬于500 μL 结合缓冲液中,并与5 μL 膜联蛋白VFITC和10 μL碘化丙啶(PI)在室温下避光孵育15 min。通过流式细胞仪测定各组的细胞凋亡率。
1.6 qRT-PCR检测炎性因子基因表达 实验结束后弃掉细胞培养液,TRIzol 法提取细胞RNA。取2 μg 总RNA,逆转录成cDNA。采用qRT-PCR 法,取0.5 μL cDNA,使用SYBR Green qPCR 试剂盒扩增靶基因白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)、单核细胞趋化蛋白-1(MCP-1)和GAPDH。所用引物见表1。PCR 反应条件:94 ℃预变性3 min;95 ℃变性15 s,62 ℃退火/延伸30 s,40 个循环。采用2-ΔΔCt法计算各个靶基因的相对表达水平。
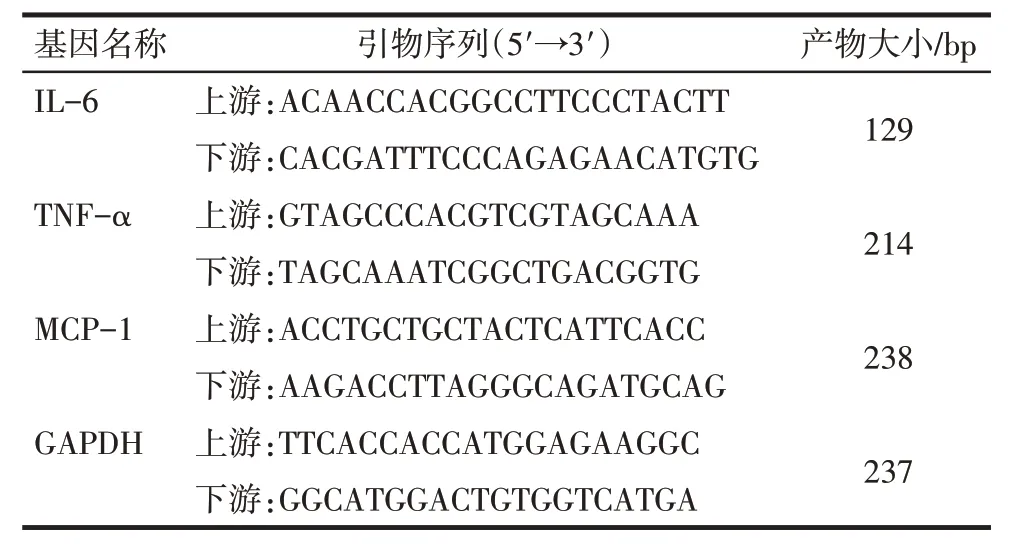
Tab.1 The primer sequences used for qRT-PCR表1 qRT-PCR引物序列表
1.7 Western blot 法检测蛋白表达 各组细胞总蛋白用含1%蛋白酶和磷酸酶抑制剂的RIPA 裂解液提取,使用5×loading buffer 变性总蛋白。取20 μg 变性总蛋白进行SDSPAGE,电泳后将凝胶在4 ℃、110 V 条件下转膜90 min。用5%脱脂奶粉室温封闭PVDF 膜2 h 后,切取包含p-Akt、Akt、p-FOXO4、FOXO4、BIM、GAPDH 蛋白条带的PVDF 膜,分别加入抗p-Akt、Akt、p-FOXO4、FOXO4、BIM(1∶1 000)或GAPDH(1∶10 000)抗体4 ℃孵育过夜。第2 天用TBST 洗膜后,加入1∶10 000稀释的HRP标记二抗,室温孵育1 h。再次用TBST 洗膜,在含有靶蛋白的PVDF 膜上滴加1 mL ECL 化学发光液反应1 min 后,在凝胶成像仪上曝光并分析蛋白表达水平。
1.8 统计学方法 应用SPSS 11.5 软件处理数据,符合正态分布的计量资料以表示,多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞存活率和LDH释放量比较 与CTRL组比较,IRI 组细胞存活率降低,LDH 释放量升高(P<0.05)。与IRI 组比较,IRI+MEL 组细胞存活率升高,LDH 释放量降低(P<0.05);与IRI+MEL 组比较,IRI+MEL+MK2206组细胞存活率降低,LDH释放量升高(P<0.05),见表2。
Tab.2 Comparison of cell viability and LDH release between the four groups表2 各组细胞存活率和LDH释放量比较(n=6,)
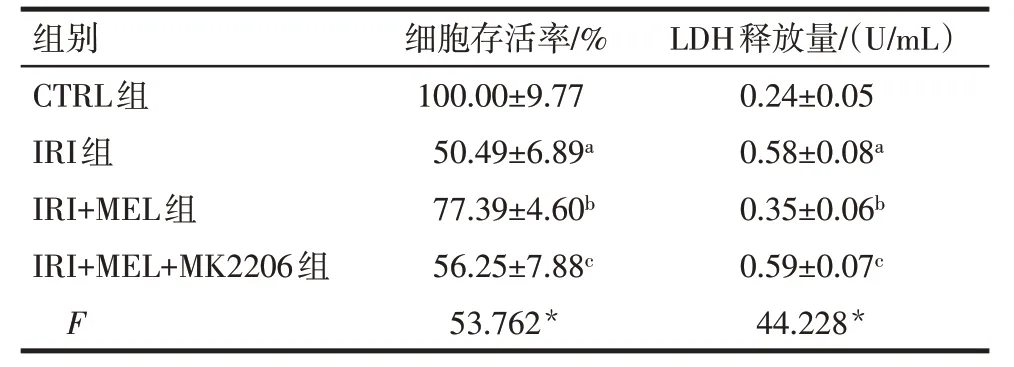
Tab.2 Comparison of cell viability and LDH release between the four groups表2 各组细胞存活率和LDH释放量比较(n=6,)
*P<0.05;a与CTRL 组比较,b与IRI 组比较,c与IRI+MEL 组比较,P<0.05;表3—5同。
?
2.2 各组细胞凋亡率比较 与CTRL组比较,IRI组细胞早期和总凋亡率升高(P<0.05)。与IRI 组比较,IRI+MEL 组细胞早期和总凋亡率降低(P<0.05);与IRI+MEL 组比较,IRI+MEL+MK2206 组细胞早期和总凋亡率升高(P<0.05)。各组细胞晚期凋亡率比较差异无统计学意义(P>0.05),见图1、表3。
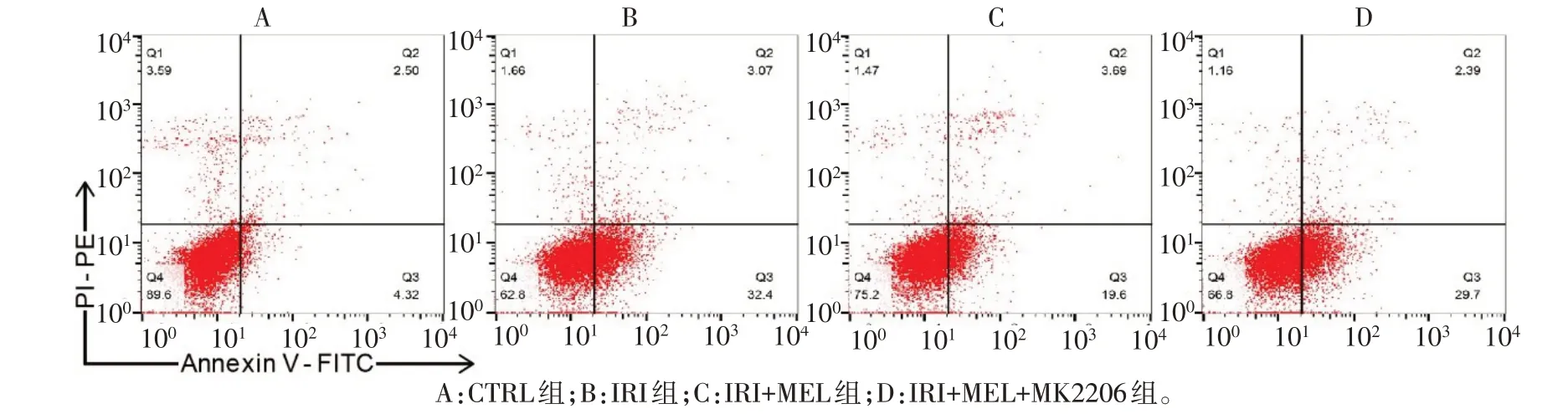
Fig.1 Flow cytometry assay of cell apoptosis图1 流式细胞术检测细胞凋亡情况
Tab.3 Comparison of cell apoptosis between the four groups表3 各组细胞凋亡率比较(n=3,%,)
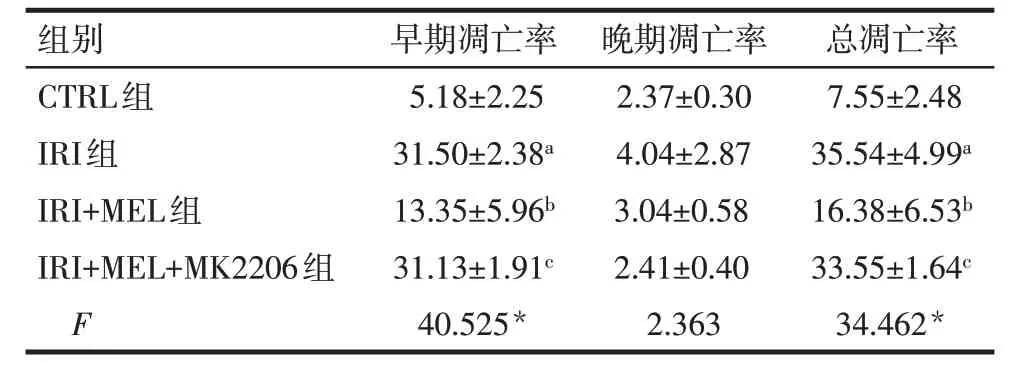
Tab.3 Comparison of cell apoptosis between the four groups表3 各组细胞凋亡率比较(n=3,%,)
?
2.3 各组细胞炎性因子基因表达水平比较 与CTRL 组比较,IRI 组IL-6、TNF-α 和MCP-1 基因相对表达水平升高(P<0.05)。与IRI 组比较,IRI+MEL组IL-6、TNF-α和MCP-1基因相对表达水平降低(P<0.05);与IRI+MEL 组比较,IRI+MEL+MK2206 组IL-6、TNF-α 和MCP-1 基因相对表达水平升高(P<0.05),见表4。
Tab.4 Comparison of inflammatory cytokine gene expression levels between the four groups表4 各组细胞炎性因子基因表达水平比较(n=3,)
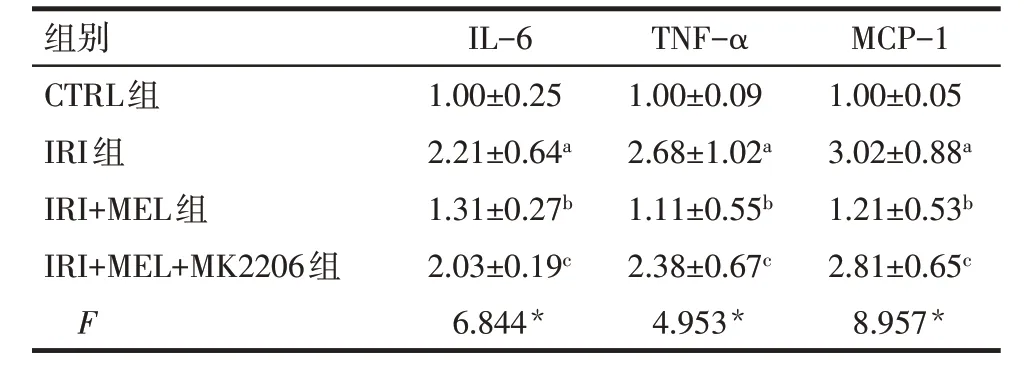
Tab.4 Comparison of inflammatory cytokine gene expression levels between the four groups表4 各组细胞炎性因子基因表达水平比较(n=3,)
?
2.4 各组蛋白表达水平比较 与CTRL组比较,IRI组p-AKT蛋白表达水平降低,p-FOXO4和BIM蛋白表达水平升高(P<0.05),与IRI组比较,IRI+MEL组p-AKT蛋白表达水平升高,p-FOXO4和BIM蛋白表达水平降低(P<0.05)。与IRI+MEL 组比较,IRI+MEL+MK2206 组p-AKT 蛋白表达水平降低,p-FOXO4 和BIM 蛋白表达水平升高(P<0.05),见图2、表5。
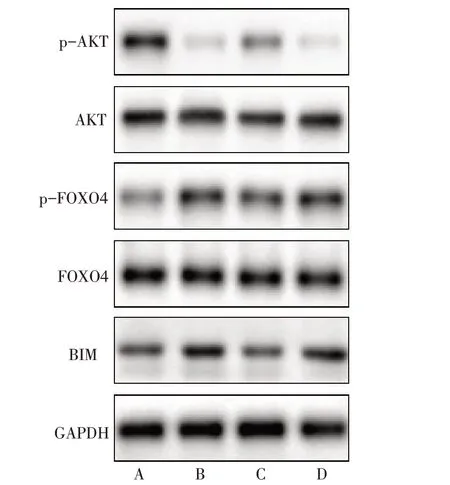
Fig.2 Western blot assay of p-AKT,p-FOXO4 and BIM proteins图2 Western blot检测各组细胞p-AKT、p-FOXO4和BIM蛋白表达水平
Tab.5 Comparison of p-AKT,p-FOXO4 and BIM proteins between four groups表5 各组细胞p-AKT、p-FOXO4和BIM蛋白表达水平(n=3,)
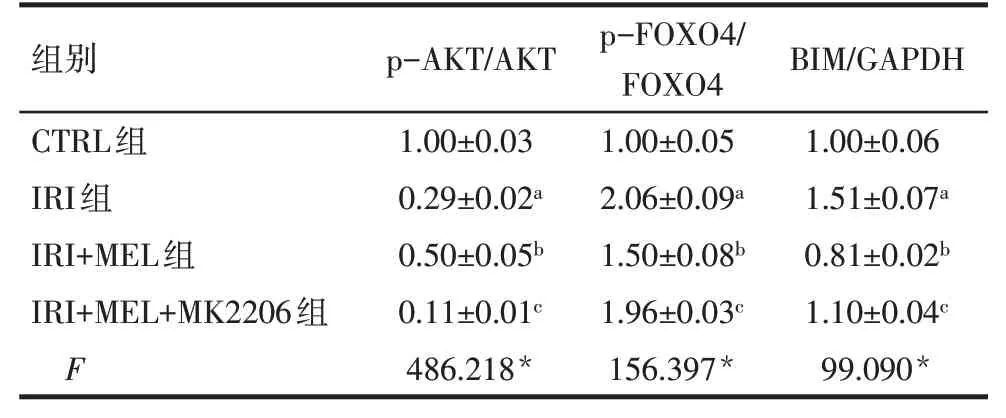
Tab.5 Comparison of p-AKT,p-FOXO4 and BIM proteins between four groups表5 各组细胞p-AKT、p-FOXO4和BIM蛋白表达水平(n=3,)
?
3 讨论
研究表明,褪黑素对缺血再灌注损伤的心肌细胞具有保护作用[6]。褪黑素不仅可以通过激活沉默信息调节因子(SIRT3)信号通路减轻老年雄性大鼠心肌细胞的氧化应激和凋亡,改善缺血再灌注后心脏收缩功能,减少梗死面积[6];还可以膜受体依赖的方式调控Notch1/Hes1/Akt 信号通路,恢复硫氧还蛋白系统,保护大鼠急性高血糖状态下缺血再灌注损伤时的心脏[7]。对接受心脏搭桥手术的患者使用褪黑素,可以减轻心肌细胞炎症、氧化应激和凋亡的程度,增加射血分数和减慢心率[8]。Zhang 等[9]研究结果证实褪黑素可以减轻IRI 心肌细胞凋亡和炎症反应,这与本研究结果一致。虽然本研究在体外心肌细胞的培养和IRI模型的制作上与Zhang等[9]并不完全相同,但是都证实了褪黑素在IRI心肌细胞中的抗凋亡和抗炎作用。在机制上,与Zhang等[9]通过腺苷酸活化蛋白激酶(AMPK)信号通路研究褪黑素心肌细胞保护作用不同,笔者研究了褪黑素对Akt/FOXO4/BIM信号通路的作用。
Akt信号通路在调节细胞生长、增殖和在生理和病理生理条件下的存活方面发挥着核心作用[10]。FOXO4 是Akt 通路重要的下游分子,主要通过调控转录及信号转导途径,影响机体生理调节、应激反应、代谢、细胞凋亡和自噬等方面[11-12]。研究表明,FOXO4 在缺血再灌注引起细胞损伤中具有重要的作用[13-14]。IRI 时,FOXO4 转移到细胞核,发挥其转录因子功能,促进环磷酸腺苷(cAMP)转录,抑制缺氧诱导因子1α(HIF1α),激活纤溶酶原激活物抑制剂1(PAI-1);FOXO4还可诱导肿瘤坏死因子凋亡相关诱导配体(TRAIL)、Fas 细胞表面死亡受体配体(FasL)和BIM 等促凋亡信号通路的激活[13],参与IRI。FOXO4 与凋亡家族蛋白BIM、B 淋巴细胞瘤-6(Bcl-6)等促凋亡蛋白的启动子特异性结合,促进其转录,从而抑制B 淋巴细胞瘤-XL(Bcl-XL)等抗凋亡蛋白的转录,负性调节细胞增殖。以上研究提示,FOXO4 参与IRI,但FOXO4 是否参与褪黑素对心肌细胞缺血再灌注损伤的保护作用,目前尚少见报道。
Akt/FOXO4/BIM信号通路在细胞凋亡中具有重要作用[15]。BIM 是仅含一个BH3 结构域的Bcl-2 蛋白家族促凋亡成员,可以与Bcl-2 家族所有的促生存蛋白结合,是一种重要的促凋亡分子。FOXO4通过与BIM 启动子特异性结合,调节BIM 转录水平。Wang 等[15]研究发现,过表达FOXO4 能通过上调BIM 的表达来促进肾脏透明细胞癌的细胞凋亡,敲低BIM 能够阻断FOXO4 的促凋亡作用。这种FOXO4 依赖的BIM 促凋亡活性受到Akt 活性的调控。Lv 等[16]在人的MCF7 乳腺癌细胞系中发现,当Akt活化时,可以抑制FOXO4的转录,进而抑制BIM的转录;而PI3K抑制剂能够促进FOXO4和BIM的转录,BIM 通过与抗凋亡蛋白相互作用,释放Bax 和Bak诱导细胞凋亡。虽然本研究与Lv等[16]的研究采用不同的疾病模型,但是与其研究结果相似的是,本研究也发现褪黑素调控的Akt磷酸化水平升高通过抑制p-FOXO4 和BIM 蛋白表达,进而减少IRI 引起的细胞凋亡。
本研究初步探索了缺血再灌注损伤中褪黑素的保护机制,但褪黑素是如何调控Akt的磷酸化水平,是通过何种受体激活Akt/FOXO4/BIM 信号通路,还有待后期进一步深入研究,以期为褪黑素治疗心肌梗死提供新的治疗靶点和理论依据。

