蔓荆子黄素调控miR-378/PRRX1轴对胃癌生物学行为的影响
张丛,冯华,黄小龙,王旋
胃癌(gastric cancer,GC)是常见的消化系统肿瘤,也是癌症死亡的主要原因[1]。近年来,植物提取物及其活性成分被认为是有希望治疗癌症的候选者[2]。蔓荆子黄素(Casticin,Cas)是一种从单叶蔓荆中提取的黄酮类化合物,具有抗炎、平喘、抗血管生成和抗肿瘤活性[3]。研究表明Cas 可抑制结肠癌细胞侵袭、迁移和增殖并诱导细胞凋亡,发挥抗癌活性[4]。研究显示,Cas 可抑制GC 细胞增殖[5]。然而Cas 对GC 侵袭和迁移的影响及作用机制尚未完全明确。微小RNA(microRNA,miRNA)通过与靶基因信使RNA(mRNA)的3'非翻译区(3'-untranslated region,3'-UTR)结合引起靶基因mRNA 的降解或翻译抑制,参与GC 的发生和发展[6]。此外,miRNA 也是Cas发挥抗癌活性的潜在靶点。据报道,Cas可通过上调miR-338-3p 表达促进急性髓系白血病细胞凋亡[7];在肝癌中,Cas 可通过破坏DNA 甲基转移酶1 和miR-148a-3p 之间的相互负调节来抑制肝癌细胞的生物活性[8]。基于以上研究,笔者推测Cas 在GC 中的抗癌活性可能与miRNA 有关。研究显示,GC 组织中miR-378 表达下调,与GC 患者的不良预后和临床病理特征相关;其过表达可抑制GC细胞的侵袭、迁移和上皮-间质转化(EMT)[9]。生物信息学预测发现,配对相关同源框1(paired related homeobox 1,PRRX1)与miR-378 存在互补的结合位点,是miR-378 的潜在靶基因。PRRX1 已被报道在GC 中呈高表达,可通过调控EMT 促进GC 淋巴结转移[10]。然而,miR-378 是否能调控PRRX1 表达介导Cas的抗GC活性还未可知。本研究通过观察Cas在体外和体内的抗癌活性,探究Cas抑制GC细胞生长和转移的分子机制与miR-378/PRRX1轴的关系。
1 材料与方法
1.1 实验材料 GC 细胞系SGC-7901 购自深圳市华拓生物公司。15 只雄性BALB/c 裸鼠(SPF 级,4 周龄,体质量18~20 g)购自常州卡文斯实验动物有限公司,生产许可证号SCXK(苏)2021-0018。在(22±1)℃、50%±5%湿度、12 h 光照/12 h 黑暗的标准条件下适应性饲养1 周。本研究动物实验经医院伦理委员会批准,批准编号:L2022-(29)号。Cas(原料药,纯度≥98.9%)购自南京春秋生物工程有限公司;miR-378 小干扰RNA(siRNA)慢病毒载体、PRRX1 过表达质粒慢病毒载体、miR-378、U6 引物序列、miR-378 模拟物(miR-378 mimics)及其阴性对照(miR-NC mimics)均由上海吉至生化科技有限公司设计合成;胎牛血清、四唑盐(MTT)试剂盒、基质胶、RNA 提取试剂、RIPA 裂解液均购自厦门甄准生物技术有限公司;一体化miRNA 荧光定量PCR(qPCR)检测试剂盒、兔源PRRX1、GAPDH一抗、羊抗兔二抗、双荧光素酶检测试剂盒均购自美国MyBioSource 公司;DMEM 培养基、Lipofectamine 2000 试剂、化学发光试剂盒购自苏州极创生物科技有限公司。酶标仪(型号Infinite F200)、显微镜(型号ZEISS)、流式细胞仪(型号NanoFCM)、蛋白凝胶成像系统(型号GelView 1500P)均购自上海然哲仪器设备有限公司;Transwell 小室(型号4590)、qPCR仪(型号Esan-Gene 696)均购自天津本生健康科技有限公司。
1.2 方法
1.2.1 不同浓度Cas 对SGC-7901 细胞活力的影响 SGC-7901 细胞在添加10%胎牛血清和1%青霉素/链霉素的DMEM培养基中培养;当细胞生长至80%~90%汇合时,使用胰蛋白酶(含乙二胺四乙酸)消化后进行细胞传代。采用不同浓度的Cas(0、5、10、20、40、80 μmol/L)[11]处理对数生长期的SGC-7901 细胞,依次将其标记为Cas 0、5、10、20、40 和80 μmol/L 组,每组重复6 次,将处理后的SGC-7901 细胞(1×105个/孔)在12 孔板中传代培养48 h。然后添加10 μL MTT(5 g/L),并将细胞板在37 ℃下孵育4 h。之后,将200 μL 二甲基亚砜添加到12 孔板中。最后,通过酶标仪检测光密度(OD)490值,计算细胞活力。细胞活力=Cas各浓度组OD490值/Cas 0 μmol/L组OD490值×100%。
1.2.2 细胞分组及干预 将对数生长期的SGC-7901细胞分成:对照组、Cas 低浓度组、Cas 中浓度组、Cas 高浓度组、Cas高浓度+miR-378 siRNA 组、Cas 高浓度+PRRX1 组、Cas 高浓度+miR-378 siRNA+PRRX1 组。对照组SGC-7901 细胞在DMEM 培养基中正常培养不进行干预;Cas 低、中、高浓度组分别采用10、20、40 μmol/L 的Cas 处理SGC-7901 细胞;Cas高浓度+miR-378 siRNA 组:采用40 μmol/L 的Cas 处理SGC-7901细胞,并同时转染miR-378 siRNA慢病毒载体;Cas高浓度+PRRX1组:采用40 μmol/L 的Cas处理SGC-7901细胞,并同时转染PRRX1 过表达质粒慢病毒载体;Cas 高浓度+miR-378 siRNA+PRRX1 组采用40 μmol/L 的Cas 处理SGC-7901细胞,并同时转染miR-378 siRNA慢病毒载体和PRRX1过表达质粒慢病毒载体。每组重复6次。
1.2.3 MTT法测定细胞活力 各组细胞培养48 h后,MTT法检测SGC-7901细胞活力。细胞活力=各处理组OD490/对照组OD490×100%。
1.2.4 集落形成实验 各组细胞(1×103个/孔)在6孔板中培养2 周,使用4%多聚甲醛固定后用瑞氏-吉姆萨溶液染色。在显微镜下计数由至少50个细胞组成的集落。
1.2.5 流式细胞术检测细胞凋亡 各组细胞经胰蛋白酶消化,重悬于100 μL缓冲液中,加入5 μL Annexin V-FITC,4 ℃孵育15 min,再加入5 μL PI,4 ℃孵育5 min,洗涤后移入流式管,通过流式细胞仪检测细胞凋亡率。
1.2.6 Transwell 小室测定细胞侵袭能力 将具有8 μm 聚碳酸酯过滤膜的Transwell 小室上室中预涂30 μg 基质胶,将200 μL 处理后的SGC-7901 细胞(1×105个/mL)添加到上室中,下室中添加500 μL 含20%胎牛血清的DMEM 培养基。孵育48 h 后,用棉签刮去Transwell 小室上表面沉降的细胞,并将沉降在下表面的细胞固定,使用结晶紫染色后在显微镜下对下室中侵袭细胞进行拍照并计数。
1.2.7 划痕实验测定细胞迁移能力 处理后的SGC-7901细胞接种到24孔板中,当细胞汇合度达80%以上时,使用无菌1 mL移液器尖端轻轻刮擦单层细胞以形成划痕,然后将细胞用培养基洗涤2 次以去除脱落的细胞,培养48 h。使用显微镜拍摄0 h 和48 h 后的划痕照片,计算划痕愈合率。划痕愈合率=(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度×100%。
1.2.8 qPCR 检测细胞miR-378 表达水平 处理并培养48 h后的SGC-7901 细胞,使用RNA 提取试剂分离总RNA,然后进行逆转录反应为cDNA,使用一体化miRNA qRCR 检测试剂盒和实时PCR检测系统进行qPCR。获取循环阈值(Ct)后通过2-ΔΔCt方法来量化miR-378 表达水平。引物序列:miR-378 上游 5'-CTGCACTGGACTTGGAGTC-3' ,下游5'-GCAGGGTCCGAGGTATTA-3';内参U6 上游5'-CTCGCTTCGGCAGCACA-3',下游5'-AACGCTTCACGAATTTGCGT-3'。
1.2.9 蛋白印迹实验检测SGC-7901 细胞PRRX1 蛋白表达水平 SGC-7901 细胞培养48 h 后,采用RIPA 裂解液提取SGC-7901 细胞中的总蛋白质,对蛋白进行定量(90 μg),电泳分离蛋白并转移到PVDF膜上,用5%脱脂奶粉封闭后,将膜与兔源PRRX1(1∶1 090)、GAPDH(1∶1 120)一抗孵育24 h,然后与相应的羊抗兔二抗(1∶1 970)孵育1.5 h。最后使用化学发光试剂盒使靶向蛋白质可视化,并通过Image J 将蛋白质标准化为内参蛋白的水平。
1.2.10 双萤光素酶报告基因测定 构建含有miR-378互补结合位点的3'-UTR PRRX1 野生型(WT)和突变型(MUT)的pmirGLO 双萤光素酶载体,分别命名为PRRX1-WT 和PRRX1-MUT。通过Lipofectamine 2000 试剂将PRRX1-WT或PRRX1-MUT与miR-378 mimics或miR-NC mimics转染至SGC-7901细胞,然后进行双萤光素酶报告基因分析。
1.2.11 裸鼠异种移植瘤模型实验 将BALB/c 裸鼠分为模型组、Cas 组、Cas+miR-378 siRNA 组,每组5 只。模型组、Cas 组裸鼠接种100 μL 未经转染处理的SGC-7901 细胞(1×106个/只),Cas+miR-378 siRNA 组裸鼠接种100 μL 转染miR-378 siRNA 的SGC-7901 细胞(1×106个/只)。在肿瘤体积达到100 mm3时,Cas 组、Cas+miR-378 siRNA 组裸鼠腹腔注射10 mg/kg 的Cas(注射体积100 μL)[12];模型组裸鼠腹腔注射100 μL 生理盐水;每日注射1 次,连续14 d。药物治疗结束后,处死所有裸鼠,取出肿瘤组织,计算肿瘤体积并称质量。肿瘤体积=长×宽2/2。将肿瘤组织匀浆,使用1.2.8中的qPCR 检测肿瘤组织中miR-378表达水平。
1.3 统计学方法 应用SPSS 25.0 软件进行数据分析,符合正态分布的计量资料以均数±标准差()表示,2 组间比较行t检验,多组间比较采用单因素方差分析,进一步两两比较行SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度Cas 对SGC-7901 细胞活力的影响 与Cas 0 μmol/L 组(100.00%±0.00%)相比,Cas 5 μmol/L 组SGC-7901 细胞活力(95.07%±4.29%)差异无统计学意义(P>0.05),而Cas 10、20、40、80 μmol/L组SGC-7901细胞活力呈浓度依赖性降低(分别为81.12%±7.62%、68.24%±6.53%、52.03%±5.07%、42.13%±4.85%,F=115.368,P<0.05,n=6),为保证SGC-7901 细胞具有一定的存活数量以进行后续实验,故将10、20、40 μmol/L 的Cas 作为后续研究浓度。
2.2 各组细胞活力、集落形成数量、细胞凋亡率比较 与对照组相比,Cas 低、中、高浓度组SGC-7901细胞活力、集落形成数量依次降低,细胞凋亡率依次升高(P<0.05);与Cas 高浓度组相比,Cas 高浓度+miR-378 siRNA 组和Cas 高浓度+PRRX1 组SGC-7901 细胞活力、集落形成数量升高,细胞凋亡率降低(P<0.05);与Cas 高浓度+miR-378 siRNA 组相比,Cas高浓度+PRRX1组SGC-7901细胞活力、集落形成数量、细胞凋亡率差异无统计学意义(P>0.05);与Cas 高浓度+miR-378 siRNA 组和Cas 高浓度+PRRX1 组相比,Cas 高浓度+miR-378 siRNA+PRRX1组SGC-7901细胞活力、集落形成数量升高,细胞凋亡率降低(P<0.05),见图1、2,表1。
Tab.1 Comparison of SGC-7901 cell viability,colony formation number and cell apoptosis rate between the seven groups表1 各组SGC-7901细胞活力、集落形成数量、细胞凋亡率比较(n=6,)
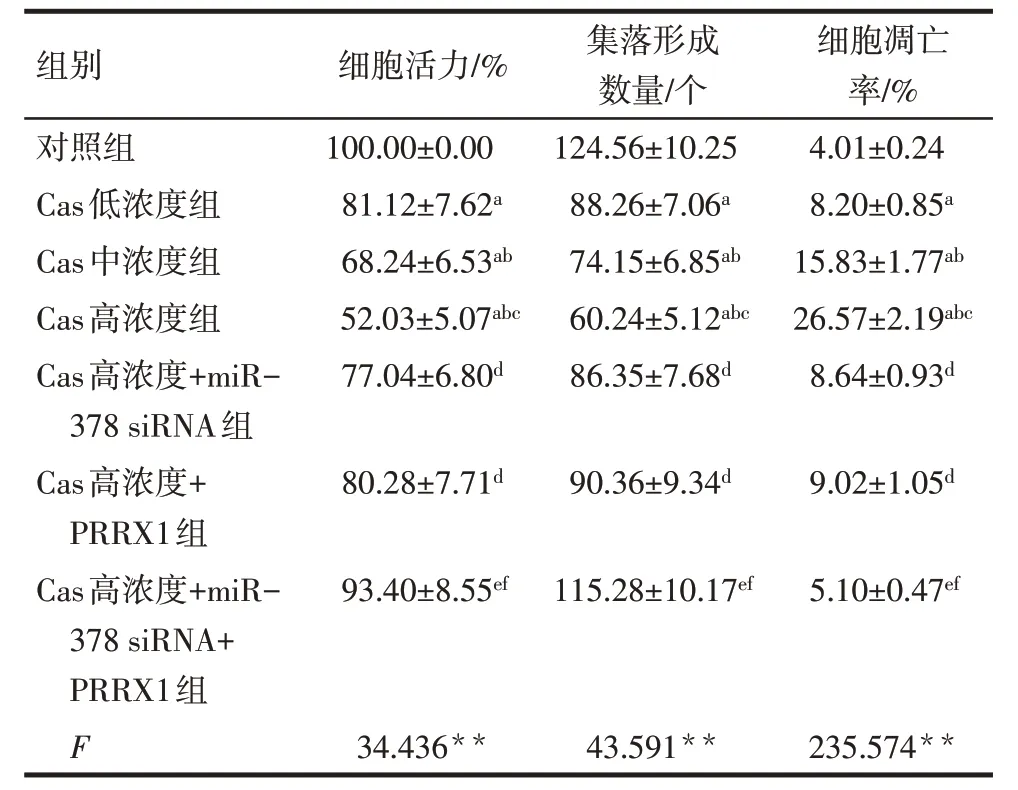
Tab.1 Comparison of SGC-7901 cell viability,colony formation number and cell apoptosis rate between the seven groups表1 各组SGC-7901细胞活力、集落形成数量、细胞凋亡率比较(n=6,)
**P<0.01;a与对照组比较,b与Cas低浓度组比较,c与Cas中浓度组比较,d与Cas 高浓度组比较,e与Cas 高浓度+miR-378 siRNA 组比较,f与Cas高浓度+PRRX1组比较,P<0.05。
?
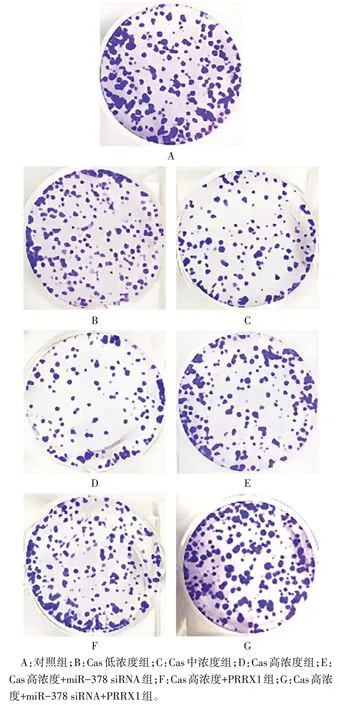
Fig.1 Colony formation of SGC-7901 cells in each group(Reich-Giemsa staining,×100)图1 各组SGC-7901细胞集落形成情况(瑞氏-吉姆萨染色,×100)
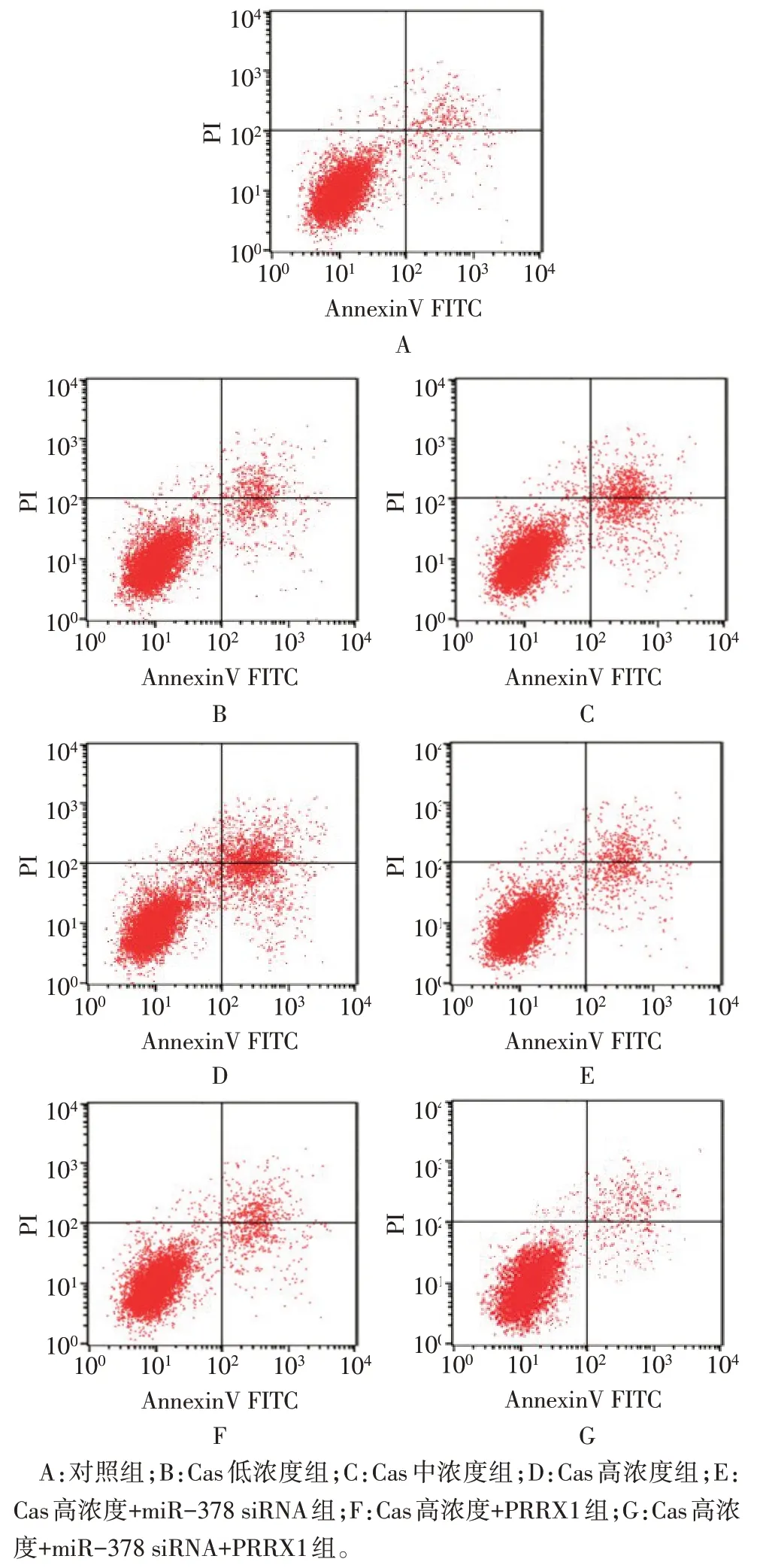
Fig.2 Flow chart of SGC-7901 cell apoptosis in each group图2 各组SGC-7901细胞凋亡流式图
2.3 各组细胞侵袭和迁移能力比较 与对照组相比,Cas低、中、高浓度组的侵袭细胞数量及划痕愈合率依次降低(P<0.05);与Cas 高浓度组相比,Cas 高浓度+miR-378 siRNA 组和Cas 高浓度+PRRX1 组侵袭细胞数量、划痕愈合率升高(P<0.05);与Cas高浓度+miR-378 siRNA 组相比,Cas 高浓度+PRRX1 组侵袭细胞数量、划痕愈合率差异无统计学意义(P>0.05);与Cas 高浓度+miR-378 siRNA 组和Cas 高浓度+PRRX1 组相比,Cas 高浓度+miR-378 siRNA+PRRX1 组侵袭细胞数量、划痕愈合率升高(P<0.05)。见表2,图3、4。
Tab.2 Comparison of the number of invasive cells and scratch healing rate of SGC-7901 cells between the seven groups表2 各组SGC-7901细胞侵袭细胞数量和划痕愈合率比较(n=6,)
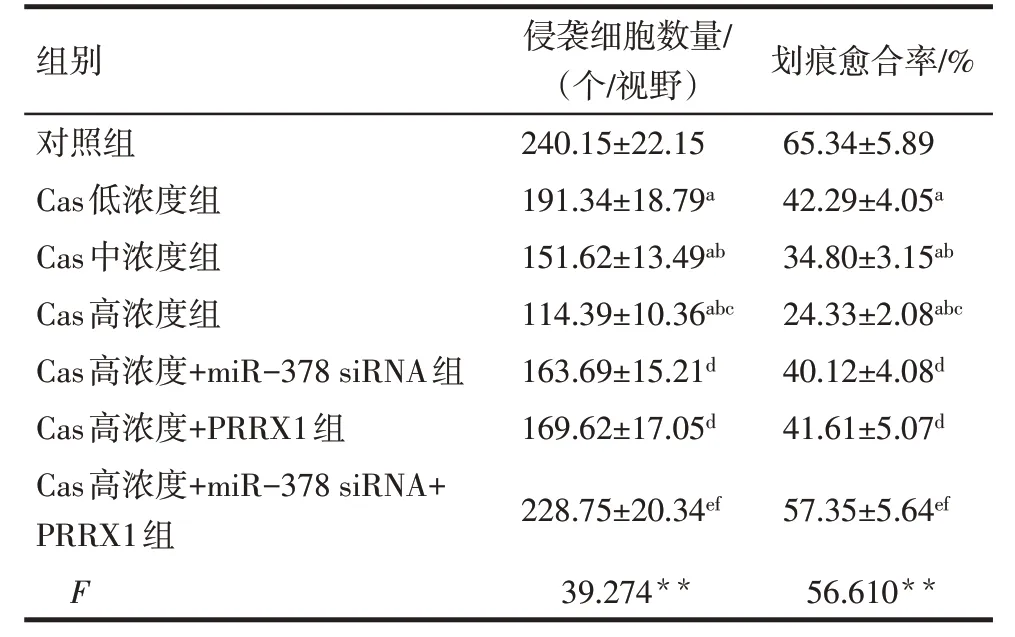
Tab.2 Comparison of the number of invasive cells and scratch healing rate of SGC-7901 cells between the seven groups表2 各组SGC-7901细胞侵袭细胞数量和划痕愈合率比较(n=6,)
**P<0.01;a与对照组比较,b与Cas低浓度组比较,c与Cas中浓度组比较,d与Cas 高浓度组比较,e与Cas 高浓度+miR-378 siRNA 组比较,f与Cas高浓度+PRRX1组比较,P<0.05。
?
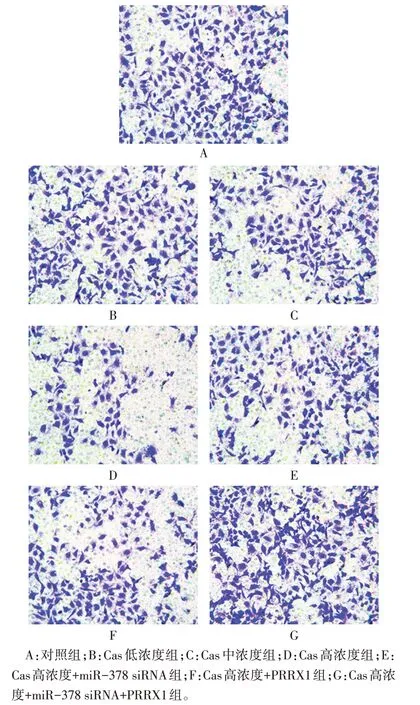
Fig.3 Invasion map of SGC-7901 cells in the lower compartment of Transwell cell in each group(crystal violet staining,×200)图3 各组Transwell小室下室中SGC-7901细胞侵袭图(结晶紫染色,×200)

Fig.4 SGC-7901 cell migration diagram of each group(×100)图4 各组SGC-7901细胞迁移图(×100)
2.4 各组细胞miR-378 和PRRX1 蛋白表达水平比较 与对照组相比,Cas 低、中、高浓度组SGC-7901细胞miR-378 表达水平依次升高,PRRX1 蛋白表达水平依次降低(P<0.05);与Cas 高浓度组相比,Cas高浓度+miR-378 siRNA 组miR-378表达水平降低,PRRX1 蛋白表达水平升高(P<0.05),Cas 高浓度+PRRX1 组miR-378 表达水平差异无统计学意义(P>0.05),PRRX1蛋白表达水平升高(P<0.05);与Cas 高浓度+miR-378 siRNA 组相比,Cas 高浓度+PRRX1组miR-378表达水平升高(P<0.05),PRRX1蛋白表达水平差异无统计学意义(P>0.05),Cas 高浓度+miR-378 siRNA+PRRX1组miR-378表达水平差异无统计学意义(P>0.05),PRRX1蛋白表达水平升高(P<0.05);与Cas 高浓度+PRRX1 组相比,Cas高浓度+miR-378 siRNA+PRRX1 组SGC-7901 细胞miR-378 表达水平降低,PRRX1 蛋白表达水平升高(P<0.05)。见图5、表3。
Tab.3 Comparison of miR-378 and PRRX1 protein expression levels between the seven groups of SGC-7901 cells表3 各组SGC-7901细胞miR-378和PRRX1蛋白表达水平比较(n=6,)
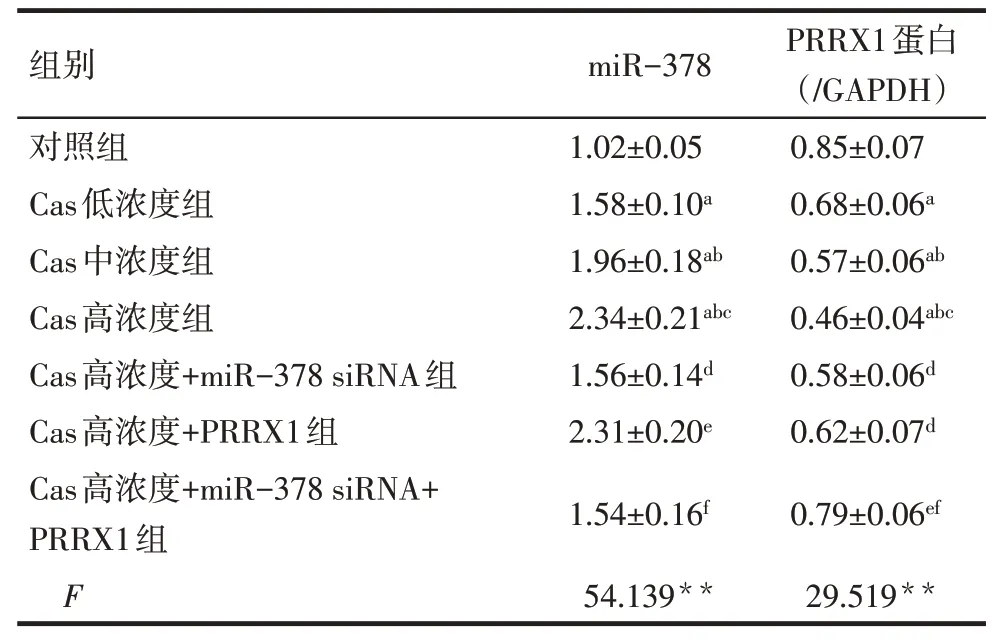
Tab.3 Comparison of miR-378 and PRRX1 protein expression levels between the seven groups of SGC-7901 cells表3 各组SGC-7901细胞miR-378和PRRX1蛋白表达水平比较(n=6,)
**P<0.01;a与对照组比较,b与Cas低浓度组比较,c与Cas中浓度组比较,d与Cas 高浓度组比较,e与Cas 高浓度+miR-378 siRNA 组比较,f与Cas高浓度+PRRX1组比较,P<0.05。
?
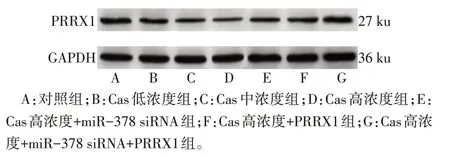
Fig.5 PRRX1 protein blotting of SGC-7901 cells in each group图5 各组SGC-7901细胞PRRX1蛋白印迹图
2.5 miR-378 靶向调控PRRX1 表达 Starbase 和miRwalk 网站预测到PRRX1 的3'-UTR 区域含有miR-378特异性结合的序列,见图6。双萤光素酶报告基因实验结果显示,与miR-NC mimics和PRRX1-WT 共转染相比,miR-378 mimics 和PRRX1-WT 共转染荧光素酶相对活性降低(P<0.05);miR-NC mimics 和PRRX1-MUT 共转染与miR-378 mimics 和PRRX1-MUT 共转染荧光素酶相对活性差异无统计学意义(P>0.05)。见表4。
Tab.4 Comparison of relative activity of luciferase between the two groups of SGC-7901 cells表4 各组SGC-7901细胞荧光素酶相对活性比较(n=6,)
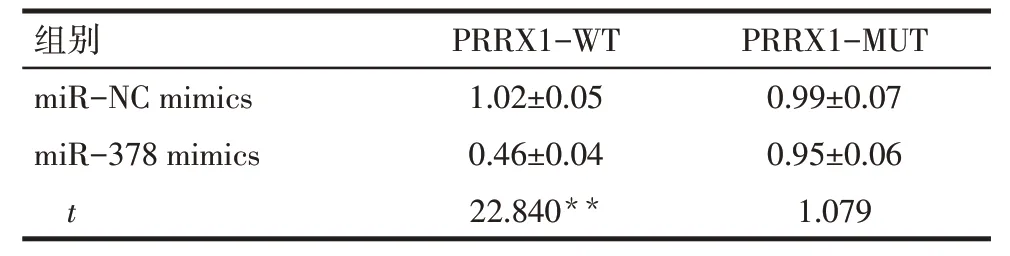
Tab.4 Comparison of relative activity of luciferase between the two groups of SGC-7901 cells表4 各组SGC-7901细胞荧光素酶相对活性比较(n=6,)
**P<0.01。
?
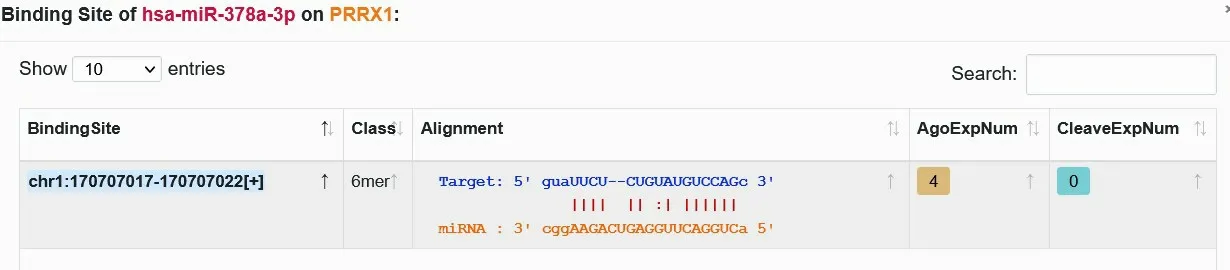
Fig.6 Nucleotide sequence of complementary binding of PRRX1 3'-UTR and miR-378 predicted by Starbase图6 Starbase预测的PRRX1 3'-UTR与miR-378互补结合的核苷酸序列
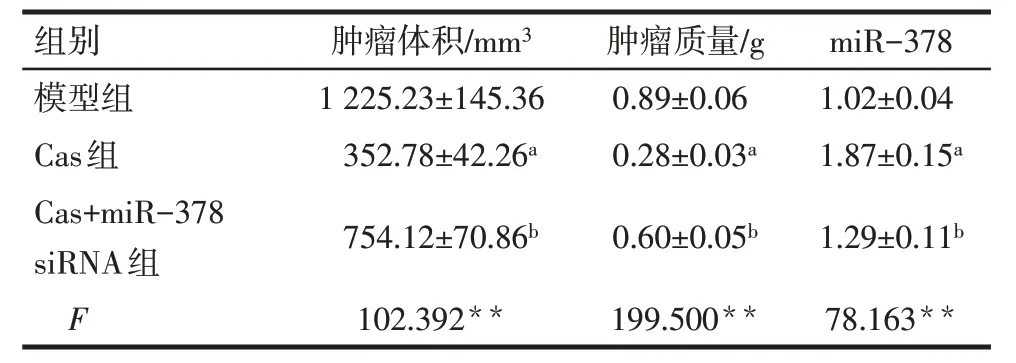
2.6 Cas在体内发挥抗肿瘤活性并促进miR-378表达 与模型组相比,Cas组裸鼠肿瘤体积、质量降低,肿瘤组织miR-378 表达水平升高(P<0.05);与Cas组相比,Cas+miR-378 siRNA 组肿瘤体积、质量升高,肿瘤组织miR-378表达水平降低(P<0.05)。见图7、表5。
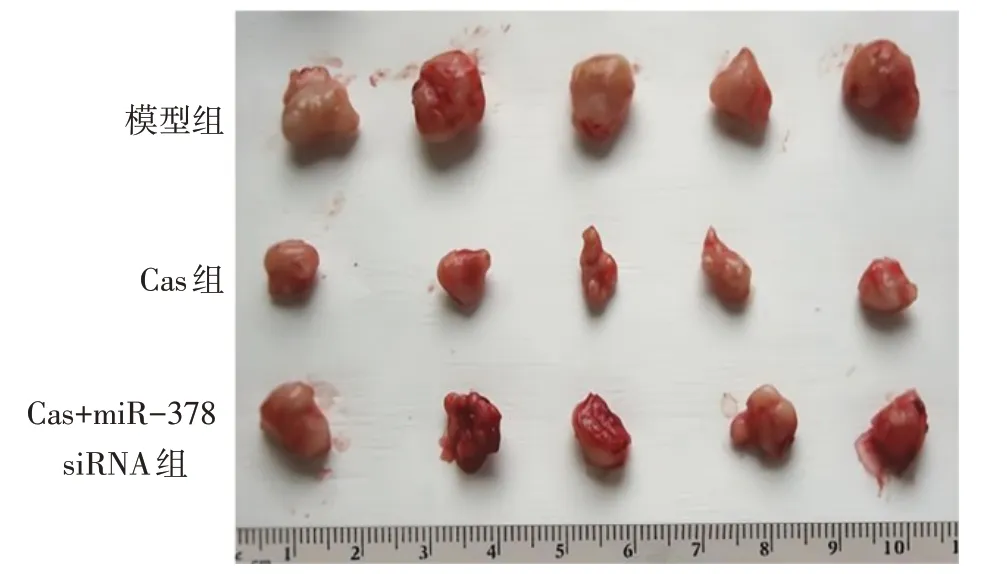
Fig.7 Representative pictures of tumor tissue formed in xenotransplantation nude mouse models in each group图7 各组异种移植裸鼠模型中形成的肿瘤组织代表性图片
3 讨论
3.1 Cas 可抑制SGC-7901 细胞的生物学活性 GC的标准治疗包括手术、放疗和化疗。癌细胞的转移是导致治疗失败的主要原因之一[1]。鉴于转移性GC患者的临床效果较差,故而抑制转移对于提高生存率至关重要[13]。黄酮类化合物是一种多酚类物质,广泛存在于食用植物中,具有抗炎、抗病毒、抗血栓、抗菌、抗肿瘤和抗突变等作用。木犀草素是一种广泛存在于水果和蔬菜中的天然黄酮类化合物,可通过调节miRNA在GC中发挥抗肿瘤活性[14]。槲皮素可调节多种肿瘤相关的miRNAs,包括miR-16、miR-216等,阻断肿瘤的发生和发展[15-16]。Cas已被证实在多种癌症中具有抗肿瘤活性,如口腔癌[17]、食管癌[12]和胃癌[5]等。在本研究中,Cas处理以浓度依赖性方式抑制SGC-7901 细胞增殖。在集落形成和凋亡实验中,Cas 降低了SGC-7901 细胞的集落形成能力,提高了细胞凋亡率;这进一步证实了Cas在体外可抑制SGC-7901 细胞的生长。此外,Cas 在裸鼠体内可抑制移植瘤的生长。癌细胞迁移和侵袭是肿瘤转移的关键[18]。在本研究中,Cas 降低了SGC-7901细胞侵袭和迁移能力,提示Cas在GC中具有潜在的抗癌作用。
Tab.5 Comparison of tumor volume,tumor weight and miR-378 expression level in tumor tissue ofxenotransplantation nude mice between the three groups表5 各组异种移植裸鼠模型中肿瘤体积、肿瘤质量及肿瘤组织中miR-378表达水平比较(n=5,)
Tab.5 Comparison of tumor volume,tumor weight and miR-378 expression level in tumor tissue ofxenotransplantation nude mice between the three groups表5 各组异种移植裸鼠模型中肿瘤体积、肿瘤质量及肿瘤组织中miR-378表达水平比较(n=5,)
**P<0.01;a与模型组比较,b与Cas组比较,P<0.05。
?
3.2 Cas 通过调节miR-378/PRRX1 轴在SGC-7901细胞中发挥抗癌作用 miR-378 是一种多功能miRNA,参与肿瘤细胞的恶性生物学行为。虽然对miR-378 的研究较多,但其作用仍存在争议。Jin等[19]研究显示,miR-378 在食管鳞状细胞癌中表达降低,低表达的miR-378患者预后更差,且miR-378低表达可促进癌细胞增殖、迁移和侵袭,在食管鳞状细胞癌的发生和发展过程中充当肿瘤抑制因子。Wang等[20]研究表明,miR-378在卵巢癌中充当促癌因子,敲低miR-378可通过直接调控其下游靶基因,减少增殖和迁移相关蛋白来抑制血管生成和卵巢癌细胞的恶性生物学行为。而在GC 中,已被证实miR-378 充当肿瘤抑制因子,上调其表达可通过调控其靶基因抑制GC 细胞侵袭、迁移和EMT 过程[9]。miR-378在不同肿瘤中发挥不同作用的原因推测可能与肿瘤类型和其下游靶基因有关。PRRX1 是配对同源框家族的成员之一,其可通过调控多种信号通路(如转化生长因子-β 通路、Wnt/β-连环蛋白通路和Notch 通路)影响肿瘤EMT 的发生[21]。另外,PRRX1 已被证实为GC 中一种新的EMT 诱导剂,并且PRRX1 可能通过调节EMT 促进GC 转移,进而影响患者预后,可作为预测或预防GC转移的新生物指标[10]。在本研究中,Cas 可上调SGC-7901 细胞中miR-378 表达,抑制PRRX1 表达,并且生物信息学分析和双萤光素酶报告基因实验证实PRRX1 是miR-378 的靶基因。为了进一步验证两者在Cas 抗肿瘤作用中的功能,本研究在Cas处理的基础上,用miR-378 siRNA 或PRRX1 过表达质粒转染SGC-7901 细胞,结果显示,下调miR-378 表达或上调PRRX1 表达可部分逆转Cas 对SGC-7901 细胞恶性生物学行为的影响;且下调miR-378 表达联合PRRX1 过表达可显著拮抗Cas 对SGC-7901 细胞恶性生物学行为的抑制作用。提示Cas可能通过调节miR-378/PRRX1 轴抑制SGC-7901 细胞的增殖和转移。
综上所述,本研究在体内和体外证明了Cas 对SGC-7901 细胞的抗肿瘤活性,且证实了miR-378/PRRX1 轴可能涉及此过程,从而初步揭示了Cas 抗GC 的分子机制。这对于将Cas 开发为抗癌药物奠定了理论基础。然而,Cas 在其他GC 细胞系中是否具有相同的抗癌活性仍需进一步探讨。

