Mesothelin对乳腺癌细胞MDA-MB-231生物学行为的影响
李宇翔,李葛,高振芳,侯春梅,韩根成,孙慧燕,王立生
三阴性乳腺癌(TNBC)是乳腺癌常见的亚型,其雌激素受体、孕激素受体及人表皮生长因子受体2表达均为阴性[1-2]。TNBC侵袭性高、预后差,其对内分泌治疗无效,且目前尚无可利用的分子靶向药物,亟待寻找新的治疗方法[3]。间皮素(Mesothelin)是一种分子质量为40 ku的细胞表面糖蛋白,在正常组织中很少表达,但在多种恶性肿瘤中高表达[4]。研究发现Mesothelin 在肿瘤的发生发展中发挥重要作用,与肿瘤的浸润转移密切相关[5]。在TNBC 中,67%的患者过度表达Mesothelin,且与肿瘤分化程度和肿瘤大小呈正相关,提示其可能是TNBC 新的治疗靶点[6]。因此,全面深入地认识Mesothelin对乳腺癌细胞生物学特性的调控作用,对TNBC 的治疗具有重要的临床意义。目前有关Mesothelin 在TNBC中的研究多倾向于分析其表达情况与临床病理特征的关系,而Mesothelin 对TNBC细胞特定生物学行为影响的研究较少。本研究观察了Mesothelin 对TNBC细胞系MDA-MB-231细胞增殖、凋亡、迁移和侵袭能力等生物学行为的影响,并阐释其分子机制,旨在为以Mesothelin为靶点的TNBC治疗提供依据。
1 材料与方法
1.1 材料 MDA-MB-231细胞、MCF-7细胞(雌激素受体及孕激素受体表达阳性)、293T 细胞及HT1080 细胞购自美国ATCC;DMEM培养基、胎牛血清、青-链霉素和磷酸盐缓冲液(PBS)购自美国Gibco 公司;Trizol 购自美国Invitrogen 公司;荧光定量PCR 试剂盒购自日本同仁公司;转录试剂盒、蛋白定量试剂盒、ECL 发光剂、PVDF 膜购自美国Thermo 公司;Annexin V-APC/PI 细胞凋亡检测试剂盒购自天津三箭生物技术公司;PCR 引物购自上海生工生物工程有限公司;大鼠抗人Mesothelin-APC流式抗体及大鼠抗人Mesothelin免疫组化抗体购自美国R&D Systems 公司;RIPA 裂解液、PMSF、Western blot 制胶液均购自北京索莱宝科技有限公司;Mesothelin 过表达慢病毒质粒及对照质粒[均携带绿色荧光蛋白(GFP)基因序列]购自PPL公司;Transwell小室购自美国Corning 公司;兔抗人抗B 淋巴细胞瘤-2 基因(Bcl-2)抗体、Bcl-2关联X蛋白(Bax)抗体购自英国Abcam公司;小鼠抗人E-钙黏蛋白(E-cadherin)抗体、兔抗人N-钙黏蛋白(Ncadherin)抗体、小鼠抗人波形蛋白(Vimentin)抗体、兔抗人Mesothelin 抗体购自美国CST 公司;小鼠抗人α-微管蛋白(α-Tubulin)抗体及辣根过氧化物酶(HRP)标记的山羊抗兔和山羊抗鼠IgG 抗体购自中杉金桥公司;FACS Calibur 型流式细胞仪购自美国Becton Dickinson 公司;7500 Fast Real-Time PCR 仪购自美国AB Applied Biosystems 公司;Varioskan Flash酶标仪、紫外分光光度计、细胞培养箱及低温高速离心机购自美国Thermo公司;电泳仪购自美国BIO-RAD公司;荧光显微镜和普通光学显微镜购自日本Olympus公司;Mesothelin过表达慢病毒及对照病毒由军事医学研究院神经免疫与抗体工程实验室制备。乳腺癌样本取自6例TNBC手术患者,样本使用不对人体造成伤害,不涉及敏感个人信息或商业利益。
1.2 研究方法
1.2.1 细胞培养 MDA-MB-231细胞、MCF-7细胞、293T细胞及HT1080细胞用含10%胎牛血清和1%双抗(青-链霉素)的DMEM 培养基于37 ℃、5%CO2饱和湿度的培养箱中培养,取对数生长期细胞用于实验。
1.2.2 免疫组织化学染色检测Mesothelin 表达 将TNBC 肿瘤组织及癌旁组织制成石蜡切片,脱蜡、水化、阻断、抗原修复、封闭,5%BSA室温放置30 min,滴加适量Mesothelin抗体,4 ℃孵育过夜。然后用PBS 清洗3 次,二抗室温孵育1 h。PBS清洗后,滴加适量二氨基联苯胺法(DAB)显色液5~10 min,灭菌水冲洗5 min。封片后显微镜下观察乳腺癌组织中Mesothelin 蛋白的表达,使用Image-Pro Plus 6.0 软件计算每张照片阳性的累积光密度值(IOD)以及组织的像素面积(AREA),并求出面密度,面密度=IOD/AREA。
在盖玻片上培养MDA-MB-231、MCF-7细胞,用10%中性甲醛固定10 min,灭菌水轻洗10 min,用PBS 洗5 min,3%H2O2室温封闭10 min,消除内源性过氧化物酶,用PBS 洗5 min。正常山羊血清室温封闭10 min,每张盖玻片滴加特异性Mesothelin抗体或IgG同型对照抗体,4 ℃孵育过夜。之后用PBS 洗5 min,滴加生物素标记山羊抗鼠、山羊抗兔二抗37 ℃孵育30 min,用PBS室温下洗5 min,滴加链霉卵白素标记的辣根过氧化物酶,37 ℃孵育30 min,PBS 洗5 min,使用DAB显色30 min,光学显微镜下观察至细胞内胞浆阳性颜色(黄棕色)与细胞外背景颜色对比度反差明显时,提示Mesothelin在细胞内表达,用蒸馏水终止反应并拍照。
1.2.3 慢病毒包装、转染 通过磷酸盐共沉淀法分别将编码Mesothelin 慢病毒质粒及对照Scramble 质粒与包装质粒(pSPAX2)和包膜质粒(pMD2G)一起转染293T 细胞。在转染后24、36、48 h收集培养上清液,并对上清液进行过滤和浓缩制备慢病毒。通过将慢病毒转染HT1080细胞来测定病毒滴度。将对数生长期的MDA-MB-231细胞以1×105个/mL的密度接种到6 孔板中,每孔2 mL。将过表达Mesothelin 慢病毒质粒(Mesothelin 组)及对照Scramble 质粒(Scramble 组)以5 倍感染复数(MOI)感染MDA-MB-231 细胞。未感染的MDA-MB-231细胞为Control 组。感染48 h后流式细胞仪检测病毒的感染效率,GFP阳性细胞为成功感染病毒的细胞。
1.2.4 实时荧光定量PCR(qPCR)检测细胞Mesothelin mRNA表达 使用Trizol 法提取3 组细胞总RNA,逆转录得到cDNA 后行qPCR 检测。β-actin 引物序列:上游5'-CATCCTCACCCTGAAGTACCC-3',下游5'-AGCCTGGATAGCAACGTACATG-3';Mesothelin 引物序列:上游5'-CTCAACCCAGATGCGTTCTCG-3',下游5'-AGGTCCACATTGGCCTTCGT-3'。反应体系:2×SYBR SuperMix Plus 10 μL,上、下游引物各0.5 μL,cDNA 1 μL,DEPC 处理水8 μL。反应条件:95 ℃1 min;95 ℃20 s,60 ℃20 s,72 ℃30 s,40 个循环。以β-actin为内参,采用2-ΔΔCt法计算Mesothelin的相对表达量。
1.2.5 流式细胞术检测Mesothelin表达 收集病毒感染后的MDA-MB-231细胞,PBS轻柔清洗3次,离心弃去上清液。制成1×107个/mL 细胞悬液,然后加入5 μL 人Mesothelin-APC流式抗体,4 ℃避光孵育30 min。孵育结束后,加入PBS清洗3次,离心弃上清液,沉淀加入300 μL染色缓冲液重悬后,用流式细胞仪进行检测Mesothelin表达。
1.2.6 Western blot检测细胞蛋白表达水平 用RIPA裂解慢病毒感染后的细胞,12 000 r/min 离心10 min 后留取上清液。使用BCA法测蛋白浓度,随后进行SDS-PAGE电泳并转移到PVDF膜上,用5%脱脂奶粉室温摇床封闭2 h,之后分别加入Mesothelin(1∶1 000)、Bax(1∶1 000)、Bcl-2(1∶1 000)、Ecadherin(1∶1 000)、N-cadherin(1∶1 000)、Vimentin(1∶1 000)、α-Tubulin(1∶2 000)一抗,4 ℃孵育过夜。次日将PVDF 膜用TBST 洗3 次。随后分别加入HRP 标记的山羊抗兔IgG(1∶5 000)或山羊抗鼠IgG(1∶5 000),室温孵育2 h,TBST 洗3 次,加入ECL 发光液显影,并使用凝胶成像系统拍照并计算条带相对灰度值,以目的蛋白与内参蛋白的比值计算蛋白相对表达水平。
1.2.7 CCK-8 检测细胞增殖 取对数生长期的慢病毒感染后的MDA-MB-231细胞,以3×104/mL密度接种到96孔板中,每孔100 μL。空白对照组只加入100 μL 培养基。在37 ℃、5%CO2及饱和湿度条件下分别培养24、48、72和96 h,每个时间点设3 个复孔,每孔加入CCK-8 试剂10 μL,继续孵育4 h后,使用酶标仪在450 nm 波长处检测光密度(OD)值。细胞增殖率(%)=(该组细胞某时间OD 值-空白对照组OD 值)/(该组细胞0 h OD值-空白对照组OD值)×100%。
1.2.8 细胞凋亡检测 取对数生长期的慢病毒感染后的MDA-MB-231 细胞,以1×105/mL 的密度接种到6 孔板中,每孔2 mL 细胞悬液,每组均设3 个平行孔。置于37 ℃、5%CO2及95%湿度培养箱培养24 h和48 h后,标记Annexin V和PI,室温避光孵育15 min后,上流式细胞仪进行检测。细胞凋亡率(%)= Annexin-V+PI-细胞比例(早期凋亡细胞的比例)+Annexin-V+PI+细胞比例(晚期凋亡细胞的比例)。
1.2.9 划痕实验检测细胞迁移能力 收集各组MDA-MB-231 细胞,以1×105/mL 的密度接种到6 孔板中,每孔2 mL 细胞悬液,每组均设3 个平行孔。置于37 ℃、5%CO2及95%湿度的恒温环境中培养,待细胞铺至90%后,使用200 μL移液枪头于各孔板正中由上至下垂直划痕,PBS 冲洗细胞板3 次后,去除脱落细胞。分别在划痕后0、12、24 h 用光学显微镜在同一视野拍照记录。使用Image J 软件分析各组MDAMB-231 细胞迁移的面积,计算划痕愈合率(%)=(初始划痕面积-某时间点的划痕面积)/初始划痕面积×100%。
1.2.10 Transwell实验检测细胞的侵袭能力 对Transwell小室上室底膜面均匀预铺Matrigel基质胶。Transwell小室置于24 孔板中,无血清培养基重悬各组MDA-MB-231 细胞制作细胞悬液,细胞密度1×105个/mL,每组重复3孔。各组取200 μL细胞悬液接种至Transwell小室上室,下室加入500 μL含10%胎牛血清的细胞培养基,置于37 ℃、5%CO2及95%湿度环境中培养24 h。培养结束后,取出Transwell 小室,PBS 洗2 次,棉签去除小室上室面未穿膜的细胞,使用4%多聚甲醛固定细胞30 min,用0.1%结晶紫溶液染色10 min,于倒置显微镜下拍照,随机读取3个视野计数侵袭细胞数。
1.3 统计学方法 采用GraphPad Prism 8.0软件进行数据分析,计量资料以表示。2组间比较采用t检验,多组间比较采用单因素方差分析,组间多重比较采用Tukey 检验。P<0.05为差异有统计学意义。
2 结果
2.1 Mesothelin 在肿瘤组织及细胞系中的表达 免疫组织化学染色显示,TNBC 肿瘤组织中Mesothelin表达高于癌旁组织(18.83±2.98vs.0.81±0.09;n=6,t=5.512,P<0.05),见图1。Mesothelin 在MCF-7 细胞和MDA-MB-231细胞中均有表达,见图2。
2.2 慢病毒介导MDA-MB-231 细胞对Mesothelin表达的影响 慢病毒感染后Mesothelin 组及Scramble组细胞可见大量绿色荧光,2组慢病毒感染效率均达到90%以上,见图3。qPCR 结果显示,Control 组与Scramble 组细胞内Mesothelin mRNA 水平差异无统计学意义;与Scramble 组相比,Mesothelin组细胞内Mesothelin mRNA表达水平升高(P<0.05),见表1。流式细胞术检测结果显示,Control 组与Scramble 组Mesothelin 阳性细胞比例差异无统计学意义;与Scramble 组相比,Mesothelin 组表达Mesothelin 阳性细胞比例增加(P<0.05),见图4A、表1。Western blot 结果显示,Control 组与Scramble 组细胞内Mesothelin 蛋白表达差异无统计学意义;与Scramble 组相比,Mesothelin 组细胞内Mesothelin蛋白水平升高(P<0.05),见图4B、表1。
Tab.1 Comparison of the proportion of mesothelin positive cells,relative mRNA and protein expression of mesothelin between three groups of MDA-MB-231 cells表1 各组细胞中Mesothelin阳性细胞比例、Mesothelin mRNA和蛋白表达水平比较 (n=3,)
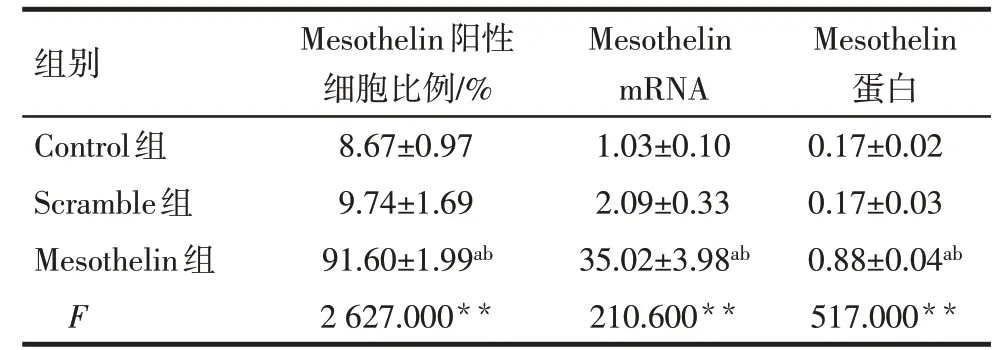
Tab.1 Comparison of the proportion of mesothelin positive cells,relative mRNA and protein expression of mesothelin between three groups of MDA-MB-231 cells表1 各组细胞中Mesothelin阳性细胞比例、Mesothelin mRNA和蛋白表达水平比较 (n=3,)
**P<0.01;a 与Control 组相比,b 与Scramble 组相比,P<0.05;表2—4同。
?
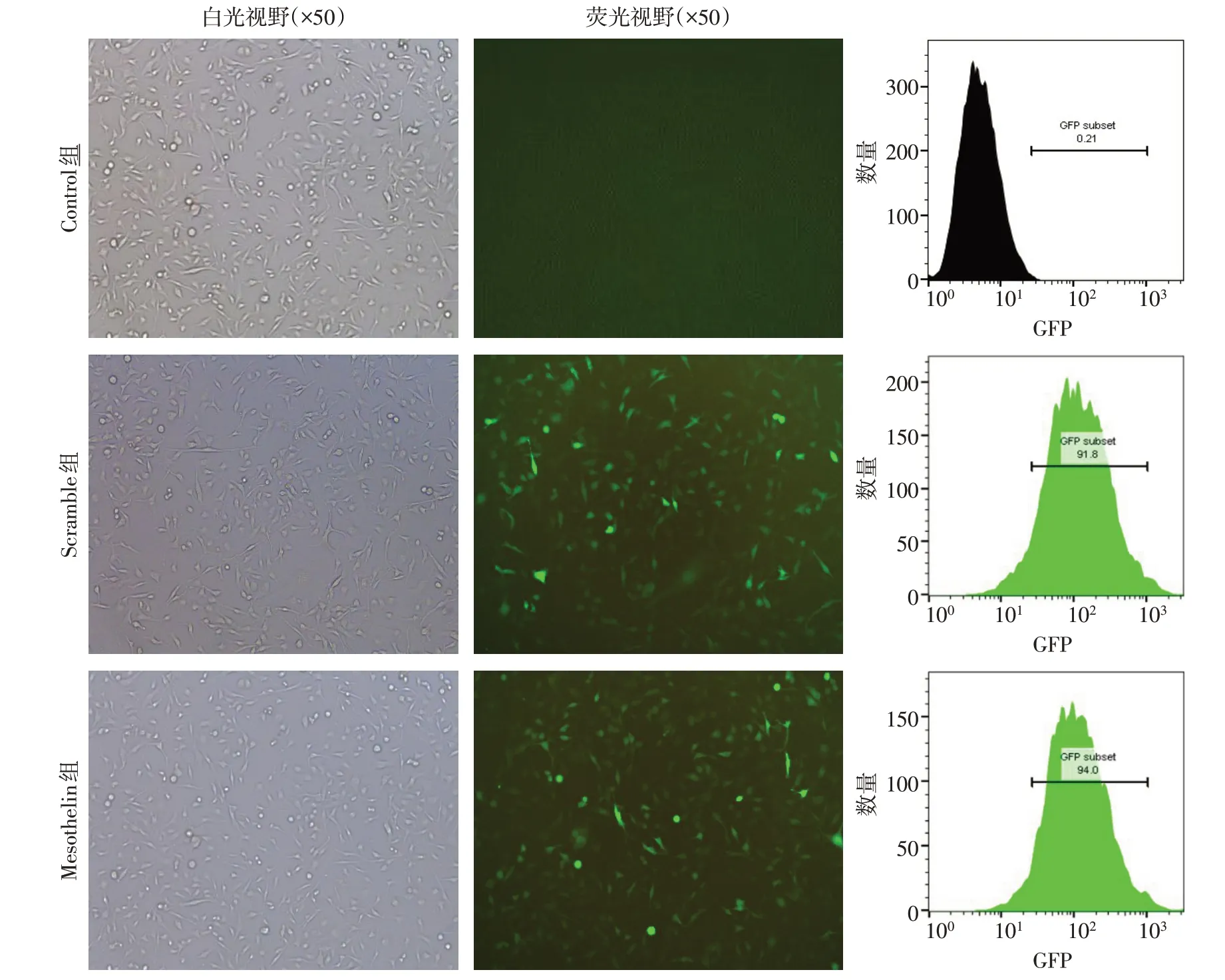
Fig.3 Detection of transfection efficiency of lentivirus图3 慢病毒转染效率的检测
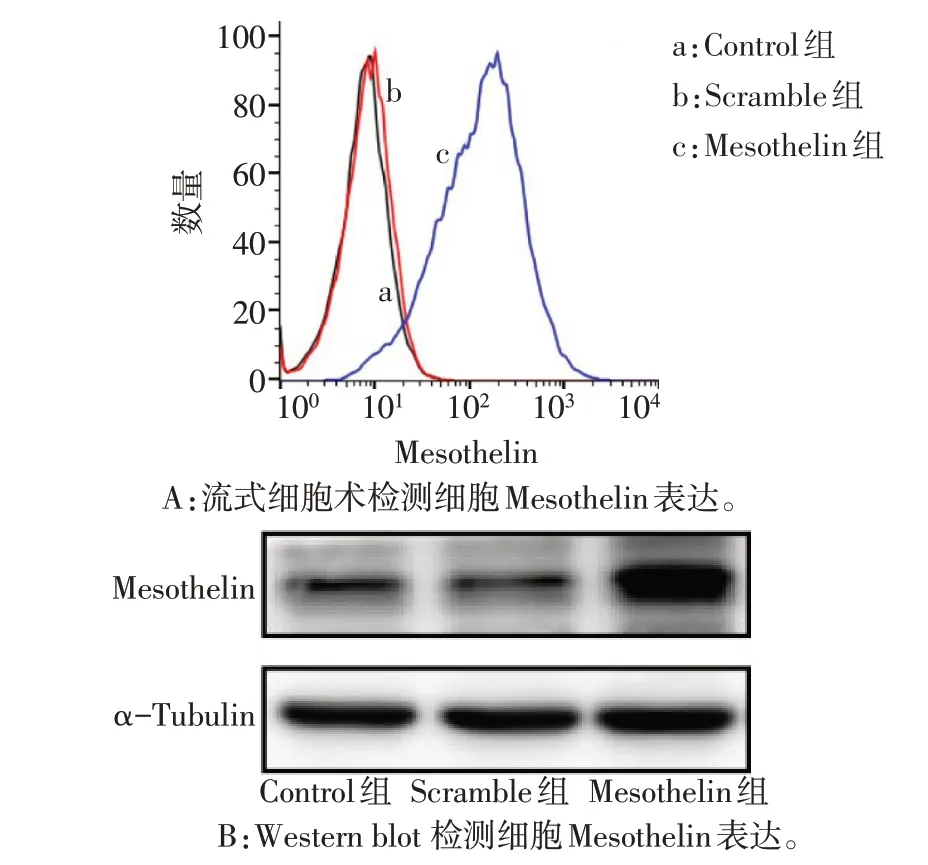
Fig.4 Lentivirus mediated overexpression of Mesothelin in MDA-MB-231 cells图4 慢病毒感染MDA-MB-231细胞检测Mesothelin的表达
2.3 过表达Mesothelin 对MDA-MB-231 细胞的增殖、凋亡的影响 CCK-8 结果显示,Control 组与Scramble 组各时间点细胞增殖率差异无统计学意义;与Scramble组比较,Mesothelin组细胞72 h和96 h细胞增殖率升高(P<0.05),见表2。AnnexinV/PI 染色结果显示,Control 组与Scramble 组各时间点细胞凋亡率差异无统计学意义;与Scramble 组比较,Mesothelin 组MDA-MB-231细胞24 h和48 h凋亡率降低(P<0.05),见表3、图5。Western blot 结果显示,Control组与Scramble组细胞Bax及Bcl-2蛋白表达差异无统计学意义;与Scramble 组比较,Mesothelin 组Bax 蛋白表达减少,Bcl-2 蛋白表达增加(P<0.05),见图6、表4。
Tab.2 Comparison of proliferation in different time points between three groups of cells表2 各组细胞不同时间点增殖率比较(n=3,%,)
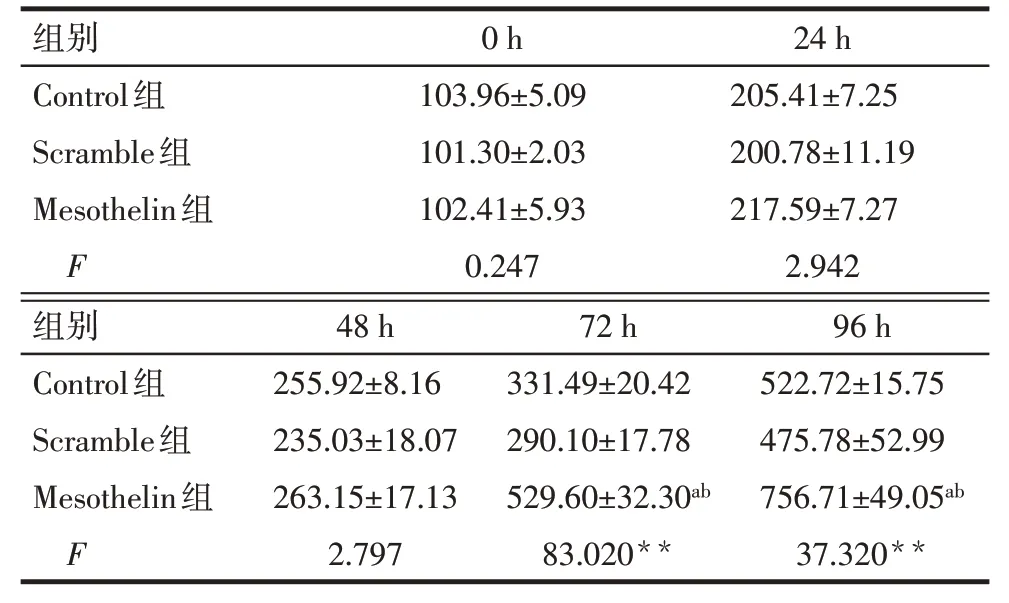
Tab.2 Comparison of proliferation in different time points between three groups of cells表2 各组细胞不同时间点增殖率比较(n=3,%,)
?
Tab.3 Comparison of apoptosis rate,migration and invasion between three groups of cells表3 各组细胞凋亡、迁移和侵袭情况比较(n=3,)
Tab.3 Comparison of apoptosis rate,migration and invasion between three groups of cells表3 各组细胞凋亡、迁移和侵袭情况比较(n=3,)
?
Tab.4 Comparison of relative expression levels of Mesothelin,Bax,Bcl-2,E-cadherin,N-cadherin and Vimentin between three groups of cells表4 各组细胞中Bax、Bcl-2、E-cadherin、N-cadherin和Vimentin表达水平比较(n=3,)
Tab.4 Comparison of relative expression levels of Mesothelin,Bax,Bcl-2,E-cadherin,N-cadherin and Vimentin between three groups of cells表4 各组细胞中Bax、Bcl-2、E-cadherin、N-cadherin和Vimentin表达水平比较(n=3,)
?
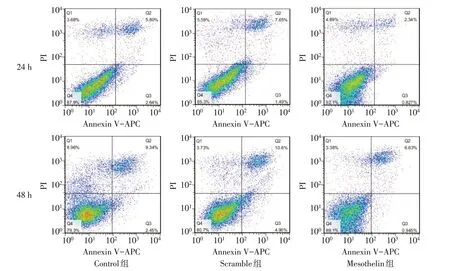
Fig.5 Effect of mesothelin overexpression on the apoptosis of MDA-MB-231 cells图5 过表达Mesothelin对MDA-MB-231细胞凋亡的影响
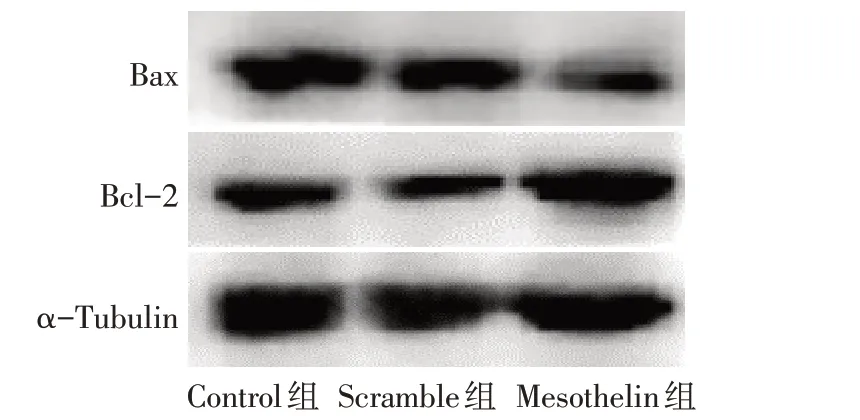
Fig.6 Effect of Mesothelin overexpression on the expression of apoptosis-related protein in MDA-MB-231 cells图6 过表达Mesothelin对MDA-MB-231细胞凋亡相关蛋白表达的影响
2.4 过表达Mesothelin 对MDA-MB-231 细胞迁移、侵袭和EMT 进程的影响 划痕实验结果显示,Control组与Scramble组12 h及24 h划痕愈合率差异无统计学意义;与Scramble组比较,Mesothelin组12 h和24 h 划痕伤口愈合率增加(P<0.05),见图7、表3。Transwell实验结果显示,Control组与Scramble组24 h 侵袭细胞数差异无统计学意义;与Scramble 组相比,Mesothelin组24 h侵袭细胞数增加(P<0.05),见图8、表3。Western blot 结果显示,Control 组与Scramble 组E-cadherin、N-cadherin 和Vimentin 表达差异无统计学意义;与Scramble 组相比,Mesothelin组E-cadherin的表达下调,而N-cadherin和Vimentin的表达上调(P<0.05),见图9、表4。

Fig.7 Effect of Mesothelin overexpression on the migration of MDA-MB-231 cells(×50)图7 过表达Mesothelin对MDA-MB-231细胞迁移能力的影响(×50)
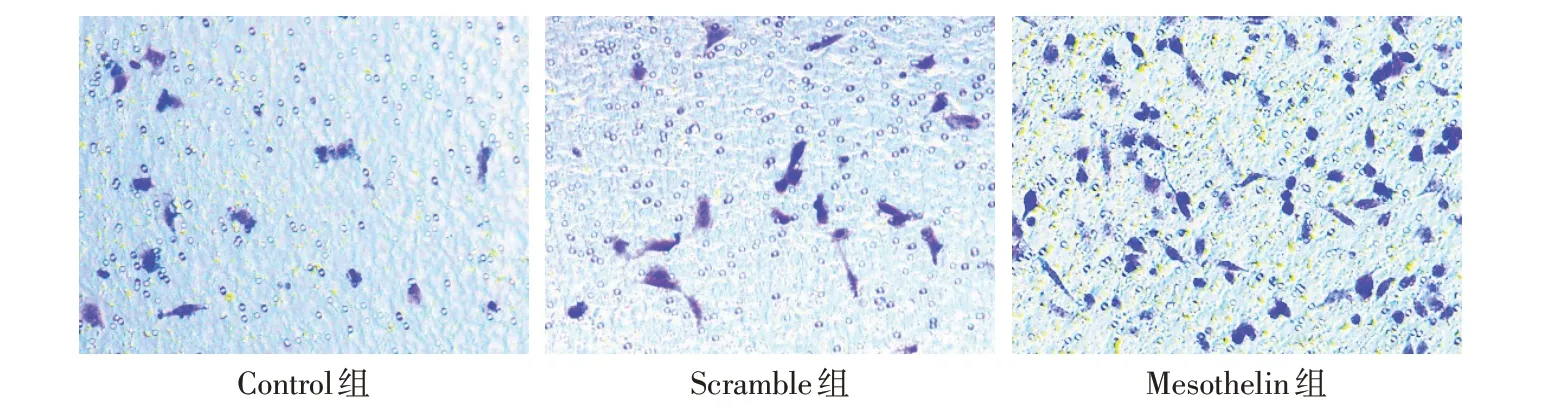
Fig.8 Effect of Mesothelin overexpression on the invasion of MDA-MB-231 cells(Crystal violet staining,×200)图8 过表达Mesothelin对MDA-MB-231细胞侵袭能力的影响(结晶紫染色,×200)
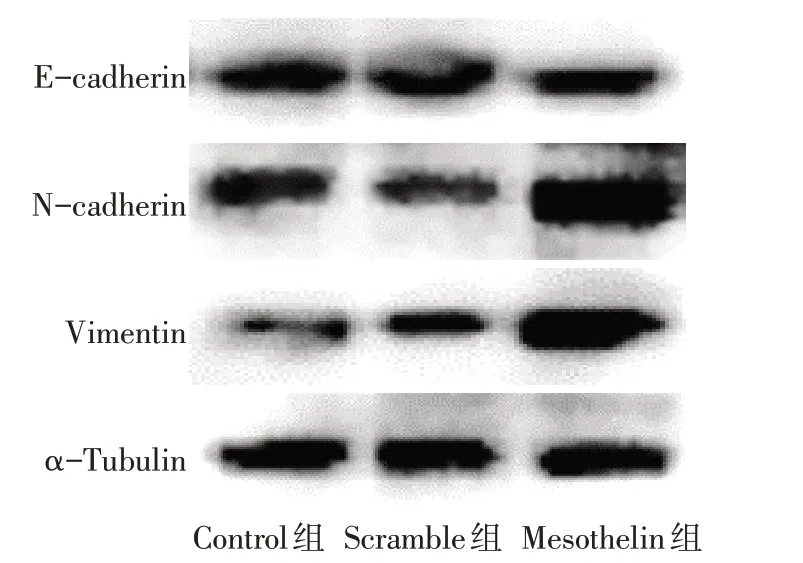
Fig.9 Effect of Mesothelin overexpression on the expression of EMT-related proteins in MDA-MB-231 cells图9 过表达Mesothelin对MDA-MB-231细胞EMT相关蛋白表达的影响
3 讨论
乳腺癌是女性最常见的恶性肿瘤,其发病率呈逐年上升趋势,严重危害女性身体健康[7]。虽然随着乳腺癌治疗手段的进展,大多数乳腺癌患者的预后较好,然而仍有部分乳腺癌患者的治疗效果很差。特别是TNBC因缺乏受体无法进行内分泌治疗和分子靶向治疗,更容易发生复发及远处转移[8]。因此,探究新的诊断标志物和治疗靶点对TNBC患者的治疗具有重要意义。
Mesothelin是近年来新发现的一种肿瘤标志物,其通过糖基磷脂酰肌醇锚定于细胞表面,正常表达在体腔表面的间皮细胞,在恶性间皮瘤、胰腺癌和卵巢癌等肿瘤组织中高表达[9-10],但其在乳腺癌肿瘤细胞生物学特性调控中的作用还不清楚。本研究发现,Mesothelin 在TNBC 组织表达水平显著高于癌旁组织。同样在雌激素受体阳性乳腺癌细胞系MCF-7 细胞和TNBC 细胞系MDA-MB-231 细胞中也检测到Mesothelin 的表达,提示Mesothelin 可能与乳腺癌的发生发展有关。为确定Mesothelin 在TNBC 细胞生物学特性中的调控作用,笔者以MDA-MB-231细胞为模型,利用Mesothelin 慢病毒过表达载体转染MDA-MB-231 细胞,通过qPCR 及Western blot 证实MDA-MB-231 细胞中成功过表达Mesothelin。诱导肿瘤细胞凋亡以及抑制肿瘤细胞转移是肿瘤治疗的重要途径[11-12]。精准寻找与肿瘤细胞增殖与转移密切相关的分子,并对其进行靶向抑制,对肿瘤的治疗策略具有重要的指导意义。本研究证实,过表达Mesothelin 能够促进MDA-MB-231 细胞的增殖,抑制其凋亡。有研究发现细胞高表达间皮素后可促进细胞非锚定生长,抵抗失巢凋亡,并在MDA-MB-231细胞中证实这种抗凋亡机制与凋亡前体蛋白的抑制相关[13]。Bcl-2 和Bax 是细胞凋亡途径的关键因子,Bcl-2 具有抑制细胞凋亡的作用,而Bax 通过形成同源二聚体进而诱导凋亡的发生,Bcl-2/Bax的比值被认为是控制细胞凋亡的开关,其变化是决定细胞凋亡作用强弱程度的关键因素[14]。本研究发现Mesothelin能够抑制Bax的表达,增加Bcl-2表达,发挥抑制乳腺癌细胞凋亡的作用,这与本研究中细胞增殖实验、流式细胞术检测细胞凋亡实验的结果一致,表明Mesothelin可通过抑制乳腺癌细胞凋亡从而促进肿瘤生长。
有研究发现Mesothelin 与糖类抗原125 结合介导细胞黏附、促进肿瘤细胞扩散,Mesothelin 在肿瘤细胞表达与肿瘤的浸润转移密切相关[15]。TNBC 具有易复发、易转移特点,基于此笔者猜测Mesothelin可能与TNBC的浸润转移有关。本研究通过划痕愈合、Transwell侵袭实验证实Mesothelin能够明显增强MDA-MB-231 细胞的迁移和侵袭能力。EMT 途径是多种肿瘤如乳腺癌、胃癌、肺癌发生转移的关键步骤[16-18]。本研究发现过表达Mesothelin 后MDAMB-231 细胞中EMT 途径的关键分子E-cadherin 蛋白表达水平降低,而N-cadherin 和Vimentin 蛋白表达水平则升高。E-cadherin 是上皮细胞的表面标志物,在细胞-细胞间黏附中发挥重要作用,参与组织结构的维持[19]。N-cadherin是间质细胞的表面标志物,能够促进肿瘤细胞转移[20]。Vimentin 是上皮细胞向间质细胞转化的表面标志物[21]。本研究证实了Mesothelin能在体外促进乳腺癌细胞发生EMT。
综上所述,Mesothelin 能够促进TNBC 细胞增殖,抑制其凋亡,增强细胞的迁移及侵袭能力,可能与其调控凋亡相关蛋白及EMT 过程的关键分子表达有关。本研究多角度阐释了Mesothelin 在调控乳腺癌细胞生物学特性中的作用,为TNBC 的诊断与治疗提供了新的思路。

