体质量指数对食管鳞癌患者术后并发症和长期预后的影响
赵雪楠,郭旭峰,丁成智,陈东东,韦丽瑞,李晨,秦贵军,王娇△
我国是食管癌高发国家,2020 年我国新发食管癌约32.4万例,占全球新发病例的53.7%[1]。根治性切除术是早期和局部晚期食管癌的主要治疗方法,但总体预后并不理想,术后5年生存率约为50%[2-3]。因此,寻找新的预后标志物对于改善患者的预后具有重要意义。研究表明,高体质量指数(body mass index,BMI)会增加癌症复发和死亡风险,导致乳腺癌、结直肠癌患者的生存率降低[4]。但BMI 对食管癌患者预后的影响尚存在争议。有研究报道,高BMI 与正常BMI 食管癌患者术后5 年生存率没有显著差异[5-6]。另有研究认为,高BMI食管癌患者可能因为具有良好的营养储备而预后更好[7-8]。然而,这些研究多基于西方人群,食管腺癌是西方国家主要的病理亚型,而食管鳞癌约占我国食管癌患者的90%[1]。目前,我国有关BMI 与食管鳞癌预后关系的大样本量研究较少。本研究旨在探讨BMI对我国食管鳞癌患者术后并发症和长期预后的影响。
1 对象与方法
手术资料、住院时长和术后辅助治疗(放疗或化疗或放化疗)。手术资料包括美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级,手术方式(开胸、微创),淋巴结清扫数目和手术时长。(4)术后并发症情况:有无吻合口瘘、切口感染、肺部感染、呼吸衰竭、乳糜胸、心律失常、声带麻痹。
1.3 随访 采用电话或查阅病历方式对每位患者随访5年,术后2 年内每3 个月随访1 次,第3—5 年每6 个月随访1 次,随访的终点事件为患者死亡,末次随访日期为2022 年12 月30日。失访及随访截止时仍存活的病例为删失数据。
1.4 统计学方法 采用SPSS 26.0软件进行数据分析。计量资料经检验均为非正态分布,以M(P25,P75)表示,多组间比较采用Kruskal-WallisH检验,组间多重比较用Bonferroni 法。计数资料以例或例(%)表示,多组间比较采用χ2检验或Fisher 确切概率法,组间多重比较用Bonferroni 法。绘制Kaplan-Meier生存曲线,Log-rank检验比较3组患者5年累积总生存率的差异。先采用单因素Cox回归分析患者BMI对预后的影响,并得到影响BMI与预后关系的混杂因素。将BMI和全部混杂因素纳入多因素Cox比例风险回归模型分析患者生存的独立影响因素。P<0.05为差异有统计学意义。
1.1 研究对象 选取2012年1月—2017年12月于上海交通大学附属上海市胸科医院行食管癌根治术的食管鳞癌患者1 479例,男1 222例,女257例,年龄(62.4±7.7)岁,BMI(23.0±3.1)kg/m2。患者均经术后病理学检查证实为食管鳞状细胞癌。纳入标准:(1)首次行根治性切除术(R0 切除),吻合口为食管-胃吻合。(2)BMI、病理分期和术后并发症等临床资料完整。排除标准:(1)术前行新辅助化疗和(或)放疗。(2)伴有肝、肺等远处器官转移。(3)伴有其他部位原发恶性肿瘤。参照文献[9],将患者分为低BMI 组(BMI<18.5 kg/m2)100例、正常BMI 组(18.5 kg/m2≤BMI<24 kg/m2)850 例及高BMI组(BMI≥24 kg/m2)529例。本研究已通过上海市胸科医院伦理委员会审核批准(批准号:IS22098),患者或家属均签署知情同意书。
1.2 资料收集 (1)一般资料:BMI、年龄、性别、吸烟史(每日吸烟量≥1 支,连续或累积≥6 个月)、饮酒史(每周饮酒≥1次,连续或累积≥6个月)、糖尿病史、高血压史。(2)病理资料:肿瘤部位(上段、中段、下段),肿瘤长度,分化程度(高分化、中分化、低分化),肿瘤浸润深度(pT分期),淋巴结转移情况(pN 分期),病理分期(pTNM 分期)。pT、pN 和pTNM 分期参照国际抗癌联盟(Union for International Cancer Control,UICC)和美国癌症联合委员会(American Joint Committee on Cancer,AJCC)共同制定的第8 版食管癌TNM 分期标准。(3)
2 结果
2.1 3 组患者一般资料比较 与正常BMI 组比较,高BMI 组吸烟患者比例降低、糖尿病患者比例升高(P<0.05),3组年龄、性别、饮酒史、高血压史差异均无统计学意义,见表1。
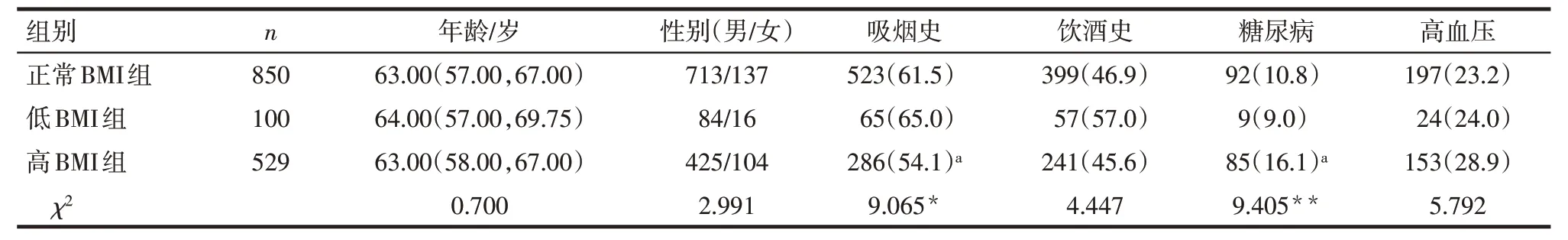
Tab.1 Comparison of general data of esophageal cancer patients between the three groups表1 不同体质量指数组患者一般资料比较
2.2 3 组患者病理资料比较 与正常BMI 组比较,低BMI 组肿瘤长度增加,pN 分期的N1—3期和pTNM分期的Ⅲ—Ⅳ期比例升高(P<0.05),高BMI组患者pT 分期的T3—4期比例降低(P<0.05)。与低BMI 组比较,高BMI组患者肿瘤长度减小,T3—4期、N1—3期和Ⅲ—Ⅳ期比例降低(P<0.05)。3 组肿瘤部位、分化程度差异均无统计学意义,见表2。
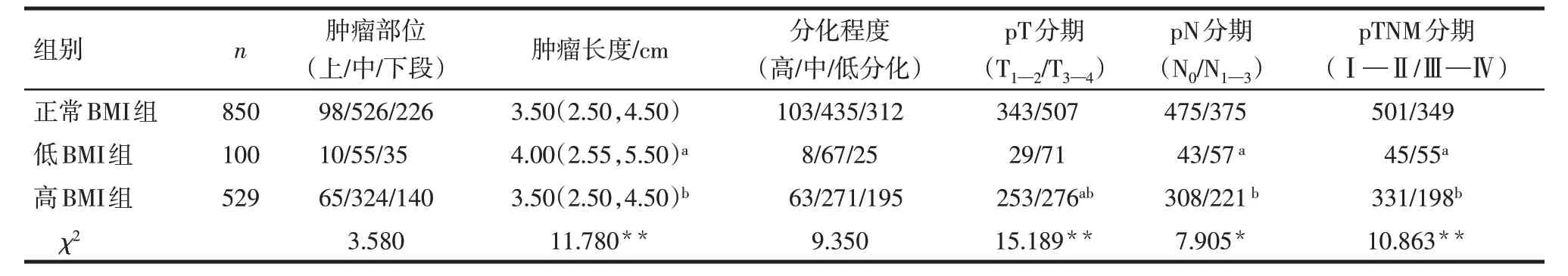
Tab.2 Comparison of pathological data of esophageal cancer patients between the three groups表2 不同体质量指数组患者病理资料比较
2.3 3 组患者手术资料、住院时长和术后辅助治疗比较 与正常BMI 组比较,高BMI 组患者淋巴结清扫数目减少,手术时长增加(P<0.05)。与低BMI组比较,高BMI 组患者手术时长增加(P<0.05)。3 组ASA分级、手术方式、住院时长和术后辅助治疗差异均无统计学意义,见表3。。
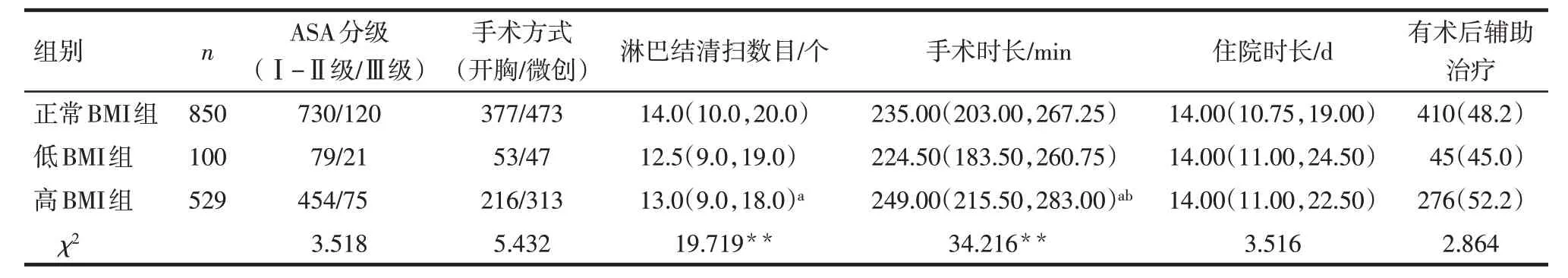
Tab.3 Comparison of surgical data,length of hospitalization and postoperative adjuvant therapy of esophageal cancer patients between the three groups表3 不同体质量指数组患者手术资料、住院时长和术后辅助治疗比较
2.4 3 组患者术后并发症比较 与正常BMI 组比较,低BMI 组肺部感染和心律失常发生率增加,高BMI 组切口感染发生率增加(P<0.05);与低BMI 组比较,高BMI 组心律失常发生率降低(P<0.05)。3组吻合口瘘、呼吸衰竭、乳糜胸和声带麻痹发生率差异均无统计学意义,见表4。
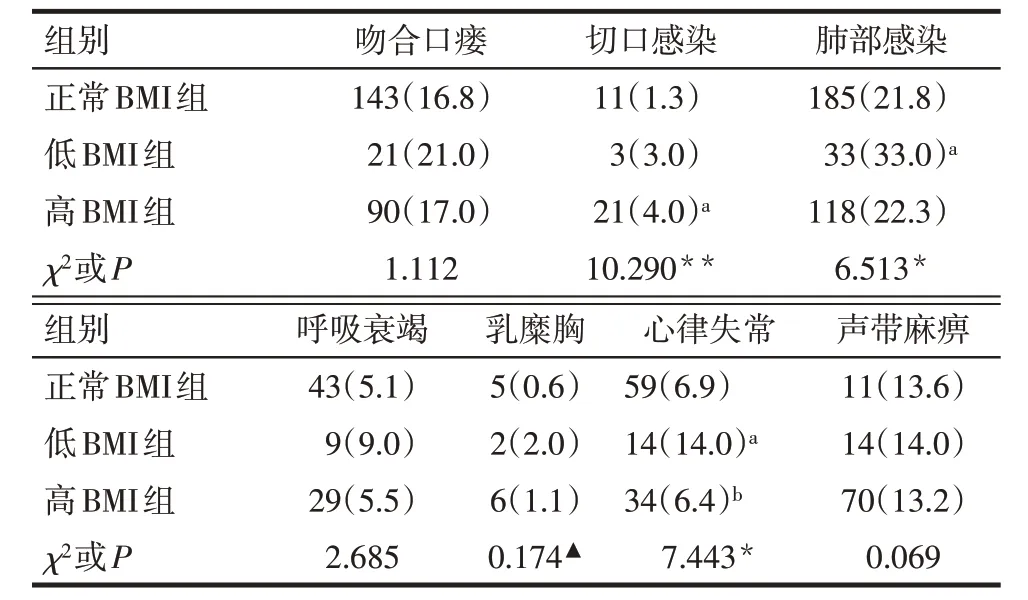
Tab.4 Comparison of postoperative complications of esophageal cancer patients between the three groups表4 不同体质量指数组患者术后并发症比较
2.5 3 组患者累积生存率比较 随访期内共558 例(37.7%)患者死亡。Kaplan-Meier生存分析显示,正常BMI 组、低BMI 组及高BMI 组的1 年累积总生存率分别为90.1%、79.6%、90.5%,3年累积总生存率分别为68.0%、47.9%、69.4%,5年累积总生存率分别为53.5%、28.2%、54.5%。其中低BMI 组5 年累积总生存率低于正常BMI组(Log-rankχ2=16.857,P<0.01)和高BMI 组(Log-rankχ2=18.802,P<0.01),而高BMI 组和正常BMI 组患者5 年累积总生存率差异无统计学意义(Log-rankχ2=0.324,P=0.569),见图1A。pTNM 分期的亚组分析显示,3 组Ⅰ—Ⅱ期患者的5年累积总生存率差异无统计学意义(Log-rankχ2=3.327,P=0.189);在Ⅲ—Ⅳ期患者中,低BMI 组患者的5年累积总生存率仍低于正常BMI组和高BMI组(Log-rankχ2=7.978,P=0.019),见图1B、C。
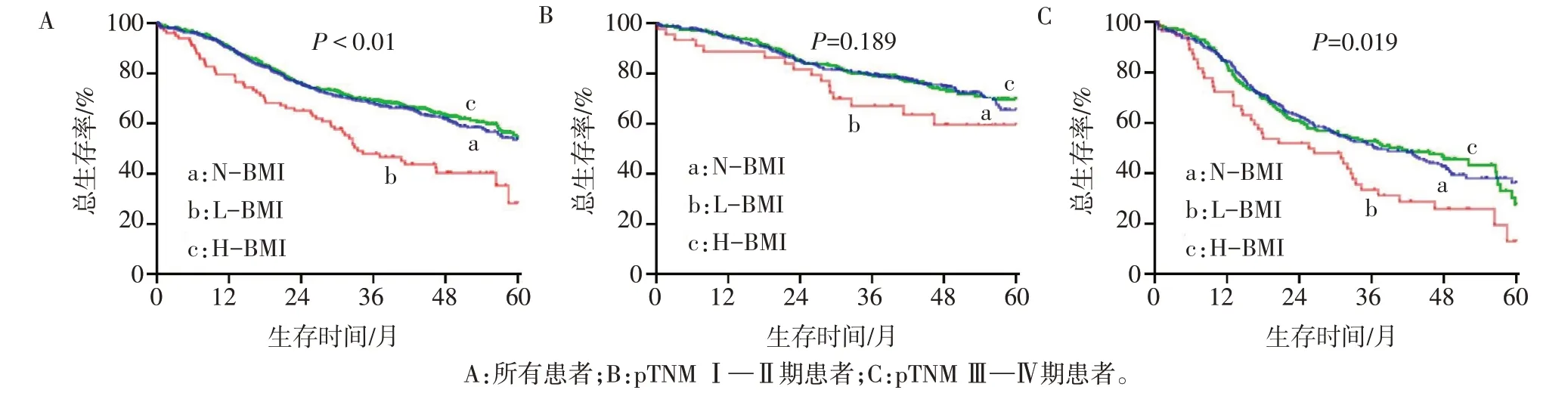
Fig.1 Comparison of 5-year cumulative overall survival of patients between the three groups图1 不同体质量指数组患者5年累积总生存率比较
2.6 BMI 对患者生存的Cox 回归分析 见表5。在未调整其他危险因素时,与正常BMI组比较,高BMI组患者的预后没有显著变化(P>0.05),低BMI组患者的死亡风险增加(P<0.01);在调整了性别、糖尿病、肿瘤长度、分化程度、pTNM 分期、手术方式、淋巴结清扫数目、术后辅助治疗等混杂因素后,低BMI组患者的死亡风险是正常BMI组患者的1.449倍。
3 讨论
肥胖患者常伴有胰岛素抵抗、大量分泌促炎细胞因子、异常分泌脂肪因子(脂联素减少、瘦素增多)等内分泌代谢变化,进而通过促进细胞增殖和血管生成、抑制细胞凋亡等多种机制影响恶性肿瘤的发生和进展[10]。BMI 简便易测,是国际上衡量人体胖瘦程度使用最广泛的指标。既往研究显示,随着BMI的增加,食管腺癌的发生风险显著增加,而食管鳞癌的发生风险反而降低[11]。因此,BMI 对食管鳞癌患者预后的影响也可能不同于腺癌。本研究排除非食管鳞癌病理亚型的干扰,探讨BMI 对食管鳞癌患者预后的影响,结果发现,与正常BMI 组比较,BMI≥24 kg/m2组患者的预后没有显著变化,BMI<18.5 kg/m2组患者的总生存率显著降低。
目前探讨高BMI与食管鳞癌患者预后关系的研究较少,且结论不一致。Hasegawa 等[6]认为BMI≥25.0 kg/m2对食管鳞癌患者的总生存率和无复发生存率没有影响。Wang 等[8]发现BMI≥23 kg/m2可显著提高食管鳞癌患者的总生存率,但该研究未纠正糖尿病、手术方式、淋巴结清扫数目和术后辅助治疗等可能影响患者生存的混杂因素,这可能是“肥胖悖论”。BMI只能粗略测量人体胖瘦程度,无法识别体脂和肌肉成分的具体含量。既往研究显示,肌肉量减少、脂肪量增加会导致食管癌患者的生存率降低[12-13]。相反,肌肉含量高、脂肪含量低的食管癌患者的生存率可能增加。因此,如果高BMI 组包括大量肌肉含量高的患者,可能会导致较高的生存率。Watanabe 等[14]认为,BMI≥25.0 kg/m2是食管鳞癌患者无病生存率降低的独立预测因素,但该研究样本量小,同时其队列中包括大量接受新辅助治疗的患者。有研究报道新辅助治疗会使患者的肌肉减少和体质量降低[15]。
随着肥胖程度的增加,食管鳞癌患者的生存率可能降低。Lee等[16]发现,与23 kg/m2≤BMI<25 kg/m2组患者相比,25 kg/m2≤BMI<35 kg/m2组食管鳞癌死亡风险无明显变化,而BMI≥35 kg/m2会显著增加食管鳞癌死亡风险。本研究中肥胖患者(BMI≥28 kg/m2)仅占6.3%(93/1479),且BMI 最高值为34.6 kg/m2,因此,肥胖患者数量少和肥胖程度不高可能是高BMI组生存率没有下降的主要原因。恶性肿瘤是慢性消耗性疾病,笔者认为适当的脂肪储备可能提供足够的能量并维持免疫系统的正常功能,从而使患者生存受益,而过度肥胖患者的糖尿病、心血管病等多种疾病的患病率可能增加,从而不利于患者的生存。
本研究显示,BMI<18.5 kg/m2是食管鳞癌患者术后生存的独立危险因素,与既往研究结论相同[12]。分析可能原因为低BMI组可能包括大量体质量减轻的患者。低BMI 组Ⅲ—Ⅳ期患者比例更高,晚期患者通常食管狭窄程度加重,患者吞咽困难,容易导致体质量减轻。消瘦和体质量减轻往往预示着癌症恶病质,会导致患者生存率降低[17]。本研究基于pTNM 分期进行的亚组分析显示,仅在Ⅲ—Ⅳ期食管鳞癌患者中,低BMI 组的生存率低于正常和高BMI 组。其次,BMI<18.5 kg/m2是营养不良的诊断标准之一[18]。营养不良会损害患者的免疫反应,导致肿瘤更容易复发和转移,从而降低患者的生存率[19]。此外,经济状况也会影响不同BMI 组患者的预后。研究认为,相比于正常和高BMI患者,低BMI患者的经济状况通常更差,肿瘤复发时,他们接受辅助治疗的机会变少[20],这也可能不利于低BMI 患者的预后。
本研究还发现,高BMI 组患者切口感染的发生率显著增加,与既往研究结论一致[5]。分析可能原因为:首先,高BMI 患者皮下脂肪层较厚,局部组织氧含量较低,手术部位在电刀和缝线的刺激下容易发生脂肪液化,大量渗液造成切口愈合不良,为细菌生长创造良好的环境[21]。其次,高BMI 患者皮肤褶皱增多,出汗增多,切口不易保持清洁状态[22]。此外,肥胖患者先天性和适应性免疫反应均减弱,对病原菌的抵抗能力下降[22]。本研究显示,低BMI 患者肺部感染比例升高,这可能与低BMI 患者更容易合并低白蛋白血症、贫血等营养不良状态,患者免疫功能受损有关。另外,低BMI 组患者心律失常的比例显著增加,这可能与低BMI患者营养储备差,更容易合并低钾血症等电解质紊乱有关。
综上所述,高BMI 增加食管鳞癌患者术后切口感染的发生率;低BMI 增加患者肺部感染和心律失常的发生率,并且是患者预后不良的独立预测因素。鉴于严重肥胖食管鳞癌患者的生存率可能降低,未来的研究应该纳入BMI≥35 kg/m2的患者,按肥胖程度独立分组,重点研究不同肥胖程度对食管鳞癌患者预后的影响。

