自制红细胞裂解液对流式细胞术测定外周血T淋巴细胞亚群的影响研究
姜 华,黄 瑛,王 超,秦 超,孙 立,韩素芹,2,王三龙,文海若
(1.中国食品药品检定研究院国家药物安全评价监测中心,药物非临床安全评价研究北京市重点实验室,北京 100176;2.中山大学药学院,广州 510006)
流式细胞术(flow cytometry,FCM)是使用流式细胞仪开展的试验技术,可在细胞、分子水平上通过识别荧光标记的单克隆抗体,对单个细胞或其他生物因子进行定量分析和分选[1]。使用流式细胞术对动物淋巴细胞免疫表型进行检测,已成为药物非临床安全性评价中常规的药物免疫毒性评价手段[2]。其中,CD4+T细胞和CD8+T细胞的表达量是最常见的检测对象。体内CD4+T淋巴细胞作为辅助/诱导细胞亚群,通过分泌的淋巴因子增强免疫应答;而CD8+T淋巴细胞为抑制/细胞毒细胞亚群,具有特异性杀伤病毒和肿瘤等作用[3]。检测时通常以一定量细胞(多通常为5 000个至20 000个)的平均荧光强度(mean fluorescence intensity,MFI)、细胞计数值、CD4+/CD8+比值等指标是药物临床前免疫毒性主要评价的常用考察指标[4-5]。淋巴细胞分类计数样本制备的操作流程,如红细胞的去除效果、红细胞的裂解时间及红细胞裂解液的制备方法对检测数值存在重要影响。故本研究以药物非临床安全性评价常用动物食蟹猴和SD大鼠的外周血样本作为研究对象,比较其经市售和自制的红细胞裂解液分别处理不同时间后,对外周血淋巴细胞表型检测结果的影响,为相关流式检测提供参考。
1 材料与方法
1.1 研究对象 食蟹猴,普通级,约3~4岁,共15 只,均为雌性,由昆明亚灵生物科技有限公司提供,动物生产许可证号为 SCXK(滇)2020-007。饲养于国家药物安全评价监测中心的普通级动物房内,单笼饲养,自由饮水,每天定量给饲料和水果(各150 g),自由摄取。饲养环境中温度和相对湿度分别控制在 16 ℃~ 26℃和 40% ~ 70%,每小时换气次数不少于 8 次,每天照明 12 h,饲养 3 周,适应环境后采血测定。
SD大鼠,SPF级,9~10周龄,共15只,均为雌性,繁育单位为北京维通利华实验动物技术有限公司,动物生产许可证号为SCXK(京)2021-0011。饲养于国家药物安全评价监测中心屏障系统内的大鼠笼具中(460mm×315mm×210mm),饲养密度为2~3只/笼。自由饮水与摄取饲料。饲养环境中温度和相对湿度分别控制在20℃~26℃(日温差≤3℃)和40%~70 %,每小时最低换气次数为15次/h,照明时间为12h/天。动物检疫适应5天后进行测定。
试验方案经国家药物安全评价监测中心实验动物福利伦理委员会审阅并批准(编号:IACUC-2022-054和IACUC- 2022-061)。
1.2 仪器与试剂 FACSCalibur流式细胞仪、分析软件 Cell QuestTM,FACSAriaIII流式细胞仪、分析软件 Diva(美国BD公司);H-60R 高速离心机(日本Kokusan公司);流式仪校准微球:BD CalibriteTM3-color(批号1190654),APC bead(批号98738),CS&T荧光校准微球(批号1088460)均购自美国BD公司;流式检测抗体:异硫氰酸荧光素标记的抗 CD8 抗体FITC-CD8(批号0104976),PECD4(批号9172628),PerCP-CD3(批号0205481),异硫氰酸荧光素标记的抗 CD4抗体FITC-CD4(批号8274677),PE-CD8a(批号7271748),APCCD3(批号1308882),市售红细胞裂解液用前十倍稀释(批号1029757)均购自美国BD公司。配制用的红细胞裂解液主要成分:氯化氨(批号20161208)、碳酸氢钾(批号20150924)、乙二胺四乙酸二钠(批号20140328)和多聚甲醛(批号20150120)购自国药集团;按照裂红液1L体积配制,氯化铵8.29 g,碳酸氢钾1.0 g,乙二胺四乙酸二钠0.372 g。磷酸盐缓冲液(美国Hyclone公司,批号AH29787896);肝素钠抗凝管(江苏康健医疗用品有限公司,批号22020301),EDTA-K2抗凝管(比克曼生物公司,批号20220408)。
1.3 方法
1.3.1 食蟹猴血样制备与分析:采集食蟹猴前臂静脉血,每只约0.3~0.5 ml,共15只。将样品添加至肝素钠抗凝管中混匀;取荧光检测抗体PerCP-CD3/FITC-CD8/PE-CD4各5μl,与肝素抗凝血 50 μl混合。样本在室温下避光孵育 20 ~ 30 min 后,加入配制的红细胞裂解液约1ml后混匀,裂解以肉眼可见澄清为准,同样操作分别制备3套样本,采用不同裂解时间,自制裂解液裂解时间约为5 min或15 min,市售裂解液裂解时间约为15 min。以200 ×g 离心 5 min,弃上清,加入适量PBS 清洗一次,再次加入含1g/100ml多聚甲醛的PBS重悬细胞上机测定。所有血样均在采集后 4h 内完成制备与测定分析。上机检测前通过CS&T荧光校准微球质控。在散点图上圈选淋巴细胞群去粘连,并使用空白对照管和单荧光标记管调节电压和荧光补偿,每个样本收集5 000 个淋巴细胞,分析猴 T 淋巴细胞亚群的MFI和淋巴细胞百分比。
1.3.2 SD大鼠血样采集与制备:采集SD大鼠腹主静脉血约0.5 ml,将样品添加至EDTA-K2的抗凝管中混匀,共30只,分别制备样本。①取2μl APC-CD3,1μl FITC-CD4和2μl PE-CD8a,分别与EDTA-K2抗凝大鼠血50 μl混合。样本在室温下避光孵育 20~30 min 后,加入配制的红细胞裂解液约1ml。同样操作共制备4套,自制裂解液用15只大鼠血样,市售裂解液用15只大鼠血样,分别制备各自比较。采用自制裂解液裂解时间约为2 min或5 min,市售裂解液裂解时间约为5 min或15min。加入适量PBS 清洗一次,加入适量含1g/dl多聚甲醛的PBS重悬细胞,分别上机测定。②取其中15只大鼠血样分别制备2套样本,与APC-CD3/PE-CD4各2 μl,与 EDTA-K2抗凝大鼠血50 μl混合。孵育结束后加入配制的红细胞裂解液。采用自制裂解液裂解时间约为2 min或5 min,以200× g离心5 min,弃上清,加入适量PBS 清洗一次,再次加入含1g/100ml多聚甲醛的PBS重悬细胞上机测定。所有血样均在采集后 4h 内完成制备与测定分析。上机检测前通过四色荧光校准微球质控。在散点图上圈选淋巴细胞群去粘连,并使用空白对照管和单荧光标记管调节电压和荧光补偿,每样收集5 000 个淋巴细胞,分析大鼠 T 淋巴细胞亚群的MFI和淋巴细胞百分比。
1.4 统计学分析 采用IBM SPSS Statistics 26.0分析数据,计数资料以例(n)表示,行F检验;符合正态分布的计量数据以均数±标准差(±s)表示。如果为等方差,两组间行独立样本t检验。如果为异方差,在n1=n2时,进行 Aspin-Welch 检验。P< 0.05为差异有统计学意义。
2 结果
2.1 自制红细胞裂解液及市售裂解液不同裂解时间对食蟹猴淋巴细胞亚群检测结果的影响 不同红细胞裂解液对食蟹猴T淋巴细胞MFI和百分比的影响见表1和表2。检测结果提示,FITC标记的CD8+细胞经自制红细胞裂解液裂解15 min时的MFI与裂解5 min时相比,下降约28.5%,差异具有统计学意义(t=8.779,P<0.001);其百分比升高16.9%,差异具有统计学意义(t=2.139,P<0.05)。PE标记的CD4+T细胞经自制红细胞裂解液中裂解15 min时的MFI与裂解5 min时相比,下降约5.6%,其百分比升高13.8%,差异具有统计学意义(t=2.162,P<0.05)。自制红细胞裂解液在不同裂解时间条件下对CD3+荧光抗体MFI(t=0.945,P>0.05)和淋巴细胞百分比(t=0.348,P>0.05),以及CD4/CD8比值均未见明显影响(t=0.321,P>0.05)。
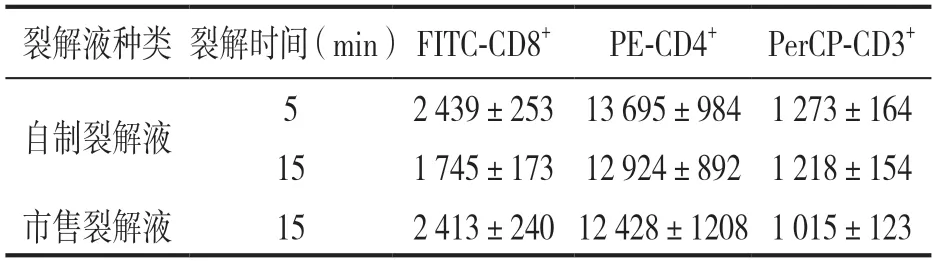
表1 裂解时间对食蟹猴T淋巴细胞MFI的影响(n=15)

表2 不同裂解时间对食蟹猴外周血T淋巴细胞百分比(%)结果(n=15)
参考市售样品使用说明,食蟹猴样本需裂解15 min,裂解时间较长。与自制裂解液裂解5min后检测值比较,食蟹猴样本经市售裂解液裂解15 min后,FITC标记的CD8+细胞MFI和百分比均未见差异。但PE标记的CD4+细胞和PerCP标记的CD3+细胞的MFI则分别降低至9.25%和20.3%,差异具有统计学意义(t=3.150,4.862,均P<0.01)。此外,PE标记的CD4+细胞(t=0.478,P>0.05)和PerCP标记的CD3+细胞的百分比(t=0.945,P>0.05),以及CD4/CD8比值(t=1.828,P>0.05)均未见明显影响。
2.2 自制红细胞裂解液及市售裂解液不同裂解时间对SD大鼠淋巴细胞亚群检测结果的影响 不同红细胞裂解液对SD大鼠T淋巴细胞MFI的影响见表3。在SD大鼠外周血T淋巴细胞中,FITC标记的CD4+细胞在自制红细胞裂解液中裂解5 min比2 min的MFI下降约75.2%,差异具有统计学意义(t=34.890,P<0.001)。裂解5 min的样本中PE标记的CD8a+杀伤性T细胞的MFI虽降低约7.8%,但与裂解2 min的样本比较差异无统计学意义(t=1.574,P>0.05)。市售的裂解液裂解5 min与15 min后比较,样本经市售裂解液裂解15 min后,FITC标记的CD4+细胞MFI升高10.7%,而PE标记的CD8a+细胞MFI降低7.5%,差异具有统计学意义(t=2.409,P<0.05)。自制和市售的红细胞裂解液不同裂解时间对CD3+CD4+,CD3+CD8+和CD4+/CD8+的百分比无影响,见表4。
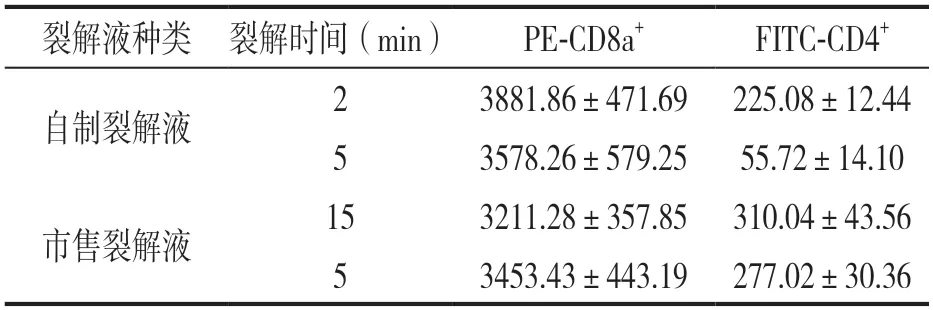
表3 裂解时间对SD大鼠T淋巴细胞MFI的影响(n=15)
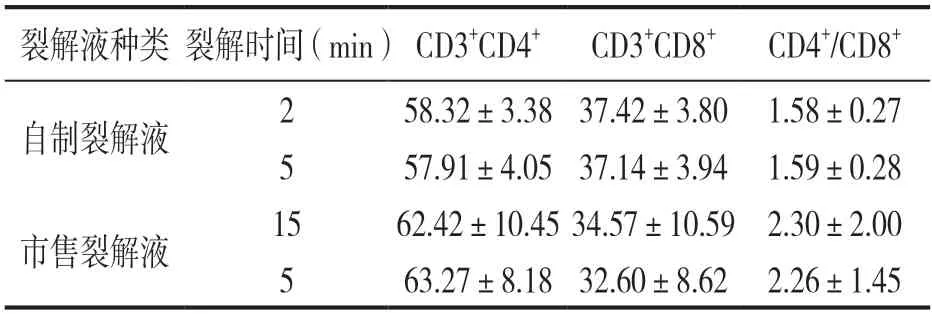
表4 不同裂解时间对SD大鼠外周血T淋巴细胞百分比(%)的影响(n=15)
3 讨论
使用流式细胞术对淋巴细胞亚群进行分类计数是非临床安全性评价中常规的免疫毒性评价手段之一,用以评价药物的免疫毒性风险。常见的淋巴细胞亚群分类指标包括CD3+CD4+,CD3+CD8+等。细化试验条件和积累经验有助于控制和减少检测中的干扰因素,从而保证检测结果的可靠性和准确性。多种因素可对流式法细胞表型测定结果产生影响,包括样本本身的因素和样本制备因素等。其中样本自身的因素包括:①来源:动物的种属、性别、年龄和免疫状态[6];②制备条件:放置时间、是否存在凝血或溶血[7]、抗凝剂的选择;③仪器的性能及日常维护与操作;④荧光抗体的选择等[8-11]。本研究中大鼠样本检测结果提示,自制红细胞裂解液对FITC标记的CD4+淋巴细胞的MFI有明显降低的作用,更换强荧光抗体标记后,在一定红细胞裂解时间内(大鼠常规裂解时间的两倍)可消除其对MFI的影响。在食蟹猴样本检测时发现裂解时间超过时间的三倍以上时,FITC-CD8+的MFI值明显降低,而PE-CD4+的MFI值和淋巴细胞百分比也有所影响。上述结果提示,随裂解时间延长,裂解液对荧光抗体的影响有所增加。
出现上述现象的原因首先可能与荧光染料(FITC和PE)自身特性,如荧光强度、稳定性及荧光淬灭衰减速率等有关[12],首先荧光染料PE的荧光强度明显高于荧光染料FITC;其次FITC染料比PE染料易受干扰,FITC和PE均由488 nm的蓝色激光器激发,FITC最大发射光波长为 520 nm~530 nm,接受蓝色激光器激发后呈现绿色荧光;而PE的发射光波长为 595 nm,接受蓝色激光器激发后呈现红色荧光,与绿色荧光比相比,激发光对于红色荧光的发射光和本底荧光的影响较小。同时试验中发现,FITC与PE染料相比更易于淬灭,也许是样本中淋巴细胞的细胞膜随着裂解时间延长发生一定裂解作用相关[13]。第三,可能与FITC相结合的淋巴细胞膜的荧光信号易破坏程度高于PE荧光染料,导致FITC荧光抗体与淋巴细胞膜表面的CD分子结合力下降,影响了MFI数值。这一现象也可能说明FITC荧光抗体与细胞结合力较差有关。食蟹猴实验中辅助性T淋巴细胞和杀伤性T淋巴细胞的百分比均增高,推测原因可能是细胞膜破裂后,结合在细胞膜上的微弱信号被流式细胞仪识别,导致其淋巴细胞的占比有所增加。因此,流式试验中对于全血样本的制备时应严格控制红细胞的裂解时间,以避免影响目的细胞的平均荧光强度的表达。
实验室常规使用的红细胞裂解液的主要成分包括NH4Cl,KHCO3和EDTA等。其中NH4Cl的主要作用是改变细胞膜的渗透压,并在EDTA的共同作用下导致红细胞的破裂。但随红细胞裂解液作用时间延长,对粒细胞、单核细胞和淋巴细胞的抗原表达量均存在影响,其中对粒细胞的影响最大,其次是单核细胞和淋巴细胞。本研究发现裂解时间延长对淋巴细胞的MFI产生了一定的影响,提示制备髓系细胞样本时,需严格控制红细胞裂解的时间[14]。现有市售红细胞裂解液可在稀释后直接用于红细胞裂解,但费用高且裂解时间较久(说明书建议时间通常为15 min)。本研究比较了自制裂解液和市售裂解液对各检测指标的影响,结果提示食蟹猴样本使用自制裂解液的裂解约5 min的检测结果与市售裂解液裂解15 min相比更佳;大鼠样本使用自制裂解液的裂解约2 min的检测结果与市售裂解液裂解5 min相比基本相当。因此,使用自制的红细胞裂解液可在节省成本的同时缩短检测时间。当前用于流式检测的新型荧光抗体不断涌现,检测表达量较低的细胞时应根据强弱搭配的原则,选择灵敏度高且特异度强的抗体[15-16]。
本研究仅以市售红细胞裂解液作为自制裂解液的参照比对,未对不同裂解时间作进一步比较分析。今后应继续总结经验,以确定更为合适的裂解时间。
综上所述,使用自制的红细胞裂解液时,延长裂解时间可影响FITC荧光标记的检测结果以及淋巴细胞MFI和细胞百分占比,从而影响检测结果的准确性。将FITC荧光抗体更换为PE荧光抗体后,在相同的裂解时间内可消除对大鼠测定淋巴细胞MFI的影响;但裂解时间延长至三倍时长后对其FITC和PE荧光抗体的MFI有一定影响。本研究比较了不同裂解时间对流式测定外周血T淋巴细胞亚群的影响,为非临床药物安全性评价的流式检测方法提供数据支持。

