帕金森病患者血清PRDX1、AOPP水平与病情、认知功能的关系*
孙 嫄,腾 飞,张 宁△
徐州市中心医院:1.神经内科;2.内分泌科,江苏徐州 221000
帕金森病(PD)是一种进展快速的神经系统退行性疾病,病因未明,多数学者认为其与遗传、神经系统老化等因素有关[1-2]。早期PD患者主要表现为静止性震颤、肌强直等运动症状,随着病情进展,逐渐出现认知功能异常等非运动症状,严重影响患者的生活品质[3-4]。因此,早期评估PD患者病情的严重性及认知功能,有利于诊治工作有序推进。过氧化还原蛋白1(PRDX1)属于抗氧化蛋白超家族,可参与机体氧化应激、炎症反应等过程[5],研究发现,PRDX1与急性缺血性脑卒中的病情及预后关系密切[6]。晚期氧化蛋白产物(AOPP)是氧化应激反应的终末产物,可促使大量的活性氧产物生成,加重机体的炎症反应[7]。既往研究发现,血清AOPP水平在癫痫患者中显著提高,且与认知功能受损有关[8]。但是现阶段鲜有研究报道PRDX1、AOPP与PD的关系。基于此,本研究主要探讨PD患者血清PRDX1、AOPP水平与其病情、认知功能的关系。
1 资料与方法
1.1一般资料 选取2021年12月至2023年1月本院收治的103例PD患者作为研究对象,其中男55例,女48例;年龄40~80岁,平均(65.13±8.65)岁。纳入标准:(1)符合PD的诊断标准[9];(2)入院前未接受相关治疗;(3)患者本人及监护人知情同意。排除标准:(1)合并癫痫、亨廷顿舞蹈症等其他神经系统疾病;(2)近期有颅脑外伤或手术史;(3)肺、心等器官功能障碍;(4)合并恶性肿瘤、精神不正常;(5)临床资料不完整及拒绝参与本次研究。本院医学伦理委员已对本研究进行审核批准。
1.2方法
1.2.1资料收集 根据住院病历收集PD患者的临床资料,包括性别、年龄、受教育年限、吸烟、饮酒、糖尿病、高血压、PD家族史等。
1.2.2血清PRDX1、AOPP水平检测 入院1 d内经肘静脉采集PD患者的空腹静脉血标本,加速离心后取上层血清,冰箱内保存。采用酶联免疫吸附试验检测血清PRDX1、AOPP水平,试剂盒上海抚生实业有限公司,操作流程按照说明书进行。
1.2.3病情 根据Hoehn-Yahr(H-Y)分期[10]评估PD患者的病情,可分为0期(无症状)、1期(单侧有症状)、1.5期(单侧有症状,并累及躯干中轴及对侧),2期(双侧有症状)、2.5期(双侧有症状,拉动试验受限)、3期(双侧有症状,并影响平衡)、4期(残疾,有独立行走能力)、5期(无他人协助只能卧床或依靠轮椅)。将H-Y分期为0~2.5期者纳入早期组(62例),H-Y分期为3~5期纳入中晚期组(41例)。
1.2.4认知功能 根据蒙特利尔认知评估量表(MoCA)[11]评估PD患者是否存在认知功能异常,量表由语言、命名、注意、抽象、执行功能、视空间、延迟记忆、定向力8个维度组成,总计30分,MoCA评分<26分即可判断为认知功能异常。根据MoCA评分情况分为认知正常组(75例)和认知异常组(28例)。
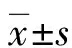
2 结 果
2.1不同病情患者血清PRDX1、AOPP水平比较 中晚期组血清PRDX1、AOPP水平高于早期组(P<0.05)。见表1。

表1 不同病情患者血清PRDX1、AOPP水平比较
2.2认知正常组与认知异常组血清PRDX1、AOPP水平及MoCA评分比较 认知异常组血清PRDX1、AOPP水平高于认知正常组(P<0.05),MoCA评分低于认知正常组(P<0.05)。见表2。

表2 认知正常组与认知异常组血清PRDX1、AOPP水平及MoCA评分比较
2.3PD患者血清PRDX1、AOPP水平与MoCA评分的相关性 PD患者血清PRDX1、AOPP水平与MoCA评分均呈负相关(r=-0.603、-0.537,P<0.05)。
2.4PD患者认知功能异常的单因素及多因素Logistic回归分析 本研究将PD患者是否发生认知功能异常作为因变量(否=0,是=1),赋值方案见表3,将单因素分析中差异有统计学意义的指标作为自变量进行多因素Logistic回归分析,结果显示,高龄、H-Y分期高、PRDX1≥9.05 ng/mL、AOPP≥113.23 μmol/L是PD患者认知功能异常的影响因素(P<0.05)。见表4。

表3 各研究变量及赋值情况

表4 PD患者认知功能异常的单因素及多因素Logistic回归分析
3 讨 论
PD是一种发病率仅次于阿尔茨海默症的神经系统退行性疾病,高发于老年人群,且随着年龄增长患病例数显著增加,给社会造成了严重的经济负担[12-13]。认知功能异常是PD患者病情进展过程中常见、高发的非运动症状,可进展为痴呆,严重影响患者的生活自理能力[14]。PD的病程长,且呈进行性发展,当下尚无有效的根治手段,主要以延缓病情进展为主[15-16]。因此,寻求有效的血清标志物用于评估PD病情,可指导治疗方案的制订,有利于延缓病情发展,改善疾病转归。
PRDX1是一种重要的抗氧化因子,在脑、肺脏等多种组织器官内表达,可通过清除活性氧产物,缓解氧化应激反应对机体造成的伤害,进而维持氧化-抗氧化系统稳态[17-19]。同时PRDX1可介导Toll样受体4(TLR4)相关炎症信号通路,促进炎症介质释放入血,进而参与多种炎症性疾病的发生及发展过程[20-21]。LIU等[22]构建了脑缺血再灌注(IR)小鼠模型发现,PRDX1可激活TLR4调节的炎症和凋亡来增强脑IR损伤,而敲除PRDX1可减少脑梗死面积,减轻细胞死亡和炎症反应。杨国强等[23]研究发现,PRDX1可通过炎症、免疫反应、轴突发育等参与脑出血发病,且患者血清PRDX1水平明显升高。本研究结果显示,中晚期组患者血清PRDX1水平高于早期组(P<0.05)。提示血清PRDX1水平升高与PD患者病情加重有关。可能原因是,PD患者病情加重,大量的活性氧产物聚集于脑部组织,导致神经元发生变性、坏死,而PRDX1对活性氧产物具有清除作用[24]。因此认为随着PD患者的病情加重,血清PRDX1水平逐渐提高。本研究结果显示,认知异常组血清PRDX1水平高于认知正常组;血清PRDX1与MoCA评分呈负相关(P<0.05)。提示血清PRDX1与PD患者发生认知功能异常相关。可能是因为PRDX1高表达可促进大量炎症介质释放入血,过度激活小胶质细胞,诱发神经炎症,进而损害神经细胞功能,导致认知功能异常[25-26]。因此认为PRDX1可参与PD患者的认知功能异常过程。多因素Logistic回归分析结果显示,PRDX1高水平是PD患者认知功能异常的影响因素之一(P<0.05)。提示PRDX1表达上调可增加PD患者认知功能异常的风险,可为早期评估认知功能提供数据参考。
AOPP是氧化应激过程中形成的含双酪氨酸的蛋白交联产物,可作为反映氧化应激程度的标志物,具有促炎、促氧化应激等作用[27-28]。相关研究发现,AOPP可激活丝裂素活化蛋白激酶(MAPKs)、核因子κB(NF-κB)信号通路,进而调节小胶质细胞介导的神经炎症反应[29-30]。FERNNDEZ等[31]报道称,PD患者的氧化应激水平较高,而血清AOPP水平与氧化应激的严重程度有关。申兴革等[32]研究发现,血清AOPP水平与阻塞性睡眠呼吸暂停低通气综合征患者的认知功能障碍程度呈正相关。本研究结果显示,中晚期组患者血清AOPP水平高于早期组(P<0.05)。提示血清AOPP可能参与PD患者的病情进展过程。可能是因为氧化应激是导致PD发病的重要环节,而AOPP能够反映机体的氧化应激程度。因此可认为血清AOPP表达升高与PD病情加重有关。本研究结果显示,认知异常组血清AOPP水平高于认知正常组;血清AOPP与MoCA评分呈负相关(P<0.05)。提示血清AOPP水平上调与PD患者认知功能异常存在密切联系。可能原因是,AOPP是一种炎症调节因子,其过表达可刺激促炎介质释放增加,加重脑血管炎症,进而导致脑组织灌注量降低,引起认知功能异常[33]。同时AOPP可过度激活神经元区域的单核细胞、巨噬细胞等,诱导活性氧产生,引起神经细胞凋亡,损害脑组织功能[34-35]。因此认为AOPP异常表达与PD患者的认知功能异常有关。多因素Logistic回归分析结果显示,AOPP高水平是PD患者认知功能异常的影响因素之一(P<0.05)。进一步证实了AOPP可参与PD患者认知功能异常过程,可作为潜在的预测标志物。
综上所述,高水平PRDX1、AOPP与PD患者病情加重、认知功能异常关系密切,二者可作为评估患者认知功能异常的辅助血清标志物,有推广应用价值。

