血清LPE、LPC对急性冠脉综合征的早期诊断及预后评估价值*
吕园园,陈 娟,卢维娜,李 潇
中部战区总医院第一派驻门诊部,湖北武汉 430014
急性冠状动脉综合征(ACS)是冠状动脉粥样硬化斑块破裂、冠脉痉挛、完全性或不完全性闭塞性血栓形成为病理基础的心肌损伤综合征[1]。临床上根据ACS患者心肌损伤的类型可分为不稳定型心绞痛、急性ST段抬高型和急性非ST段抬高型心肌梗死[2]。目前用于心肌损伤诊断的血清标志物包括心脏肌钙蛋白T(cTnT)、肌酸激酶同工酶(CK-MB)等,但临床上对ACS的早期诊断的灵敏度不高,在评估冠状动脉病变严重程度及预后方面价值有限[3]。心脏是能量代谢旺盛的器官,ACS发生后会导致严重的心脏能量代谢障碍。近年来,随着代谢组学技术如高效液相色谱-串联质谱法的发展,对低相对分子量的代谢物质进行分析成为可能,这将有助于ACS的早期诊断及疾病严重程度判断[4]。研究表明,溶血磷脂酰乙醇胺(LPE)及溶血磷脂酰胆碱(LPC)是重要的代谢标志物,二者均参与细胞脂肪酸代谢、卵磷脂代谢等代谢过程,在非酒精性脂肪肝[5]、阿尔茨海默病[6]、动脉粥样硬化[7]等多种疾病中均发挥重要的调节作用,参与疾病的发生发展过程,可能是新的血清物标志物。本研究通过检测ACS患者血清中LPE、LPC的水平,初步分析二者在ACS早期诊断及预后评估中的价值。
1 资料与方法
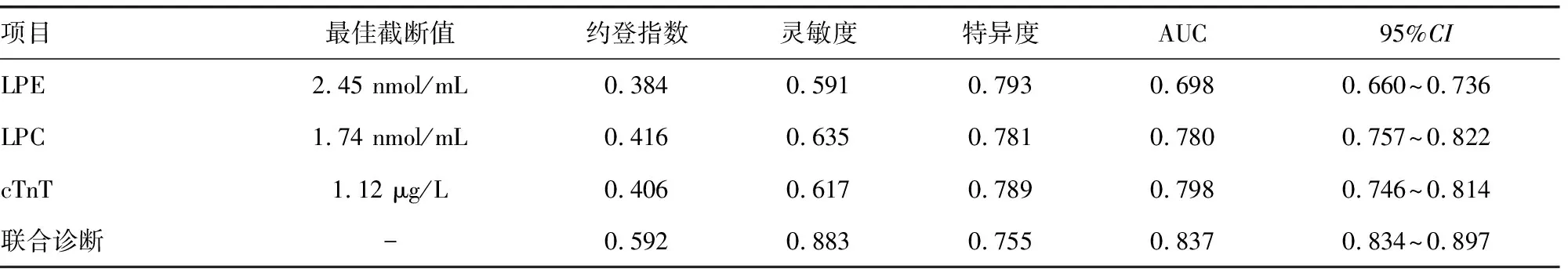
1.1一般资料 选取2021年1月至2022年6月本院收治的108例ACS患者为ACS组。纳入标准:(1)ACS诊断符合2019年美国心脏病学会/美国心脏协会(ACC/AHA)制订的ACS诊断标准[8];(2)临床及实验室检查等资料完整;(3)胸痛发作至入院间隔<4 h。(4)年龄18~85岁。排除标准:(1)合并严重的肝肾功能障碍;(2)合并心力衰竭、心肌病或严重心瓣膜疾病;(3)合并严重感染性疾病或恶性肿瘤。ACS组中男68例,女40例;年龄36~78岁,平均(60.82±6.32)岁;平均体质量指数(BMI)(26.01±3.82)kg/m2。选取同期本院60例稳定型心绞痛(SAP)患者作为SAP组,其中男37例,女23例;年龄33~79岁,平均(60.41±6.58)岁;平均BMI(25.68±3.31)kg/m2。另外,选取50例健康查体的健康志愿者作为对照组,其中男30例,女20例;年龄35~79岁,平均(59.82±7.12)岁;平均BMI(25.89±3.01)kg/m2。所有受试者及家属对本研究知情同意,并签署知情同意书,本研究经本院伦理委员会审核批准。
1.2方法
1.2.1血清LPE、LPC水平检测 采用高效液相色谱串联质谱检测各组血清LPE、LPC水平。留取ACS组和SAP组入院即刻,对照组清晨空腹静脉血5 mL,3 000 r/min离心10 min,分离上层血清。取30 μL血清,同时加入3倍体积的去蛋白液,12 000 r/min离心15 min,取上清至离心柱,4 000 r/min离心5 min,将滤过的上清用移液器转移到密封的EP管中。色谱条件:固定相为superlcosil LC-SCX;流动相为乙腈及水以10∶90的比例配制,等度洗脱,流速0.8 mL/min,柱温40 ℃,进样量5 μL,梯度洗脱程序15 min,分离LPE、LPC。检测LPE、LPC水平,每个标本重复检测5次,结果取平均值。
1.2.2观察指标 收集并记录所有受试者性别、年龄、BMI、糖尿病史、高血压史等一般资料,ACS组和SAP组入院即刻及对照组体检时静脉血生化指标,如总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、cTnT、CK-MB及血肌酐,完善各组心脏彩超检查,记录左心室射血分数(LVEF)。
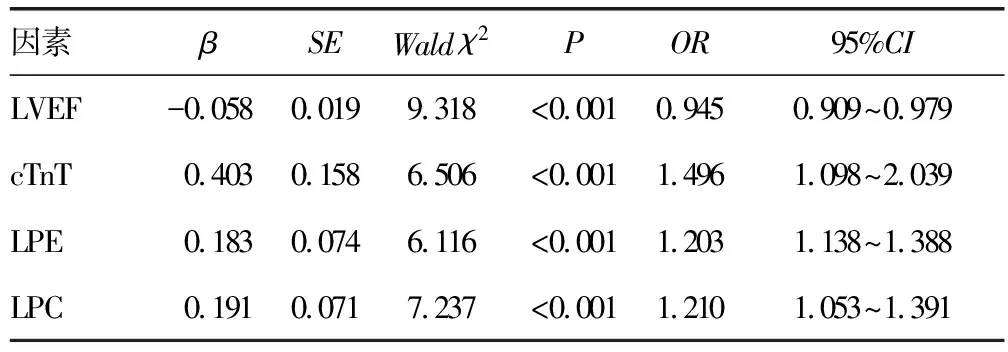
1.2.3ACS患者全球急性冠脉事件注册(GRACE)危险评分 根据ACS患者年龄、心率、动脉收缩压、血肌酐、入院时心脏骤停、心电图变化及心肌标志物等参数进行GRACE危险评分[9],用于对ACS患者危险分层。根据GRACE评分结果,将ACS患者分为高危组(GRACE评分>140分)34例、中危组(109分 1.2.4ACS患者随访及预后 ACS患者出院后以门诊或电话方式进行随访,所有患者随访6个月,随访内容为心脏不良事件(MACE)发生情况。MACE定义为全因死亡、非致命性的AMI、非预期的冠脉血运重建。根据是否发生MACE,将ACS组分为MACE组、非MACE组。 2.13组一般资料及血清LPE、LPC水平比较 ACS组、SAP组及对照组高血压史比例及血清LPE、LPC、cTnT、CK-MB水平比较差异均有统计学意义(P<0.05),而各组性别、年龄、BMI、糖尿病史比例及TC、TG、HDL-C、LDL-C水平比较,差异均无统计学意义(P>0.05)。进一步两两比较显示,相比于对照组和SAP组,ACS组LPE、LPC、cTnT、CK-MB水平明显升高(P<0.05)。见表1。 表1 各组一般资料及血清LPE、LPC水平比较或n/n) 2.2ACS患者血清LPE、LPC与心cTnT、CK-MB水平的相关性 Pearson相关分析结果显示,ACS患者血清LPE、LPC水平与血清cTnT水平呈正相关(r=0.612、0.568,均P<0.001),与CK-MB呈正相关(r=0.408、0.426,均P<0.001)。 2.3ACS患者血清LPE、LPC水平与GRACE危险评分的关系 高危组、中危组及低危组患者血清LPE、LPC水平比较,差异有统计学意义(P<0.05),进一步两两比较显示,高危组血清LPE、LPC水平明显高于中危组和低危组(P<0.05),中危组明显高于低危组(P<0.05)。见表2。 表2 ACS患者血清LPE、LPC水平与GRACE危险评分的关系 2.4血清LPE、LPC及cTnT对ACS的诊断效能 以约登指数最大时作为血清LPE、LPC、cTnT的最佳截断值,ACS诊断的曲线下面积(AUC)分别为0.698、0.780、0.798,血清LPE、LPC、cTnT联合检测的AUC为0.877(95%CI:0.834~0.897);相比于单项检测,三者联合检测的诊断价值明显较高(P<0.001)。见表3、图1。 图1 血清LPE、LPC及cTnT对ACS的诊断效能 表3 血清LPE、LPC与cTnT对ACS的诊断效能 2.5影响ACS患者预后的因素分析 MACE组患者血清LPE、LPC、cTnT、LVEF显著高于非 MACE组(P<0.05);MACE组与非MACE组性别、年龄、BMI、糖尿病史比例、高血压史比例及CK-MB、TC、TG、HDL-C、LDL-C水平比较,差异均无统计学意义(P>0.05)。见表4。以是否发生MACE(赋值:否=0,是=1)为因变量,以LPE、LPC、cTnT、LVEF(赋值:实际值)为自变量进行多因素Logistic回归分析,结果显示,血清LPE、LPC、cTnT水平升高及LVEF降低是影响MACE发生的独立危险因素(P<0.05)。见表5。 表4 影响ACS患者预后的单因素Logistic分析或n/n) 表5 影响ACS患者预后的多因素Logistic回归分析 冠心病是常见的心血管系统疾病,我国冠心病患病人数达1 100万例,近年来其患病率和死亡率呈不断升高的趋势[10]。ACS是冠心病的一种严重类型,具有发病急、病情重、预后差的特点,是心血管疾病患者死亡的主要原因,但如及时发现并治疗,有助于降低患者病死率,改善患者预后[1]。目前,临床上ACS相关的生物标志物有cTnT、CK-MB等,但其他疾病如败血症、脑血管疾病及心脏毒性药物反应等也可引起这些标志物水平的升高,因而对诊断ACS的特异度较低[11]。代谢是细胞生命活动的基础,代谢物质广泛参与细胞信号传导、能量转移等生物学过程。代谢组学是寻找代谢物与疾病病理生理学变化的研究方法,可以对低相对分子质量代谢物进行定性和定量分析。研究发现,代谢物质在动脉粥样硬化、高血压等心血管疾病中均具有不同的特点,如ACS患者磷脂酰胆碱通路的代谢异常能够加重血管内皮细胞损伤,加重炎症反应,导致斑块破裂等病理过程[12]。因此,对ACS患者血清中代谢物质进行分析,寻找可能作为ACS早期诊断、风险分层及预后判断的代谢标志物,是近年来的研究热点。 LPE是磷脂酶A1/A2催化磷脂酰乙醇胺的脱酰基产物,是参与构成细胞膜的一种重要成分。近年来研究发现,LPE通过下调肝细胞中TG水解酶基因的表达,并降低胆固醇调节元件结合蛋白1的表达,抑制脂肪分解,促进细胞中脂滴的形成[13]。ACS作为一种脂代谢异常的疾病,LPE可能在ACS中发挥重要的作用。本研究结果显示,ACS患者血清LPE水平升高,并且LPE的表达与ACS危险程度及心肌损伤标志物cTnT、CK-MB有关,表明LPE可能参与促进ACS的发生发展。ACS患者血清LPE水平升高机制可能与血管内皮细胞中磷脂酶A2活性升高有关。有学者发现,血管内皮细胞中的氧化物二氧化氮能够与细胞膜结合并显著激活磷脂酶A2的活性,导致细胞中磷脂酰乙醇胺水平降低,而LPE及磷脂酰丝氨酸水平显著升高[14]。此外,LPE能够通过诱导的巨噬细胞M1极化及泡沫细胞形成[15],M1巨噬细胞通过分泌产生大量白细胞介素1β等促炎性细胞因子,引起血流动力学变化,导致动脉硬化斑块破裂等急性冠状动脉事件的发生[16]。本研究中,血清LPE水平升高是影响ACS不良预后的独立危险因素,提示检测血清LPE水平可能有助于判断ACS患者的临床预后。分析其原因,可能是血清LPE水平影响动脉粥样硬化斑块不稳定性。研究表明,LPE的代谢产物溶血磷脂酸能够嵌入冠状动脉斑块/泡沫细胞中,增加斑块破裂的风险[17]。 LPC是卵磷脂代谢的中间产物,是一种具有生物活性的促炎症脂质,是构成氧化型低密度脂蛋白的主要磷脂成分。近年来发现,LPC通过激活蛋白激酶C、细胞外信号调节激酶第二信使,破坏内皮细胞及平滑肌细胞的功能,促进动脉粥样硬化的发生发展[7]。本研究中,ACS患者血清LPC水平明显较高,并且LPC的水平与ACS患者危险程度及心肌损伤标志物cTnT、CK-MB有关,表明LPC参与促进ACS的发生发展。LPC是在卵磷脂胆固醇酰基转移酶催化下,由血清中卵磷脂转化而成。研究表明,ACS患者卵磷脂胆固醇酰基转移酶活性显著升高导致LPC水平较高,进而加重血管内皮细胞的氧化应激损伤,促进动脉粥样硬化的形成[18-19]。此外,LPC还能够通过上调细胞间黏附分子的表达,促进白细胞与血管内皮细胞的黏附,导致循环中单核细胞的聚集浸润及泡沫细胞的形成,加重斑块的不稳定性[20]。本研究进一步分析发现,血清LPC水平升高是ACS患者不良预后的独立危险因素,表明检测血清LPC水平有助于判断ACS患者的临床预后。其原因可能是,LPC水平升高导致血管内皮细胞的功能障碍。研究表明,血清LPC水平升高通过抑制细胞内钙离子内流,抑制血管内皮细胞释放一氧化氮,引起冠状动脉血管过度收缩[21]。此外,LPC能够通过微泡的运输下,结合血小板表面的G2AR受体,激活血小板,促进血小板聚集,降低动脉粥样硬化斑块的不稳定性[22]。因此,临床医生可根据血清LPC水平对ACS患者的危险进行分层,以及评估患者的预后,进而采取有效的针对性治疗措施,降低病死率,改善患者临床预后。本研究中,ACS患者入院即刻(胸痛发作至入院间隔短于4 h)血清LPE、LPC水平明显升高,提示血清LPE、LPC能够较早反映心肌损伤的发生。ROC曲线分析结果证实,血清LPE、LPC与cTnT联合检测对ACS具有较高的诊断价值,提示血清LPE、LPC与cTnT联合检测有助于ACS的早期诊断。 综上所述,ACS患者血清LPE、LPC水平升高,血清LPE、LPC水平与ACS患者危险分层有关,血清LPE、LPC与cTnT联合检测对ACS具有较高的诊断效能,可为ACS的早期诊断、预防和治疗提供参考依据。血清LPE、LPC、cTnT水平升高及LVEF降低是影响MACE发生的独立危险因素。本研究尚存在一定的不足之处,一方面是本研究样本量有限,未对进一步进行分层分析,有待今后开展多中心临床研究深入探索;另一方面,不同研究检测血清代谢物质的方法及实验参数有所不同,有待今后采用标准化统一的检测方法进一步验证本研究结论。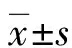
2 结 果



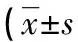
3 讨 论

