感染性休克患者血清NFL、sNRG-1水平与疾病转归的关系*
黄清平,王 波,林芳崇,云天奇
1.海南医学院第二附属医院急诊科,海南海口 570311;2.海南省人民医院/海南医学院附属海南医院急诊科,海南海口 570311
感染性休克作为一种复杂的临床综合征,发病后病情进展较快,若未及时诊断与治疗容易导致患者病情加重而出现死亡,目前数据显示,感染性休克病死率在30%~70%,已成为我国重症医学领域研究的重点[1-2]。神经丝蛋白轻链(NFL)作为中间丝蛋白家族成员之一,主要在维持神经细胞形态、促进有髓鞘的轴突再生中发挥重要作用[3],既往相关研究发现,血清NFL水平在急性缺血性脑卒中等疾病中升高,并且可作为评估患者疾病发生、预后的有效指标[4-5]。可溶性神经调节蛋白-1(sNRG-1)作为神经调节蛋白-1(NRG-1)的一种可溶形式,目前主要在神经系统疾病中发挥作用[6]。但目前有关于血清NFL、sNRG-1与感染性休克患者疾病转归的研究尚不清楚。因此,本次研究主要分析感染性休克患者血清NFL、sNRG-1水平与疾病转归的关系,现报道如下。
1 资料与方法
1.1一般资料 选取2019年1月至2022年5月海南医学院第二附属医院收治的121例感染性休克患者作为研究对象,其中男63例,女58例;年龄20~85岁,平均(64.55±6.44)岁。根据患者疾病转归情况将其分为死亡组(42例)、生存组(79例)。纳入标准:(1)符合感染性休克的诊断标准[7];(2)休克6 h内入院者。排除标准:(1)伴有重要脏器功能损伤;(2)合并心脑血管疾病、血液系统疾病、严重感染性疾病、自身免疫性疾病及恶性肿瘤;(3)在外院接受治疗超过24 h,且入院时生命体征平稳;(4)入院时间小于24 h;(5)妊娠期女性和儿童;(6)临床资料不全。本研究已获海南医学院第二附属医院伦理委员会批准,并获得患者及家属的知情同意。
1.2方法 (1)资料收集:入院后收集患者性别、年龄、体质量指数、住院时间及降钙素原(PCT)、白细胞计数(WBC)、C反应蛋白(CRP)、急性生理学与慢性健康状况评分系统Ⅱ(APACHEⅡ)评分、序贯器官功能衰竭(SOFA)评分等资料。(2)血清NFL、sNRG-1检测:所有纳入对象入院后均抽取外周静脉血4 mL送检,按照3 000 r/min离心15 min后使用1.5 mL PE管取上清液,存放至-80 ℃冰箱内于保存,并在24 h内采用酶联免疫吸附试验(ELISA)检测患者血清NFL、sNRG-1水平。本研究所有试剂盒及检验设备均由瑞士罗氏公司生产与提供,严格按照试剂盒说明书进行操作。
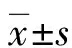
2 结 果
2.1死亡组、生存组基本资料比较 死亡组、生存组患者的性别、年龄、体质量指数比较,差异无统计学意义(P>0.05);死亡组患者住院时间长于生存组(P<0.05),PCT、WBC、CRP、APACHEⅡ评分、SOFA评分均明显高于生存组(P<0.05),见表1。
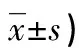
表1 死亡组、生存组患者入院时基本资料比较(n/n或
2.2死亡组、生存组患者血清NFL、sNRG-1水平比较 死亡组患者血清NFL水平均明显高于生存组,sNRG-1水平明显低于生存组(P<0.05)。见表2。

表2 死亡组、生存组患者血清NFL、sNRG-1水平比较
2.3血清NFL、sNRG-1对感染性休克患者疾病转归的预测价值 血清NFL预测感染性休克患者疾病转归的曲线下面积(AUC)为0.775,最佳截断值为2.36 pg/mL,灵敏度及特异度分别为92.83%、53.16%;血清sNRG-1预测感染性休克患者疾病转归的AUC为0.859,最佳截断值为2.17 ng/L,灵敏度及特异度分别为92.83%、65.82%;血清NFL联合sNRG-1预测感染性休克患者疾病转归的AUC为0.919,灵敏度及特异度分别为85.71%、86.08%。见表3、图1。

图1 血清NFL、sNRG-1对感染性休克患者疾病转归的预测ROC曲线

表3 血清NFL、sNRG-1对感染性休克患者疾病转归的预测价值
2.4感染性休克患者疾病转归的多因素Logistic回归分析 本研究以感染性休克患者疾病转归情况(赋值:好转=0,恶化=1)为因变量,以有血清NFL、sNRG-1及PCT、WBC、CRP、APACHEⅡ评分、SOFA评分等指标为自变量进行多因素Logistic回归分析发现,血清NFL、sNRG-1水平及SOFA评分、APACHEⅡ评分均为影响感染性休克患者疾病转归的独立危险因素(P<0.05)。见表4。

表4 感染性休克患者疾病转归的多因素Logistic回归分析
3 讨 论
感染性休克作为以低外周血管阻力和高心输出量且导致组织灌注不足为特征的急危重症,多年来一直因病情危重、致死率高、经济负担重等特点而成为重症医学研究的重点[8]。近年来,感染性休克的治疗逐步规范化,相关治疗指南得到及时更新,这对感染性休克的防治有重要意义。另外,寻找合适的检测指标,早期评估感染性休克病情危重程度并给予积极治疗,对改善预后非常重要。
NFL是一种大量表达于有髓轴突的蛋白,在维持轴突形态及神经传递中起重要作用,NFL缺失可导致轴突直径减小、轴突的再生能力受限、神经传导速度减慢[9]。既往研究发现,神经元细胞受损后可导致脑脊液与外周血中NFL水平升高[10]。而本研究通过分析发现,死亡组血清NFL水平均明显高于生存组(P<0.05),说明血清NFL水平与感染性休克疾病转归有关,这与吉康等[11]研究结果一致。本研究ROC曲线分析显示,血清NFL评估感染性休克患者疾病转归的AUC为0.775,灵敏度及特异度分别为92.83%、53.16%,说明血清NFL对感染性休克患者疾病转归有较好的预测价值,且当其水平超过2.36 pg/mL时,提示患者病情存在恶化风险。同时,本研究进一步分析发现,血清NFL为影响感染性休克患者疾病转归的危险因素,提示血清NFL对感染性休克患者疾病转归有着评估价值。有研究显示,当炎症、神经退行性病变、创伤或血管损伤等导致中枢神经系统轴突损伤时,NFL大量释放入脑脊液和血液中[12]。而感染性休克伴有全身失控性炎症反应,而随着促炎症细胞因子的大量产生可引起神经系统炎症反应,进而导致脑损伤[13-14]。因此,本研究中感染性休克患者可导致血清NFL水平升高,临床可通过检测感染性休克血清NFL水平及时了解患者病情变化。
NRG-1是神经调节素家族成员之一,具有心血管保护作用,包括促进心肌细胞增殖、抑制心肌细胞凋亡、促进血管新生等[15]。而sNRG-1作为神经调节蛋白-1的可溶形式,不仅具有诱导上皮细胞、神经胶质细胞、神经细胞和骨骼肌细胞的生长和分化作用,同时也有保护心血管作用[16]。本研究分析发现,死亡组患者血清sNRG-1水平明显低于生存组(P<0.05),说明血清sNRG-1与感染性休克疾病转归有关。但伍明超[17]研究发现,阿尔茨海默病患者血清中sNRG-1水平高于血管性痴呆者。本研究ROC曲线分析显示,血清sNRG-1评估感染性休克患者疾病转归的AUC为0.859,最佳截断值为2.17 ng/L,灵敏度及特异度分别为92.83%、65.82%,说明血清sNRG-1有效诊断感染性休克患者疾病转归。进一步分析发现,血清sNRG-1为影响感染性休克患者疾病转归的危险因素,证实血清sNRG-1对感染性休克患者疾病转归有评估价值。有研究发现,NRG-1与酪氨酸激酶受体结合具有调节细胞生长、抑制凋亡、促血管新生、抗炎等多层生物学效应[18]。还有研究显示,外源性补给NRG-1可抑制心肌细胞的凋亡、减轻心肌纤维化,从而改善大鼠心功能[19]。另外,研究发现,NRG-1预处理可以明显降低脓毒症大鼠循环中炎症因子水平[20],而感染性休克发病后由于急性微循环不足以及炎症因子的释放可导致心功能出现损伤。因此,机体NRG-1水平下降提示炎症因子水平升高,心肌功能受损严重。
本研究发现,血清NFL联合sNRG-1评估感染性休克患者疾病转归的AUC为0.919,灵敏度及特异度分别为85.71%、86.08%,提示二者联合应用有助于对感染性休克患者预后情况的把握,为临床及时采取积极有效的干预措施提供指导,有助于改善患者临床结局。
综上所述,血清NFL、sNRG-1水平与感染性休克患者疾病转归密切相关,均能够作为评估患者疾病转归的有效指标,二者联合对感染性休克患者疾病转归具有更好的预测价值。但本次研究为单中心,纳入数据存在局限性,可能对结论存在一定影响,因此后续研究中将扩大样本来源进一步分析。

