血清PTX3、Cys-C对宫颈癌患者化疗相关心脏毒性的评估价值*
严晓春,张文颖,刘 峰,胡晓华△
上海市交通大学医学院附属第九人民医院:1.妇产科;2.肿瘤科,上海 201900
宫颈癌是威胁女性健康安全的常见高发病,据相关数据显示,全球每年大约有57万新增病例,约占所有恶性肿瘤病例的3.15%[1]。化疗是治疗宫颈癌的常用手段之一,可缓解病情进展,延长预后生存时间,但是治疗期间容易导致不可逆的心脏损害,甚至诱发心源性死亡[2]。故早期评估宫颈癌患者化疗相关心脏毒性的发生风险十分重要。正五聚蛋白3(PTX3)属于正五聚蛋白家族,可调控机体的炎症反应、动脉粥样硬化形成等过程,研究发现,PTX3可作为评估急性失代偿性心力衰竭患者预后的辅助指标[3-4]。胱抑素C(Cys-C)属于半胱氨酸蛋白酶抑制剂超家族,可通过参与中性粒细胞的迁移,调控炎症介质的分泌,近年来研究发现,Cys-C可作为评估心血管疾病的敏感标志物[5]。但是关于PTX3、Cys-C与宫颈癌患者化疗相关心脏毒性的报道较少。因此,本次研究主要探讨血清PTX3、Cys-C对宫颈癌患者化疗相关心脏毒性的评估价值。
1 资料与方法
1.1一般资料 选取2020年7月至2022年7月本院收治的104例宫颈癌患者作为研究组,年龄40~75岁,平均(54.36±7.54)岁;体质量指数18~30 kg/m2,平均(20.17±4.15)kg/m2。纳入标准:(1)符合宫颈癌的诊断标准[6];(2)为首次患病,均接受化疗;(3)患者及监护人知情同意。排除标准:(1)既往有冠心病、心力衰竭等心脏疾病史;(2)合并脑、肺、肝等功能障碍;(3)近期有地氟迷、氟卡胺等影响心脏功能的用药史;(4)合并其他恶性肿瘤;(5)精神或认知不正常;(6)配合度差及拒绝参与本次研究。另外选取同期来本院体检的120例健康女性作为健康组,年龄40~75岁,平均(54.02±7.52)岁;体质量指数18~30 kg/m2,平均(20.82±4.19)kg/m2。研究组年龄、体质量指数与健康组比较差异均无统计学意义(P>0.05),具有可比性。本院医学伦理委员已对本研究审核批准。
1.2方法
1.2.1临床资料 收集宫颈癌患者的临床资料,包括年龄、体质量指数、吸烟史、饮酒史、基础病史、病理分期、分化程度、淋巴结转移、血肌酐、尿素氮、左心室射血分数(LVEF)、肌酸激酶、肌酸激酶同工酶等。
1.2.2化疗方法 所有宫颈癌患者均接受TP方案化疗,静脉滴注紫杉醇(华北制药股份有限公司,国药准字H20084439,剂量160 mg/m2)联合顺铂(江苏豪森药业集团有限公司,国药准字H20040812,剂量75 mg/m2),每3周给药1次,治疗4个周期。
1.2.3血清PTX3、Cys-C水平检测 采集健康女性体检当天、宫颈癌患者首次化疗当天的空腹静脉血样5 mL,经离心处理出后,保留上层清液,采用酶联免疫吸附试验检测PTX3水平。试剂盒购自上海酶仪生物科技有限公司,操作流程参考使用说明书。使用美国贝克曼库尔特公司AU5800型全自动生化仪检测血清Cys-C水平,检测原理为免疫比浊法,试剂盒购自武汉博士德公司。
1.2.4化疗相关心脏毒性[7](1)化疗后LVEF与化疗前相比降低>10%,并且伴随心力衰竭症状;或化疗后LVEF与化疗前相比降低>15%,但是无心力衰竭症状。(2)心肌酶检查结果异常:血清肌酸激酶、肌酸激酶同工酶水平升高。(3)心电图检查结果异常:T波低平、R波低电压、窦性心动过速或过缓、ST段下降或抬高。根据是否发生化疗相关心脏毒性事件将研究组患者分为非心脏毒性组(85例)与心脏毒性组(19例)。
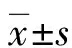
2 结 果
2.1两组血清PTX3、Cys-C水平对比 研究组血清PTX3、Cys-C水平高于健康组(P<0.05)。见表1。

表1 两组血清PTX3、Cys-C水平对比
2.2非心脏毒性组与心脏毒性组血清PTX3、Cys-C水平对比 心脏毒性组血清PTX3、Cys-C水平高于非心脏毒性组(P<0.05)。见表2。

表2 非心脏毒性组与心脏毒性组血清PTX3、Cys-C水平对比
2.3血清PTX3、Cys-C对宫颈癌患者化疗相关心脏毒性的预测价值 血清PTX3、Cys-C预测宫颈癌患者化疗相关心脏毒性的曲线下面积(AUC)分别为0.841、0.787,二者联合预测的AUC为0.903。见表3、图1。

图1 血清PTX3、Cys-C预测宫颈癌患者化疗相关心脏毒性的ROC曲线

表3 血清PTX3、Cys-C对宫颈癌患者化疗相关心脏毒性的预测价值
2.4宫颈癌患者化疗相关心脏毒性的单因素分析 心脏毒性组患者高血压史占比、肌酸激酶及肌酸激酶同工酶水平高于非心脏毒性组患者(P<0.05),LVEF低于非心脏毒性组患者(P<0.05)。见表4。

表4 宫颈癌患者化疗相关心脏毒性的单因素分析或n(%)]
2.5宫颈癌患者化疗相关心脏毒性的多因素Logistic回归分析 本研究将宫颈癌患者是否发生化疗相关心脏毒性事件作为因变量(否=0,是=1),将单因素分析差异有统计学意义的指标及PTX3、Cys-C作为自变量进行多因素Logistic回归分析,结果显示,LVEF≤52.57%、PTX3≥5.84 ng/mL、Cys-C≥2.98 mg/L是宫颈癌患者化疗相关心脏毒性的影响因素(P<0.05)。见表5。

表5 宫颈癌患者化疗相关心脏毒性的多因素Logistic回归分析
3 讨 论
宫颈癌的发病率位居女性恶性肿瘤的第2位,近年来我国大力推广宫颈癌早期筛查及人乳头瘤病毒(HPV)疫苗接种,其发病率有下降趋势,但是防控形势仍然十分严峻[8]。宫颈癌化疗期间容易因药物不良反应导致心脏毒性事件发生,包括心率失常、心肌炎、心力衰竭等,进而影响治疗效果,是现阶段我国医务工作者亟待解决的难题[9]。目前临床通过超声心动图检查、心肌酶检查等方式来检测心脏毒性,但是特异度较低,且费用昂贵[10]。因此,选择合适的血清指标用于评估宫颈癌患者化疗相关心脏毒性可指导临床治疗。
PTX3作为一种炎性标志物,在炎症刺激下可由巨噬细胞、单核细胞等免疫细胞产生和释放,能够参与机体炎症反应、动脉粥样硬化形成等过程,与多种心血管疾病的进展有关[11]。既往研究发现,PTX3可介导相关信号转导过程,调控成纤维细胞生长因子、内皮组织因子的表达,进而推动慢性心力衰竭的病情进展[12]。郑国红等[13]报道称,发生乳腺癌放化疗相关心脏毒性事件的患者血清PTX3水平升高,且该指标具有一定的早期预测价值。本研究结果显示,研究组血清PTX3水平高于健康组(P<0.05);心脏毒性组血清PTX3水平高于非心脏毒性组(P<0.05)。提示血清PTX3水平在宫颈癌患者中表达上调,且与患者发生化疗相关心脏毒性有关。究其原因,宫颈癌化疗期间会破坏患者免疫细胞的正常功能,导致机体免疫低下,促使大量的炎症介质释放入血,而PTX3作为急性期时相反应蛋白,其血清水平明显增加。PTX3表达上调后可加重血管内膜炎症,诱导动脉粥样硬化形成,进而影响心脏血供[14]。同时PTX3可使成纤维细胞过度活化,导致胶原沉积,诱发心肌重塑,进而损害心肌功能[15]。本研究结果显示,血清PTX3预测宫颈癌患者化疗相关心脏毒性的AUC为0.841,灵敏度为94.73%;且PTX3≥5.84 ng/mL是宫颈癌患者化疗相关心脏毒性的影响因素(P<0.05)。提示检测血清PTX3水平可协助评估宫颈癌患者发生化疗相关心脏毒性事件的风险。
Cys-C是由122个氨基酸残基构成的小分子分泌蛋白,由真核细胞产生,具有抑制半胱氨酸蛋白酶活性的作用,同时可影响中性粒细胞的迁移过程,进而参与机体的炎症反应[16]。既往研究发现,Cys-C可抑制心肌组织中蛋白酶B活性,促使大量的胶原蛋白积聚,引起心室壁增厚,降低心肌顺应性[17]。戴红梅等[18]研究发现,血清Cys-C水平在慢性心力衰竭患者中上升,且与患者心肾损伤程度有关。本研究结果显示,研究组血清Cys-C水平高于健康组(P<0.05);心脏毒性组血清Cys-C水平高于非心脏毒性组(P<0.05)。提示血清Cys-C在宫颈癌患者中呈高表达,且与患者化疗相关心脏毒性有关。究其原因,Cys-C过表达可抑制中性粒细胞的迁移,促使多种炎症介质释放入血,损伤心血管内膜,并且可加重机体氧化应激,加速心肌细胞凋亡,进而损害心功能[19]。同时Cys-C与心室重塑密切相关,而血清Cys-C水平升高后可抑制组织蛋白酶B的活性,促使心肌组织周围的胶原蛋白合成与降解失衡,加重心肌损伤[20]。本研究结果显示,血清Cys-C预测宫颈癌患者化疗相关心脏毒性的AUC为0.787,灵敏度为94.73%;且Cys-C≥2.98 mg/L是宫颈癌患者化疗相关心脏毒性的影响因素。表明Cys-C可作为预测宫颈癌患者化疗相关心脏毒性的辅助指标,且Cys-C高表达会增加患者发生化疗相关心脏毒性事件的风险。
综上所述,血清PTX3、Cys-C水平升高与宫颈癌患者化疗相关心脏毒性密切相关,可作为评估宫颈癌患者化疗相关心脏毒性的生物学指标,且二者联合预测的效能更高。

