基于MELD评分探讨RDW及ApoA1与肝硬化患者病情严重程度的关系*
王晴晴,丁 洁,武昆利,李海雯,刘思奇,华丽娟,常国楫,陈华憶,张 露,李生浩
昆明市第三人民医院/云南省传染性疾病临床医学中心肝病综合科,云南昆明 650041
肝硬化是各种肝脏疾病发展的晚期阶段,以肝纤维化、假小叶及再生结节形成为基本病理表现,该病病死率在成人疾病死亡中位居第5位[1]。有研究表明,红细胞分布宽度(RDW)与乙型肝炎病毒(HBV)感染的严重程度相关[2]。也有研究报道,血脂谱中特定成分的降低可以使肝硬化患者生存率降低[3]。但是RDW与血脂谱在肝硬化患者病情进展中究竟扮演何种角色,目前尚不十分清楚。终末期肝病模型(MELD)评分作为临床上最常用的评估终末期肝脏疾病病情风险的评分系统,可用于评估患者的肝脏储备功能,以及用于等待肝移植的患者筛选。因此,本研究基于MELD评分,对肝硬化患者的常见临床指标进行分析,阐明RDW和血脂谱与因肝硬化住院患者病情严重程度的关系及对90 d内死亡的预测价值,旨在不增加额外经济花费的情况下,为肝硬化患者病情的预测提供新的临床思路。
1 资料与方法
1.1一般资料 以2021年1月至2022年10月昆明市第三人民医院因肝硬化住院的172例患者为研究对象。肝硬化诊断标准参照2019年中国《肝硬化诊治指南》[4],具体为B超、CT或MRI等影像学提示肝硬化,胃镜提示食管胃静脉曲张或消化道异位静脉曲张,除外非肝硬化性门静脉高压症。排除标准:(1)合并胃癌、肝癌、食管癌、胆道癌等消化系统恶性肿瘤;(2)甲状腺功能障碍;(3)合并严重心、脑血管疾病及肾脏疾病;(4)糖尿病;(5)近期服用糖皮质激素、性腺激素、调脂药物及肠外营养史;(6)血液系统疾病、凝血机制障碍、类风湿性疾病;(7)近期有口服叶酸、维生素B12、铁剂药物史及输血史。所有受试者(或家属)签署知情同意书。本研究经昆明市第三人民医院伦理委员会批准。
1.2研究方法 收集患者的基本资料(年龄、性别),并收集入院后首次检测的常规临床资料,包括RDW、血小板计数(PLT)、凝血酶原时间(PT)、国际标准化比值(INR)、肝功能指标[总胆红素(TBIL)、门冬氨酸氨基转移酶(AST)、谷氨酸氨基转移酶(ALT)、清蛋白(ALB)、胆碱酯酶(CHE)]、肌酐(CREA)、血脂谱[三酰甘油(TG)、血清总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、载脂蛋白A1(ApoA1)、载脂蛋白B(ApoB)、载脂蛋白E(ApoE)]。根据收集的资料计算患者的MELD评分。MELD计算公式:R=9.6×ln[CREA(mg/dL)]+3.8×ln[TBIL(mg/dL)]+11.2×ln(INR)+6.4×病因(胆汁或酒精性为0,病毒性或其他为1)[5]。根据意大利罗马杰梅利大学医院的肝移植患者的选择标准[6],将MELD评分的分界值设定在13分,将所有患者分为高MELD评分组(MELD评分≥13分)和低MELD评分组(MELD评分<13分)。通过电话随访的形式获取所有患者入院后90 d内的生存情况,根据是否死亡,分为死亡组和存活组。
2 结 果
2.1低MELD评分组与高MELD评分组的基本临床资料比较 高MELD评分组PLT、ALB、CHE、TC、HDL-C、LDL-C、ApoA1、ApoB均低于低MELD评分组,而PT、INR、RDW、TBIL、ALT、AST、CREA均高于低MELD评分组(P<0.05);年龄、性别在两组间比较差异均无统计学意义(P>0.05)。见表1。

表1 低MELD评分与高MELD评分患者基本临床资料、RDW及血脂谱比较或n(%)或M(P25,P75)]
2.2RDW及血脂谱与MELD评分之间的Spearman相关性分析 Spearman相关性分析显示,RDW与MELD评分呈正相关(r=0.544,P<0.05),TC、HDL-C、LDL-C、ApoA1、ApoB与MELD评分呈负相关(r=-0.422、-0.556、-0.443、-0.585、-0.243,P<0.05);TG、ApoE与MELD评分之间无相关性(P>0.05)。
2.3肝硬化患者高MELD评分的影响因素分析 为明确RDW和血脂相关指标是否为肝硬化高MELD评分组患者的影响因素,将上述Spearman相关性分析中与MELD评分有明显相关性的指标进行二元Logistics回归分析显示,RDW是肝硬化高MELD评分的独立危险因素(OR=1.133,95%CI:1.011~1.268,P<0.05),ApoA1则是肝硬化高MELD评分的独立保护因素(OR=0.063,95%CI:0.020~0.200,P<0.05)。见表2。
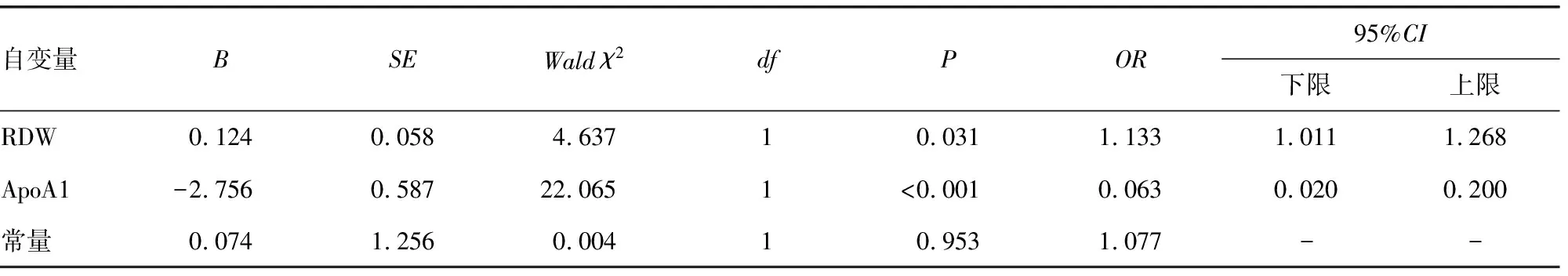
表2 影响MELD评分高低的二元Logistic回归分析
2.4存活组与死亡组基本资料、RDW及血脂谱的比较 对上述172例受试者进行随访,根据是否在90 d内发生死亡分为死亡组(32例,占18.6%)和存活组(140例,占81.4%)。死亡组RDW、男性占比明显高于存活组(P<0.05),而TC、HDL-C、LDL-C、ApoA1、ApoE水平低于存活组(P<0.05);年龄、TG、ApoB在两组之间比较,差异无统计学意义(P>0.05)。见表3。

表3 90 d存活与死亡患者的基本资料、RDW及血脂谱比较或n(%)或M(P25,P75)]
2.5肝硬化患者90 d内发生死亡的影响因素分析 为探索RDW、血脂相关指标是否为肝硬化患者90 d内死亡的影响因素,以是否发生死亡为因变量,以性别、RDW、TC、HDL-C、LDL-C、ApoA1、ApoE为自变量,进行二元Logistic回归分析(Forward:LR法),结果显示,RDW是肝硬化患者90 d内发生死亡的独立危险因素(OR=1.198,95%CI:1.059~1.355,P<0.05),而ApoA1则属于独立保护因素(OR=0.090,95%CI:0.023~0.353,P<0.05)。见表4。

表4 影响肝硬化患者90 d内存活或死亡的二元Logistic回归分析
2.6RDW、ApoA1、MELD评分对肝硬化患者90 d内发生死亡的预测效能 将RDW、ApoA1及MELD评分绘制ROC曲线,结果显示,曲线下面积(AUC)由高到低排序分别为RDW+ApoA1[AUC=0.813(95%CI:0.742~0.884),P<0.05]、MELD评分[0.716(95%CI:0.620~0.812),P<0.05]、ApoA1[0.707(95%CI:0.547~0.866),P<0.05]、RDW[0.670(95%CI:0.486~0.853),P<0.05],RDW+ApoA1预测肝硬化患者90 d内死亡的灵敏度和特异度分别为69.3%和84.4%,MELD评分为60.0%和75.0%,ApoA1为69.3%和78.1%,RDW为72.1%和68.7%。见表5、图1。

图1 RDW、ApoA1、MELD评分预测肝硬化患者90 d内发生死亡的ROC曲线
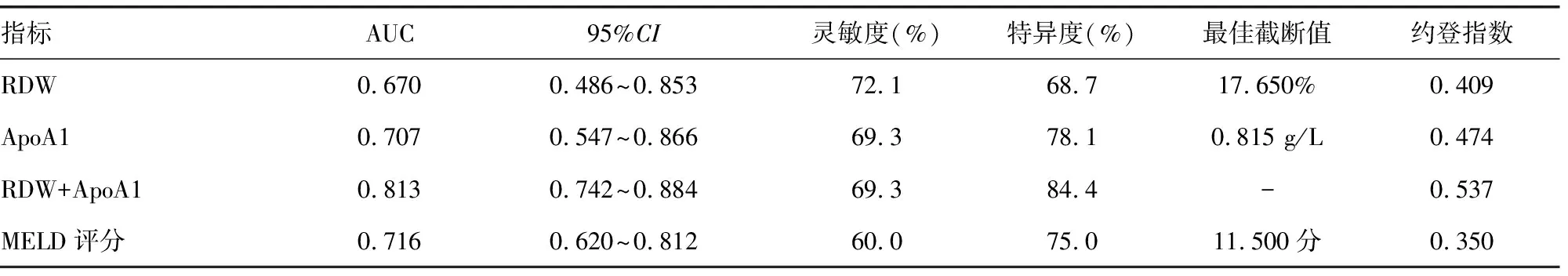
表5 RDW、ApoA1及MELD评分对肝硬化患者90 d内发生死亡的预测效能
3 讨 论
MELD评分作为晚期肝脏疾病高级别评分,已在慢加急性肝衰竭的病情评估、肝移植患者的选择、肝硬化患者的手术评估、危重症患者的死亡及预后评估方面发挥重要的作用[7-8],目前被广泛应用于终末期肝脏疾病患者的病情评估,其分值越高代表肝脏病情越重。RDW是一种自动测量红细胞大小变化的方法,它的增加反映了红细胞内稳态的严重失调。目前有研究表明,RDW与肝脏疾病病情的严重程度有关[2,9-11]。肝脏是合成血脂和载脂蛋白的重要器官,血脂和载脂蛋白水平与肝功能受损的严重程度密切相关[12]。因此,基于MELD评分对RDW及血脂谱与肝硬化患者病情严重程度的关系进行探讨,可为该类患者病情严重程度的预测提供真实可信的临床依据。
近年来,RDW在危重疾病中的应用受到广泛关注。RDW增加可能与多种代谢异常相关,如氧化应激、炎症、高血压、营养不良、血脂异常和红细胞疾病等[13]。肝脏是主要的造血器官,主要生成红细胞,肝脏病变会导致红细胞系统异常,出现不同程度的贫血[14]。目前,对于RDW在肝脏疾病中发生变化的机制不是十分清楚。肝硬化患者RDW增加可能与以下原因有关[14-15]:(1)肝硬化程度越重,脾功能亢进越重,红细胞破坏过多,从而刺激红细胞增生,导致RDW增加;(2)肝硬化越严重,门脉高压越重,影响胃肠道对铁剂的吸收,同时消化道出血可能导致铁丢失过多,从而出现小细胞低色素贫血,导致RDW增加;(3)肝硬化患者容易导致脂肪代谢紊乱,从而影响红细胞膜结构改变,使得红细胞形态改变,导致RDW增加。乙型肝炎肝硬化患者RDW高于普通肝炎患者,且RDW与Child-Pugh评分和MELD评分呈正相关[13,16],提示RDW与乙型肝炎肝硬化患者的病情严重程度相关,乙型肝炎肝硬化程度越重,RDW越高。本研究中RDW在高MELD评分组及死亡组中较高,RDW与MELD评分呈正相关与上述报道观点基本一致。
肝脏是脂质代谢的主要场所,ApoA是高密度脂蛋白(HDL)的主要结构蛋白,其中ApoA1是载脂蛋白的主要种类之一,由肝脏和肠道分泌,它们除了将胆固醇从外周细胞转运到肝脏,还具有重要的抗炎特性[17],它可以激活卵磷脂酰胆碱-胆固醇酰基转移酶(LCAT)将体内的胆固醇逆向转运到肝脏,有助于清除组织多余脂质,因ApoA1意义最明确,在组织中水平最高,因此是临床常用的检测指标[17-18]。肝硬化导致血脂水平异常考虑以下原因引起[18]:(1)肝硬化时肝脏功能受损,使肝细胞合成的多种脂代谢中的关键酶合成减少,导致血脂减少;(2)肝硬化时胃肠道淤血,导致吸收不良、食欲下降,因营养不良而影响血脂水平;(3)肝硬化时激素的合成分解及糖代谢紊乱,影响血脂合成,导致血脂合成减少。在酒精性肝硬化和/或丙型肝炎肝硬化患者中血脂水平TC、HDL、LDL、极低密度脂蛋白、TG与MELD评分呈负相关[19]。本研究中,高MELD评分组TG、TC、HDL-C、LDL-C、ApoA1、ApoB、ApoE水平均低于低MELD评分组,死亡组中TC、HDL-C、LDL-C、ApoA1、ApoE水平均低于生存组,TC、HDL-C、LDL-C、ApoA1、ApoB与MELD评分呈负相关。以上研究表明,血脂水平的高低可以反映肝脏的合成能力,从而间接提示肝硬化患者病情的严重程度。
有研究显示,乙型肝炎肝硬化患者根据RDW数值的不同进行分组,不同RDW组间的MELD评分存在明显差异,提示RDW是HBV感染严重程度的独立危险因素[20]。肝硬化患者中,随着Child-Pugh分级的升高,ApoA1水平逐渐下降,说明血清ApoA1对肝功能的评价更加敏感[18]。本研究发现,RDW是肝硬化患者高MELD评分组及90 d死亡组的危险因素,而ApoA1为保护因素,说明RDW增高、ApoA1水平下降可能预示肝硬化患者病情加重,短期死亡风险增加。本研究将RDW、ApoA1及MELD评分绘制ROC曲线,结果显示,AUC由高到低排序分别为RDW+ApoA1、MELD评分、ApoA1、RDW,表明RDW、ApoA1与肝硬化患者病情的严重程度密切相关,且对于短期死亡具有良好的预测价值,相较于MELD评分,RDW联合ApoA1预测效果更佳。
综上所述,基于MELD评分对肝硬化患者常见的临床指标进行研究,结果显示RDW及ApoA1与肝硬化患者病情的严重程度密切相关,其可作为肝硬化患者病情严重程度的预测指标,在临床观察、治疗和预后评估中有重要的指导意义。因肝硬化病因诸多,本研究所搜集的病例有限,没有进行病因分类后的对比分析,基于MELD评分、RDW和血脂谱,尤其是ApoA1与不同病因导致的肝硬化患者病情严重程度的关系是否与本研究结果一致,需要扩大样本量通过更为缜密的基础及临床试验进一步证实。

