miR-145-5p靶向FGF5对神经细胞缺血/再灌注损伤诱导的神经元细胞凋亡和氧化应激的影响
贾燕燕,张小林,潘 燕,赵 迪
缺血性脑血管病(ischemic cerebrovascular diseases,ICVD)是具有高发病率、高致残率及高死亡率的急性脑血管疾病[1-2],其中缺血性脑卒中的发病率占所有脑卒中的87%,临床通常采用及时溶栓、介入等方式恢复缺血区域的血流再灌注,但血流再灌注可能引发缺血性再灌注损伤(ischemia/reperfusion injury,I/R)。神经元细胞是对缺血缺氧最敏感的细胞,I/R对神经元细胞的损伤非常大。研究表明,缺血性脑卒中的病理生理机制包括兴奋神经毒性神经递质释放、细胞内Ca2+积聚、自由基损伤、细胞凋亡、神经炎症及脂质分解等[3],但I/R的发病机制仍不完全清楚,因此,进一步研究缺血性脑卒中的发病机制以寻找潜在的治疗靶点,从而提高缺血性脑卒中疗效,降低病人死亡率和致残率。miRNA是真核生物中具有调控功能的短链非编码RNA[4],包含21~23个核苷酸序列[5],可与目标基因mRNA的3′-非编码区(3-UTR)碱基配对结合,对目标基因发挥调控作用。近年来的研究表明,miRNA对缺血再灌注损伤具有调控作用,如miR-429的表达可缓解氧糖剥夺/复氧(OGD/R)对神经细胞的损伤[6],而microRNA-320可通过抑制胰岛素生长因子-1调控脑缺血/再灌注损伤[7];miR-145-5p受长链非编码RNA SNHG14调控,参与脑梗死的发生发展[8]。最近的研究表明,缺血时miR-145-5p表达水平的改变可影响神经元的活性[9]。成纤维细胞生长因子5(FGF5)是小鼠拟胚体外胚层标志物,在胚胎发育和神经发育中发挥重要作用。本实验以体外培养的小鼠海马区神经元细胞为研究对象,构建OGD/R模型,研究miR-145-5p与FGF5的靶向关系及其对氧化应激反应的影响,为脑缺血再灌注提供潜在靶点。
1 材料与方法
1.1 实验材料
小鼠海马神经元HT22细胞购自中国科学院上海细胞库;miR-145-5p inhibitor由广州锐博生物有限公司合成;小干扰RNA(siRNA)靶向FGF5购自上海Genechem公司;胎牛血清、DMEM培养基和胰蛋白酶购自美国Gibco公司;活性氧(ROS)检测试剂盒、放射免疫沉淀试验(RIPA)裂解液、二喹啉甲酸(BCA)试剂盒均购自上海碧云天生物技术研究所;丙二醛(MDA)试剂盒、超氧化物歧化酶(SOD)试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒均购自北京康为世纪生物科技有限公司。
1.2 细胞培养与OGD/R模型建立
细胞培养:采用含10%胎牛血清、1%青霉素/链霉素的DMEM培养基培养HT22细胞,培养条件为37 ℃、5%CO2。OGD/R模型建立:HT22细胞置于无糖平衡盐溶液中,在三气缺氧细胞培养箱(37 ℃、1%O2、94%N2、5%CO2)中培养4 h后,更换为含4.5 g/L葡萄糖的培养基,常规复氧培养(95%空气、5%CO2)12、24 h制备OGD/R模型,对照组不进行OGD/R处理,常规条件下培养。
1.3 流式细胞术检测神经元细胞凋亡
将HT22细胞(密度为2×105个/mL)接种于六孔板,按上述OGD/R模型建立方法处理HT22细胞6、12、24 h,收集细胞并离心,用预冷磷酸缓冲盐溶液(PBS)洗涤两次,调整细胞密度为1×106个/mL。将5 μL的V-异硫氰酸荧光素(Annexin V-FITC)和10 μL的碘化丙啶(PI)加入100 μL的1×Binding Buffer重悬细胞悬液中混匀,室温避光孵育5 min,最后加入400 μL的1×Binding Buffer混匀,在流式细胞仪上进行检测,并采用BD FAC-Suite软件作图。
1.4 蛋白免疫印迹法(Western Blot)检测蛋白表达
复氧24 h后收集各组细胞,加入RIPA蛋白裂解液冰上裂解30 min,在低温冷冻离心机上以12 500 r/min离心10 min,取上清,采用BCA蛋白定量试剂盒测定蛋白总浓度。取50 μg总蛋白进行聚丙烯酰胺凝胶(SDS-PAGE)电泳,电转至聚偏二氟乙烯膜(PVDF),Tris 缓冲盐溶液(TBS)洗膜10 min,5%牛血清白蛋白封闭2 h,加一抗4 ℃孵育过夜,次日加入相应二抗孵育1~2 h,增强型化学发光剂(ECL)显色,采用Image J2x图像分析系统分析蛋白条带灰度值,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参。
1.5 氧化应激标志物检测
分别采用MDA、SOD、ROS及LDH试剂盒检测细胞MDA、SOD、ROS及LDH含量。
1.6 荧光素酶报告实验验证靶向关系
采用Targetscan 和MiRDB生物信息学预测软件预测miR-145-5p和FGF5的结合位点,合成携带miR-145-5p结合位点的野生型(WT)FGF5 3′-UTR,并将其克隆至pMIR-control荧光素酶报告质粒中,293T细胞接种到95孔板中,使用Lipofectamine3000将pcDNA3.0-FGF5 WT和突变型(MUT)质粒分别与miR-145-5p mimic共转染,48 h后,通过双荧光素酶报告试验系统测定荧光素酶活性。
1.7 细胞转染
将siRNA靶向FGF5和对照siRNA分别插入pcDNA3.0质粒,取对数生长期的HT22细胞,调整细胞密度为1×104个/mL,接种于24孔板,常规培养24 h后,采用Lipofectamine 3000将上述pcDNA3.0质粒转染至HT22细胞。
1.8 实时定量聚合酶链式反应(RT-PCR)
采用TRIzol试剂提取细胞总RNA,然后将RNA逆转录为cDNA,然后以cDNA为模板采用SYBR Gene RealtimePCRMaster Mix进行RT-PCR,使用Fast Real-time PCR 7300系统分析miR-145-5p的mRNA水平,反应均以U6为内参计算蛋白的相对表达量,采用2-ΔΔCt计算mRNA相对表达量。详见表1。

表1 基因名称及引物序列
1.9 统计学处理

2 结 果
2.1 OGD/R处理对神经细胞氧化应激反应的影响
神经细胞经氧糖剥夺后复氧,细胞ROS、MDA及细胞上清LDH含量随复氧时间的增加而增加,而SOD活性则随复氧时间的增加而降低,OGD/R 6、12、24 h时ROS、MDA、LDH、SOD水平与0 h比较,差异均有统计学意义(P<0.01),提示OGD/R诱导神经细胞出现氧化应激反应。详见图1、图2。

图1 OGD/R处理对神经细胞LDH、SOD水平的影响

图2 OGD/R处理对神经细胞ROS、MDA水平的影响
2.2 OGD/R处理对miR-145-5p表达的影响
神经细胞经氧糖剥夺后复氧不同时间,miR-145-5p表达均高于对照组(P<0.01),并且随着复氧时间的增加,miR-145-5p表达量增加,提示OGD/R能诱导神经细胞中miR-145-5p的表达,详见图3。神经细胞转染miR-145-5p mimic后氧糖剥夺,miR-145-5p表达水平明显高于OGD/R 24 h;而miR-145-5p inhibitor组miR-145-5p表达水平明显低于OGD/R 24 h组,差异均有统计学意义(P<0.01),详见图4。提示miR-145-5p的高表达与I/R损伤相关。

图3 神经细胞经OGD/R不同时间miR-145-5p表达比较

图4 神经细胞转染miR-145-5p mimic后氧糖剥夺对miR-145-5p表达的影响
2.3 OGD/R处理对神经元细胞凋亡的影响
流式细胞术检测结果显示,与0 h比较,OGD/R处理6、12、24 h神经元凋亡细胞及凋亡率均增加,差异均有统计学意义(P<0.01)。详见图5、图6。

图5 流式细胞术检测HT22神经元细胞凋亡情况
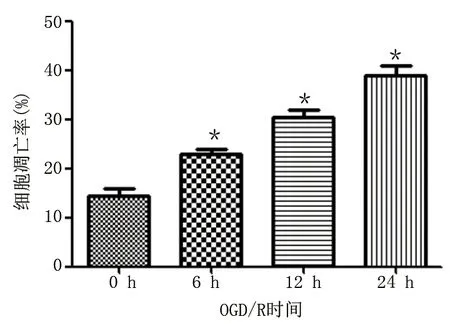
图6 OGD/R处理对HT22神经元细胞凋亡率的影响
2.4 miR-145-5p与FGF5的靶向关系
miR-145-5p在miRTar base、Target scan、Target miner及miRDB在线软件中分别存在15 064、890、1 305、495个潜在靶基因,经过绘制Venn图并取其交集共有100个潜在的靶基因,FGF5为其中之一。详见图7。

图7 Venn图
采用Targetscan 验证miR-145-5p与FGF5的靶向关系,结果显示,miR-145-5p与FGF5的3′-UTR有互补序列。荧光素酶报告结果显示,WT FGF5 3′-UTR与miR-145-5p mimic共转染后,荧光素酶的活性明显降低;MUT FGF5 3′-UTR与miR-145-5p mimic共转染后,荧光素酶的活性变化不明显。与OGD/R比较,miR-145-5p inhibitor明显上调FGF5表达,FGF5 siRNA明显下调FGF5表达,差异均有统计学意义(P<0.01)。详见图8、图9。
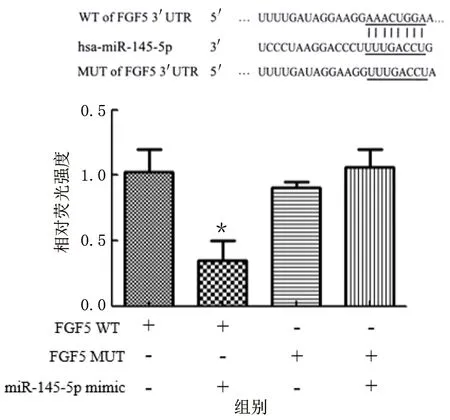
图8 荧光素酶实验验证FGF5与miR-145-5p的靶向关系
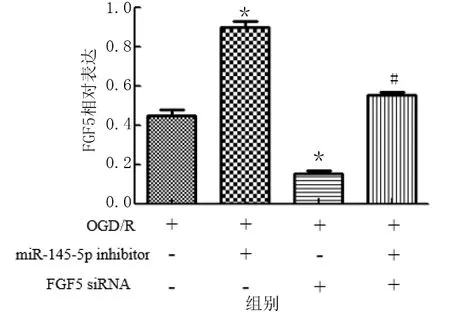
图9 miR-145-5p靶向负向调控FGF5表达
2.5 miR-145-5p inhibitor 抑制OGD/R诱导的HT22细胞凋亡
与OGD/R组比较,OGD/R+miR-145-5p inhibitor组HT22细胞凋亡率明显降低(P<0.01),OGD/R+FGF5 siRNA组HT22细胞凋亡率明显增加(P<0.01)。OGD/R+miR-145-5p inhibitor+FGF5 siRNA组与OGD/R+FGF5 siRNA组比较,HT22细胞凋亡率明显降低(P<0.01)。详见图10、图11。
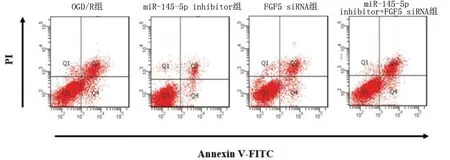
图10 流式细胞术检测HT22神经元细胞凋亡情况
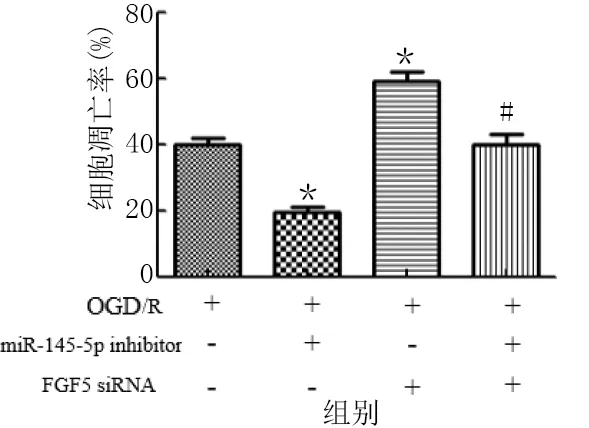
图11 miR-145-5p inhibitor 抑制OGD/R诱导的HT22细胞凋亡
2.6 miR-145-5p inhibitor 减轻OGD/R诱导的氧化应激损伤
细胞氧化应激损伤检测结果显示,与OGD/R组比较,OGD/R+miR-145-5p inhibitor组细胞MDA、ROS和LDH含量均明显降低,SOD活性明显升高,差异均有统计学意义(P<0.01);OGD/R+FGF5 siRNA组细胞MDA、ROS和LDH含量均明显增加,SOD活性明显降低,差异均有统计学意义(P<0.01)。OGD/R+miR-145-5p inhibitor+FGF5 siRNA组与OGD/R+FGF5 siRNA组比较,细胞MDA、ROS和LDH含量均明显降低,SOD活性明显升高,差异均有统计学意义(P<0.01)。详见图12、图13。

图12 miR-145-5p inhibitor对OGD/R诱导的LDH、SOD水平的影响
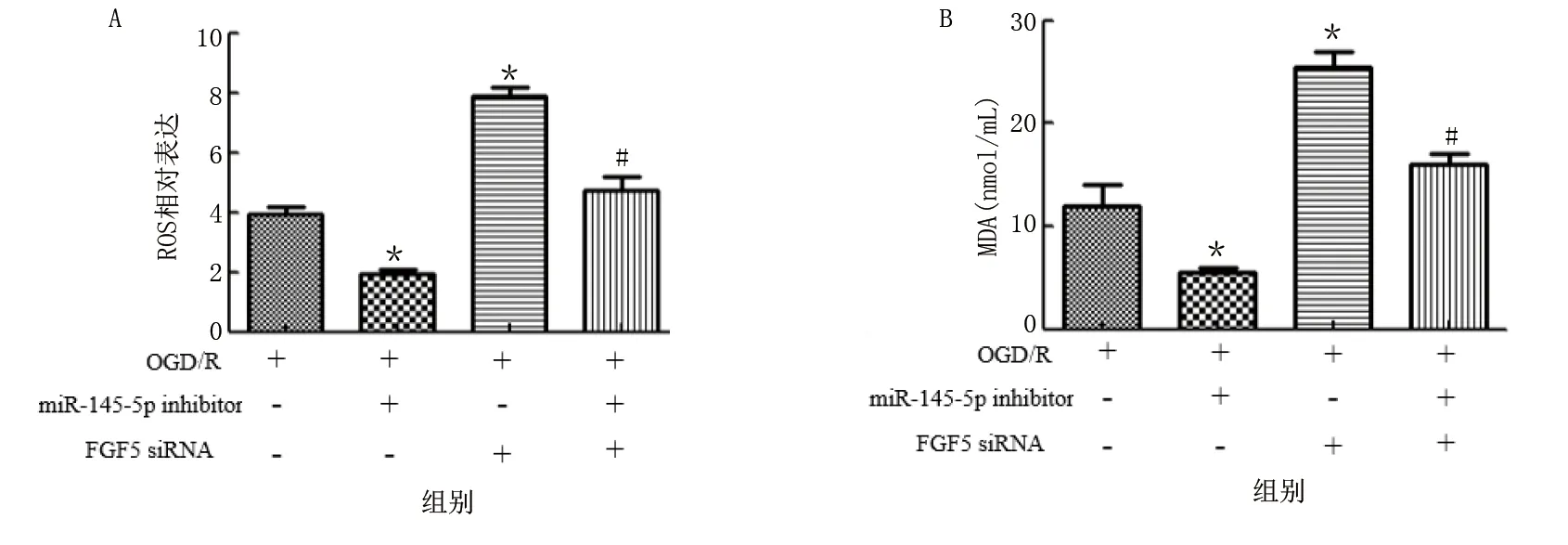
图13 miR-145-5p inhibitor对OGD/R诱导的ROS、MDA水平的影响
3 讨 论
I/R是一个复杂的生理病理过程,涉及多种发病机制,如神经元的死亡、胶质细胞的激活和炎症反应等。miRNA在大脑功能中扮演重要角色,包括神经发生、神经发育、导致突触可塑性发生改变的细胞反应等。研究表明,miR-145-5p在血管内皮细胞损伤、心肌细胞存活及H2O2所致神经元细胞损伤等过程中均明显上调[10-11],小胶质细胞OGD/R处理 2 h后和大脑中动脉栓塞(MCAO)12 h后大脑皮质中miR-145-5p也明显上调。以上研究表明,miR-145-5p可能在OGD/R过程中损伤神经元细胞。本实验结果显示,对HT22细胞进行氧糖剥夺复氧不同时间后,细胞ROS、MDA、LDH含量明显升高,SOD的活性明显降低,提示造模成功。I/R发生后机体氧化和抗氧化能力失衡,发生氧化应激反应并产生大量氧自由基,清除自由基、抑制氧化应激反应是治疗I/R的重要方式之一。本研究结果显示,在I/R细胞模型中,miR-145-5p表达增加,抑制miR-145-5p表达后,细胞氧化应激反应得到缓解。研究表明,氧自由基可诱导产生大量细胞因子,从而刺激脑血管内皮细胞黏附因子的表达,引起再灌注的大量炎症反应,最终导致神经细胞的凋亡和坏死[12]。ROS是高含氧活性小分子,有效清除过剩的ROS可改善缺血性脑卒中转归。SOD是清除氧自由基的蛋白酶,可通过磷酸化蛋白激酶B(AKT)降低缺血脑损伤导致的细胞凋亡[13]。本研究中,神经细胞经氧糖剥夺后复氧,细胞ROS、MDA及细胞上清LDH含量随复氧时间的增加而增加,而SOD活性则随复氧时间的增加而降低。
成熟miRNA通过与靶mRNA的3′-UTR的互补结合调节基因表达,此种调节作用将导致靶mRNA降解或蛋白质翻译抑制,从而使细胞功能发生变化[14]。本研究中I/R损伤细胞miR-145-5p表达升高,并且FGF5受到抑制,通过生物信息学分析及荧光素酶实验证实两者之间具有较强的靶向关系,HT22细胞转染miR-497-5p inhibitor后OGD/R,细胞中氧化应激、炎症反应和细胞凋亡明显减轻,而FGF5 siRNA转染HT22细胞后,细胞氧化应激反应及细胞凋亡增加,提示miR-145-5p靶向FGF5,调节I/R损伤诱导的细胞凋亡和氧化应激损伤。
FGF5属于成纤维细胞生长因子家族(FGFs)成员,在小鼠胚胎和成年小鼠的中枢神经系统及原肠胚、肌肉、运动神经元形成中被检测到[15]。有研究表明,成年小鼠FGF5的信息水平在海马、脊髓和大脑皮层比在其他神经节、小脑、中脑和后脑略高,可视为神经元或神经胶质持续释放的营养因子[16]。FGF5具有多种生物学功能,并发挥重要作用。Walter等[17]研究表明,FGF5及其主要受体FGFR1介导的信号可作为人多形性胶质母细胞瘤的治疗靶点。Fang等[18]研究结果表明,miR-188-5p通过靶向FGF5基因抑制肝癌细胞的增殖和转移,在肝癌中起抑癌作用。此外,FGF5在高血压疾病中也发挥重要作用,FGF5基因内部或附近区域是原发性高血压的易感区域,原发性高血压外周血中FGF5基因T/C突变与舒张压和收缩压呈正相关,提示FGF5 mRNA和蛋白质水平异常表达可能与高血压疾病的发生发展有关[19-20]。本研究结果显示,FGF5在OGD/R诱导的HT122中表达减少,并通过Targetscan证明FGF5是miR-145-5p的下游靶点,此外,miR-145-5p inhibitor转染HT22细胞后,FGF5蛋白表达增加,细胞凋亡和氧化应激损伤均得以改善。而FGF5 siRNA转染HT22细胞后,FGF5蛋白表达减少,氧化应激反应加强。以上结果提示miR-145-5p通过抑制FGF5表达从而增加OGD/R环境下HT22细胞的凋亡和损伤。
综上所述,miR-145-5p可通过靶向结合FGF5诱导HT22细胞凋亡和氧化应激损伤,miR-145-5p可能是I/R的潜在治疗靶点。但本研究仅通过体外细胞培养探讨相关机制,关于miR-145-5p对I/R的作用和影响机制还需进一步深入研究。

