革兰氏阳性细菌致脓毒症患者血清免疫炎性指标水平变化及其对心肌损伤的预测价值
黄雪 程前 杨玉斌
脓毒症属于全身炎症反应综合征的范畴,患者在病原菌等因素的感染下发生功能失调,进而导致机体重要器官功能异常,随着病情不断进展,易引发脓毒症休克等严重并发症,导致临床死亡率增加[1,2]。相关研究[3]报道,尽管临床治疗脓毒症的水平不断提升,但其致死率仍高达30%,其中细菌感染为主要致病因素,若及时给予敏感抗生素治疗,则能在一定程度上提高患者的预后,降低致死率,因此明确细菌类型并采取针对性干预措施对于脓毒症患者的临床治疗至关重要。心脏是脓毒症患者易受累器官,当进展为心肌损伤时会显著增加心功能障碍及病情严重程度,增加患者的病死率[4,5]。脓毒症心肌损伤患者的致病机理较为复杂,其诊断标准尚未统一[6]。已有研究[7,8]表明,炎症反应是反映脓毒症患者发病情况的重要因素,随着血清中相关因子检测手段的不断提升,血清免疫炎性指标检测的准确性随之增加,但不同细菌感染患者免疫炎性指标升高程度是否存在区别,以及与心肌损伤的相关性如何,当前仍缺乏相关报道论证。鉴于此,本研究通过探究革兰氏阳性细菌(G+菌)感染致脓毒症患者血清免疫炎性指标水平的变化,明确该感染类别的血清标志物以及对心肌损伤的预测价值。
1 材料与方法
1.1 一般资料选取2019 年1 月~2022 年12 月我院收治的G+菌感染致脓毒症患者80 例作为G+菌组。纳入标准:①满足相关脓毒症诊断标准[9],且为单一G+菌感染;②年龄>18 岁;③知情许可。排除标准:①伴有严重的凝血功能障碍;②伴有恶性肿瘤;③伴有传染性疾病;④近期服用过影响细胞炎症介质水平的药物。另外选取同期单一革兰氏阴性细菌(G-菌)感染致脓毒症患者80 例作为G-菌组。两组各项基线数据差异无统计学意义(P>0.05)。见表1。本研究经医院伦理委员会批准。

表1 两组患者的一般资料比较
1.2 方法
1.2.1 血清免疫炎性指标检测方法 两组患者均在入院次日进行空腹采血,均静脉取血4mL,对血液样品进行离心以分离血液中的血清,转速设为3 500r/min,取上清液备用。测定血常规,采用流式细胞术检测白细胞(WBC),中性粒细胞百分比(NEU)、红细胞压积(HCT),采用免疫荧光法检测白细胞介素6(IL-6)、C 反应蛋白(CRP)、降钙素原(PCT)、乳酸(Lac)、氨基末端B型脑钠肽前体(NTproBNP),采用化学发光法检测铁蛋白(SF)。
1.2.2 心肌损伤诊断 根据G+菌组患者的心肌损伤程度,将肌钙蛋白I(cTnI)≥0.034ng/mL 的患者纳入心肌损伤组,剩余患者纳入心肌正常组[10]。
1.3 统计学方法研究数据采用SPSS 22.0 软件分析。计量资料以表示,两组间对比采用t检验,采用受试者工作特征(ROC)曲线分析血清免疫炎性指标对心肌损伤的预测价值。P<0.05 为差异有统计学意义。
2 结果
2.1 G+菌组与G-菌组血清免疫炎性指标水平比较G+菌组患者的血清IL-6、CRP 及PCT 水平均低于G-菌组,差异有统计学意义(P<0.05);两组WBC、NEU、HCT、Lac、NT-proBNP 及SF 水平比较差异无统计学意义(P>0.05)。见表2。
表2 G+菌组与G-菌组血清免疫炎性指标水平比较()

表2 G+菌组与G-菌组血清免疫炎性指标水平比较()
2.2 心肌损伤组与心肌正常组血清免疫炎性指标水平比较心肌损伤组患者的血清PCT、Lac、NTproBNP 水平高于心肌正常组,差异有统计学意义(P<0.05),两组WBC、NEU、HCT、IL-6、CRP 及SF水平比较差异无统计学意义(P>0.05)。见表3。
表3 心肌损伤组与心肌正常组血清免疫炎性指标水平的比较()

表3 心肌损伤组与心肌正常组血清免疫炎性指标水平的比较()
2.3 血清PCT、Lac、NT-proBNP 及三者联合预测心肌损伤的价值绘制ROC 曲线,结果显示:血清PCT 预测心肌损伤的最佳截断值为5.155ng/mL,Lac最佳截断值为5.490mmol/L,NT-proBNP 最佳截断值为6.395ng/mL,对脓毒症患者心肌损伤均具有一定程度的预测价值。三项指标联合(采用并联的方式)预测脓毒症患者心肌损伤的AUC 及敏感度均高于单一指标诊断(P<0.05)。见表4、图1。

图1 血清PCT、Lac、NT-proBNP 及三者联合预测心肌损伤的ROC 曲线
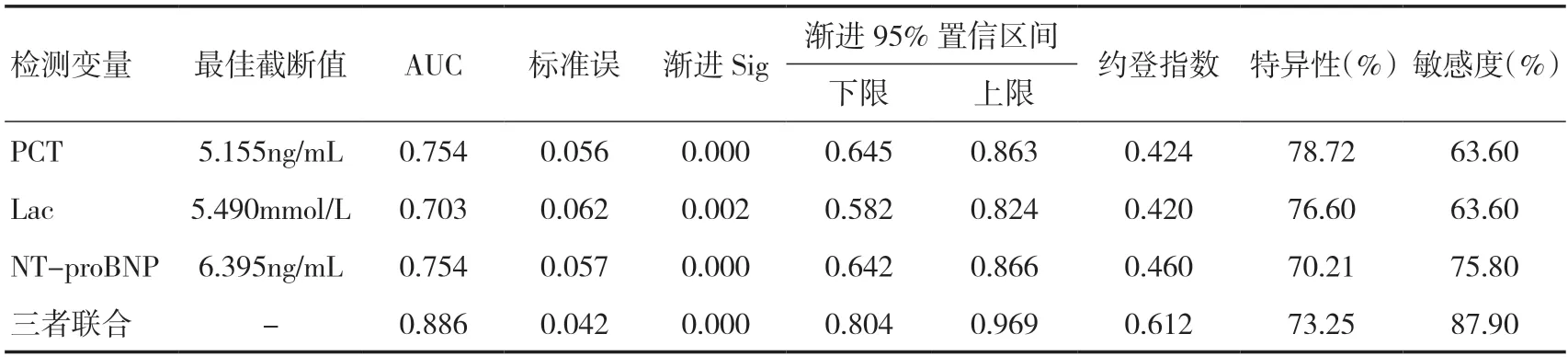
表4 血清PCT、Lac、NT-proBNP 及三者联合预测心肌损伤的效能分析
3 讨论
脓毒症患者感染后,其机体内的免疫细胞在炎症因子的作用下被过度激活,使内环境稳态受到破坏,当抗炎与促炎反应紊乱失衡时,会导致免疫系统紊乱,重要器官衰竭,甚至死亡[11]。临床对于脓毒症患者常采用广谱抗生素治疗,但不合理用药会导致病菌的耐药率增加,从而加大临床治疗难度[12]。G+菌与G-菌的微生物组成存在差异,其免疫细胞表面存在不同的表型,相关研究表明,寻找血清标志物鉴别G+菌与G-菌对于临床治疗脓毒症患者意义重大[13]。目前关于血清标志物区分G+菌与G-菌感染致脓毒症的研究尚未得出一致性结论。胡珊博等[14]研究结果显示,G-菌感染致脓毒症患者的血清IL-6 水平高于G+菌感染。闫圣涛等[15]则发现血清PCT 鉴别G+菌与G-菌感染致脓毒症的临床价值较高,其曲线下面积超过0.8。但也有相关研究[8]发现,G+菌与G-菌感染致脓毒症患者的血清PCT 水平差异无统计学意义。
本研究结果显示,G+菌组患者的血清IL-6、CRP 及PCT 水平低于G-菌组(P<0.05),两组WBC、NEU、HCT、Lac、NT-proBNP 及SF 水平比较差异无统计学意义(P>0.05),提示与G-菌感染致脓毒症患者相比,G+菌的血清IL-6、CRP 及PCT 水平更低,与上述研究的部分结论一致,均证实IL-6 及PCT 对于鉴别G+菌与G-菌感染具有一定的价值。血清IL-6 具有调控机体细胞生长与分化的功能,在抗感染等免疫反应中发挥重要作用[16]。对于感染不同病原菌的脓毒症患者,由于G+菌与G-菌感染时机体内应答的免疫机制不同,使得表达的细胞因子水平存在较大差异,而血清IL-6 水平主要取决于Toll 样受体4 的激活程度,对于G-菌的脂多糖,G+菌无法表达,无法激活Toll 样受体4,因此G+菌感染患者机体的血清IL-6 水平更低。CRP 是人体处于急性反应期的一类应激蛋白,当机体内炎症反应出现时,其水平会在短时间内明显增加。邓超等[17]研究显示,G+菌与G-菌感染致脓毒症患者的血清CRP 水平差异有统计学意义,与本研究结果具有一致性。当患者受到细菌感染时,机体内的巨噬细胞、内分泌细胞以及淋巴细胞等会促进血清PCT 的表达,而G-菌具有脂多糖成分的细胞壁能够在细胞自溶时释放内毒素,从而进一步刺激PCT 的生成与释放,导致血清PCT 在G-菌组水平更高。
既往研究[18,19]表明,心肌损伤是脓毒症患者的严重并发症之一,会增加临床治疗难度,其发生与患者机体的炎症反应、心室张力情况改变以及氧化应激等因素密切相关。采用科学方法评估脓毒症患者心肌损伤的发生风险,并采取针对性措施,可显著改善患者的预后。本研究结果显示,心肌损伤组患者的血清PCT、Lac、NT-proBNP 水平显著高于心肌正常组(P<0.05),提示PCT、Lac、NT-proBNP水平对脓毒症患者的病情转归影响显著。主要原因在于心肌损伤患者的心肌细胞发生坏死时,其炎症反应程度显著高于心肌正常患者,使得PCT 表达水平更高,NT-proBNP 水平的增加则与心肌损伤患者心脏负荷增加以及高动力循环状态密切相关。另外在大量炎性因子及内毒素的共同作用下,NTproBNP 水平显著增加,造成患者心肌抑制与心脏功能异常。心肌损伤患者的组织处于缺氧、低灌注水平,使代谢过程受限,同时刺激酵解途径,促进丙酮酸转化成Lac 的无氧代谢过程,因此心肌损伤组的血清Lac 水平更高。另外ROC 曲线显示血清PCT预测心肌损伤的最佳截断值为5.155ng/mL,Lac 最佳截断值为5.490mmol/L,NT-proBNP 最佳截断值为6.395ng/mL,对G+菌感染致脓毒症患者心肌损伤均具有一定的预测价值。三项指标联合(采用并联的方式)预测脓毒症患者心肌损伤的AUC 及敏感度均高于单一指标诊断(P<0.05),提示血清PCT、Lac 联合NT-proBNP 可互为补充,发挥协同作用,增加对心肌损伤的预测价值,建议临床密切监测上述指标变化,及时给予针对性处理,以改善患者预后。本研究局限性在于样本量较少,且来源单一,有待后续大样本量试验对相关结论进一步论证,且G-菌感染致脓毒症患者心肌损伤情况亦有待分析研究。
综上所述,与G-菌感染致脓毒症患者相比,G+菌感染的血清IL-6、CRP 及PCT 水平更低,另外G+菌所致脓毒症心肌损伤患者的血清PCT、Lac、NTproBNP 水平高于心肌正常患者,可作为预测心肌损伤的预测指标,另外血清PCT、Lac 联合NTproBNP 对心肌损伤具有较高的预测价值,建议临床密切监测。

