婴幼儿伴多层菊形团胚胎性肿瘤五例
陈希文 吴慧莹 朱敏 林锦荣 曹亚先 杨鉴宏
伴多层菊形团胚胎性肿瘤(embryonal tumor with multilayered rosettes,ETMR)是一种主要以19 号染色体q13.42 位点(C19MC 区域)基因扩增为分子生物学特征的罕见儿童中枢神经系统肿瘤[1,2]。ETMR 恶性程度高,27%患儿首诊时发生转移,2 年和4 年总体生存率仅为29%和27%[1]。为更好认识本病及提高影像诊断水平,报道我院确诊的5 例ETMR患儿病例。
1 病例资料
5 例ETMR 患儿临床一般资料见表1,影像表现与病理结果见表2。本回顾性研究经广州市妇女儿童医疗中心伦理委员会批准(批准号:2023 第029A01 号),免除受试者知情同意。

表1 ETMR 患儿临床一般资料

表2 ETMR 患儿影像表现与病理结果

图2 病例4,鞍上池实性ETMR 伴双侧桥小脑角池、枕大池转移。a)~d)颅脑MRI轴位示鞍上池实性占位,T1WI 等信号,T2WI 等、稍 高信 号,DWI 高信号,ADC 低信号;e)增强轴位示无强化为主伴局部轻度强化;f)、g)T2WI 轴位示双侧桥小脑角池、枕大池转移瘤(箭);h)颅脑CT 平扫轴位示鞍上池等密度占位,边界清晰,CT值约20~40 HU;i)颅脑CT增强轴位示病变轻度强化;j)镜下示肿瘤细胞排列密集,其间见多层菊形团结构(HE×40)。
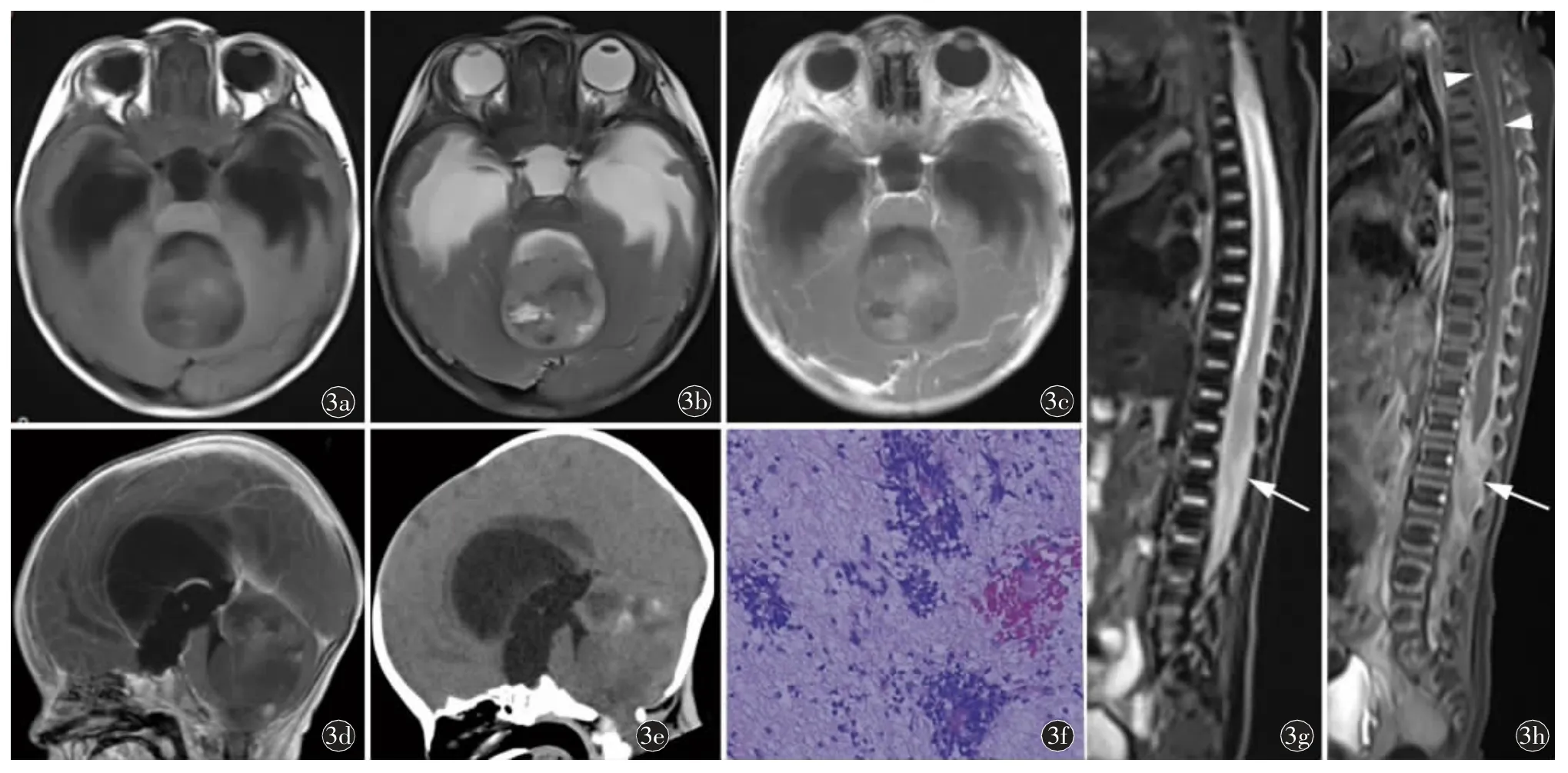
图3 病例5,小脑蚓部囊实性ETMR。a)、b)颅脑MRI 轴位示小脑蚓部囊实性ETMR,边界清晰,实性部分T1WI 呈等、稍低信号伴斑片状稍高信号,T2WI 以稍高信号为主伴斑片状稍低信号;囊性部分T1WI 低信号,T2WI 高信号;c)增强轴位、d)增强矢状位示肿瘤实性部分轻-中度强化,囊性部分无强化;e)颅脑CT 平扫矢状位重组示小脑蚓部囊实性占位,实性部分以等密度为主,伴出血和点状钙化;f)镜下示肿瘤细胞以神经胶质为背景疏密不均,呈弥漫成片或多层菊形团结构(HE×100);g)术后1 个月脊柱T2WI 矢状位压脂示胸12 椎体及以下水平椎管内稍高信号影,脊髓圆锥、马尾神经显示不清(箭);h)全脊柱T1WI 矢状位增强示病变明显不均匀强化(箭),脊膜广泛增厚强化(箭头)。
2 讨论
2016 年WHO 中枢神经系统肿瘤分类(修订版第四版)首次将ETMR 归为独立实体肿瘤,根据FISH 检测是否出现C19MC 位点扩增分为C19MC 变异型非特殊(not otherwise specified,NOS)型及髓上皮瘤[2]。基于大部分ETMR 具有特异性基因亚型[3],2021 年WHO 中枢神经系统肿瘤分类(第五版)增加DICER1 变异型[4]。ETMR以女性多见,确诊中位年龄为26 个月,然而性别与发病年龄在C19MC 变异型和NOS 型并无差异[1],临床症状与肿瘤发生部位、累及范围有关,多表现为颅内压升高、脑积水以及局部神经功能障碍[5]。本组仅1 例为女性,ETMR 属WHO IV 级,易发生早期转移与肿瘤复发,预后差[1]。病例4 首诊时发现颅内多发转移灶且术后3 个月离世,病例3 外院脑肿瘤切除术后2 个月出现复发。病例5 脑肿瘤切除术后1 个月发现椎管、脊膜转移,由于术前未行全脊柱MRI 检查,不能排除该患儿术前已发生转移可能。因此笔者认为术前辅以全脊柱MRI 检查对发现非颅内转移病变,正确制定治疗方案有积极意义。
ETMR 镜下以多层原始未分化细胞围绕血管腔呈放射状排列分布形成多层细胞菊形团为特征[3,6]。分子生物学检测是诊断本病关键。C19MC 位点扩增是ETMR 的分子生物学标志物,超过90%的ETMR 患儿存在C19MC 位点扩增[3,6]。除FISH 外,单核苷酸多态性阵列、下一代测序等检测方式亦对本病诊断提供帮助[1,3]。LIN28A 在诊断ETMR方面具有高度敏感性与特异性,被视为另一分子生物学特征[3]。研究发现部分ETMR 患者13 号染色体上存在miR-17-92(MIR17HG)位点扩增和DICER 突变[3]。免疫组织化学显示细胞分化区及神经毡表达Syn 等神经元标志物,神经上皮干细胞标志物Nestin 和Vimentin 在细胞密集区及多层细胞菊形团呈阳性表达[6-8]。未分化细胞和菊形团区域Ki-67 指数高表达,提示细胞增殖活跃,易发生转移复发,提示预后不良[1,6]。本组5 例ETMR 镜下示多层肿瘤细胞围绕血管排列成假菊形团结构,2 例经FISH 检测确诊为C19MC 变异型,3 例免疫组织化学提示LIN28A(+)。
影像特点:1)以额顶叶皮层多见,可跨脑叶生长[9,10]。2)体积大,平均直径达6 cm,占位效应明显,可推压或阻塞脑室系统继发脑脊液循环障碍[9,10]。3)分为囊实性或实性,根据囊实比例不同前者分为囊性优势型和实性优势型,肿瘤的实性部分T1WI 呈等、稍低信号,T2WI 呈等、稍高或混杂信号,CT 平扫以等、稍低密度为主,囊性部分的信号密度差异与成分相关[9-13]。4)常伴钙化[9],本组1 例CT 检查发现瘤内点状钙化。5)瘤内流空血管影可能对本病的诊断具有意义[9,12],本组1 例瘤体可见血管流空信号。6)增强扫描病变表现为不强化或轻-中度强化[9-13],本组2例实性ETMR表现为无强化为主伴局部轻度强化,无强化区可能与正常脑组织相似的大量神经毡成分相关[8],3 例囊实性ETMR 表现为轻-中度强化,可能与不同比例细胞构成区及血管重构有关[14]。7)本组3 例脑内ETMR 边界清晰且不伴瘤周水肿,易掩盖高度恶性的生物学特性,实性部分DWI 高信号、ADC 低信号提示细胞核浆比高,为低分化生物学特性提供有力实证,亦为影像医生诊断ETMR开拓思路[9-11]。8)肿瘤可侵犯邻近硬脑膜[15],本组2 例经手术证实侵犯邻近硬脑膜,与影像改变相符。
鉴别诊断:ETMR 的鉴别诊断因肿瘤发生部位与性质不同存在差异,结合本组病例需与以下疾病相鉴别:1)幕下非中线髓母细胞瘤:多发生于青年,ETMR 主要为婴幼儿,瘤周水肿和强化程度较ETMR 明显[16];2)鞍区生殖细胞瘤:多见于10~12 岁儿童,发病年龄较ETMR 偏大,临床主要表现为尿崩症,钙化较ETMR 少见,强化程度较ETMR明显[17];3)非典型畸胎样/横纹肌样瘤:发病年龄、性别与ETMR 相似,幕上与幕下发生率大致相等,表现囊实性占位,增强方式以环形波浪带样强化为特征,而ETMR 可为囊实性或实性,强化程度较非典型畸胎样/横纹肌样瘤低[18]。
综上所述,婴幼儿ETMR 具有一定影像特征,部分“良性”肿瘤影像表现易掩盖恶性生物学增强特征,需引起影像诊断医生的重视。术前辅以全脊柱MRI 增强检查对发现非颅内转移病变,正确制定治疗方案有积极意义。分子遗传基因筛查和病理组织学检查对明确诊断具有重要作用。