TACE 联合卡瑞利珠单抗及酪氨酸激酶抑制剂治疗晚期肝细胞癌的疗效分析
熊柏柱 侯昌龙 吴昱霖 许军 周磊 费一鹏 谢韬
肝细胞癌(hepatocellular carcinoma,HCC)是世界范围内最常见的恶性肿瘤之一[1],多数的HCC患者发现时已经处于晚期阶段,失去了手术的最佳机会[2,3]。经动脉化疗栓塞(transarterial chemoembolization,TACE)是中国肝癌分期(China live cancer staging,CNLC)Ⅰb~Ⅲb 期肝癌的推荐疗法[4],但是TACE 的疗效会因为手术次数而下降[5],对于一些肿瘤负荷较重的患者,TACE 治疗的益处也显著下降[6]。TACE 作为中晚期肝癌的主要治疗手段,能否通过联合治疗,增强TACE 的效果是亟待解决的问题。TACE 对肿瘤造成的缺血性和细胞毒性损伤有助于激发针对肿瘤相关抗原的T 细胞反应并上调程序性死亡受体1(programmed death-1,PD-1)的表达[7],这可能有利于免疫检查点抑制剂发挥抗肿瘤免疫反应。另一方面TACE 阻断肿瘤血供引起的局部缺氧会促进血管内皮生长因子(vascular endothelial growth factors,VEGF)表达,从而导致新生血管的形成,可能会引起肿瘤复发或转移,而与索拉非尼或仑伐替尼等具有抗增殖和抗血管生成活性的多激酶抑制剂的联合应用被认为可有效地逆转TACE 缺氧诱导的血管生成[8]。既往研究表明,TACE 治疗后联合系统治疗的效果优于单独TACE 或系统治疗[9]。但是缺乏TACE 联合卡瑞利珠单抗(camrelizumab)和酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)对比TACE 联合卡瑞利珠单抗的研究,本研究回顾性分析TACE 和卡瑞利珠单抗联合TKIs 治疗晚期HCC 的临床数据,并与TACE 联合卡瑞利珠单抗治疗晚期HCC 进行对比分析。
1 资料与方法
1.1 一般资料
回顾性分析2019 年3 月—2021 年6 月于中国科学技术大学第一附属医院接受TACE 联合卡瑞利珠单抗和TKIs 治疗(TACE+C+T)或TACE 联合卡瑞利珠单抗(TACE+C)治疗的40 例晚期HCC 患者。纳入标准:1)临床诊断分期为CNLC Ⅲa~Ⅲb 的HCC(具有典型HCC 影像学特征,即增强CT/MRI 为“快进快出”的强化方式,或穿刺活检证明为HCC[4]);2)美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分为0 或1;3)Child-Pugh A 级或B 级;4)未接受治疗、对先前的治疗已进展或不耐受,并至少有一个可测量的病变,由修改后的实体瘤反应评估标准(modified Response Evaluation Criteria in Solid Tumours,mRECIST)定义。排除标准:1)病理证实合并其他恶性肿瘤或有恶性肿瘤病史的患者;2)联合治疗期间进展前接受其他治疗的患者,如放疗或肝切除术;3)随访期间影像学或实验室检查资料缺失;4)随访时间小于12 周。
1.2 治疗方案
TACE 过程如下:采用改良Seldinger 技术行股动脉穿刺并置入导管鞘,随后将导管插入肿瘤供血动脉,行DSA 明确病灶后,于肿瘤供血动脉注入奥沙利铂(100~200 mg),再注入盐酸表柔比星(10~40 mg)与罂粟乙碘油(10~20 mL,江苏恒瑞医药)制成的乳化剂适量进行肿瘤栓塞,最后使用明胶海绵颗粒(杭州艾力康医药)适量加强栓塞,直到DSA 造影肿瘤染色消失。
系统治疗在TACE 术后3 d 内进行,卡瑞利珠单抗(江苏恒瑞医药)以200 mg的剂量静脉注射每3 周一次。TACE+C+T 组使用TKIs 口服的初始日剂量为索拉非尼800 mg(拜耳医药),阿帕替尼500 mg(江苏恒瑞医药)或仑伐替尼12 mg(南京正大天晴制药)。联合治疗后每8~12 周进行一次增强CT 或MRI,根据疗效评估决定是否继续接受原方案治疗。
1.3 随访和疗效评估
随访时间截止至2022 年12 月31 日。在治疗前、初始治疗后8 周和之后每8~12 周进行一次增强CT 或MRI。根据mRECIST,与治疗前相比,所有靶病灶均未见动脉期增强,则完全缓解(complete response,CR);靶病灶增强扫描动脉期的直径之和减少超过30%,则部分缓解(partial response,PR);靶病灶增强扫描动脉期的直径之和减少小于30%或增加小于20%,则疾病稳定(stable disease,SD);靶病灶增强扫描动脉期的直径之和增加超过20%,或出现新发病灶,则疾病进展(progressive disease,PD)。客观缓解率(objective response rate,ORR)计算为(CR+PR)/病例总数×100%。疾病控制率(disease control rate,DCR)计算为(CR+PR+SD)/病例总数×100%。不良事件(adverse events,AEs)根据不良事件通用术语标准(CommonTerminology Criteria for Adverse Events,CTCAE)5.0 版本进行评估。无进展生存期(progression-free survival,PFS)定义为从首次联合治疗开始到疾病进展或死亡的时间。总生存期(overall survival,OS)为首次联合治疗开始到患者死亡或随访截止时间。本研究的主要研究终点为OS,次要研究终点为PFS、ORR、DCR和不良反应。
1.4 统计分析
使用SPSS 20.0 进行统计学分析。符合正态分布的计量资料采用均数±标准差()表示,并用独立的t 检验或Mann-Whitney U 检验进行比较,计数资料以例数或百分率表示,组间比较采用卡方检验或Fisher 精确检验,使用Kaplan-Meier 分析绘制了两组的生存曲线。所有统计检验均为双尾,P<0.05 具有统计学意义。
2 结果
2.1 患者特征
两组在人口统计学、临床和肿瘤特征方面无差异(表1)。其中TACE+C+T 组中,TKIs 的使用情况为阿帕替尼13 例、索拉非尼5 例、仑伐替尼2例。TACE+C+T 组患者的TKIs 治疗的中位时间为7.3 个月(1.5~17.3 个月),卡瑞利珠单抗治疗的中位时间为7 个周期(2~17 周期)。TACE+C 组卡瑞利珠单抗治疗的中位时间为6 个周期(3~13 周期)。

表1 两组患者基线临床资料比较(n)
2.2 两组生存情况的比较
患者的中位PFS,TACE+C+T 组明显长于TACE+C 组[11.2(95%CI:9.1~13.2)个月比4.7(95%CI:3.1~6.3)个月,P<0.001,图1a]。TACE+C+T 组的中位OS 明显高于TACE+C 组[17.8(95%CI:13.8~21.7)比12.8(95%CI:8.9~16.7)个月,P=0.039,图1b]。
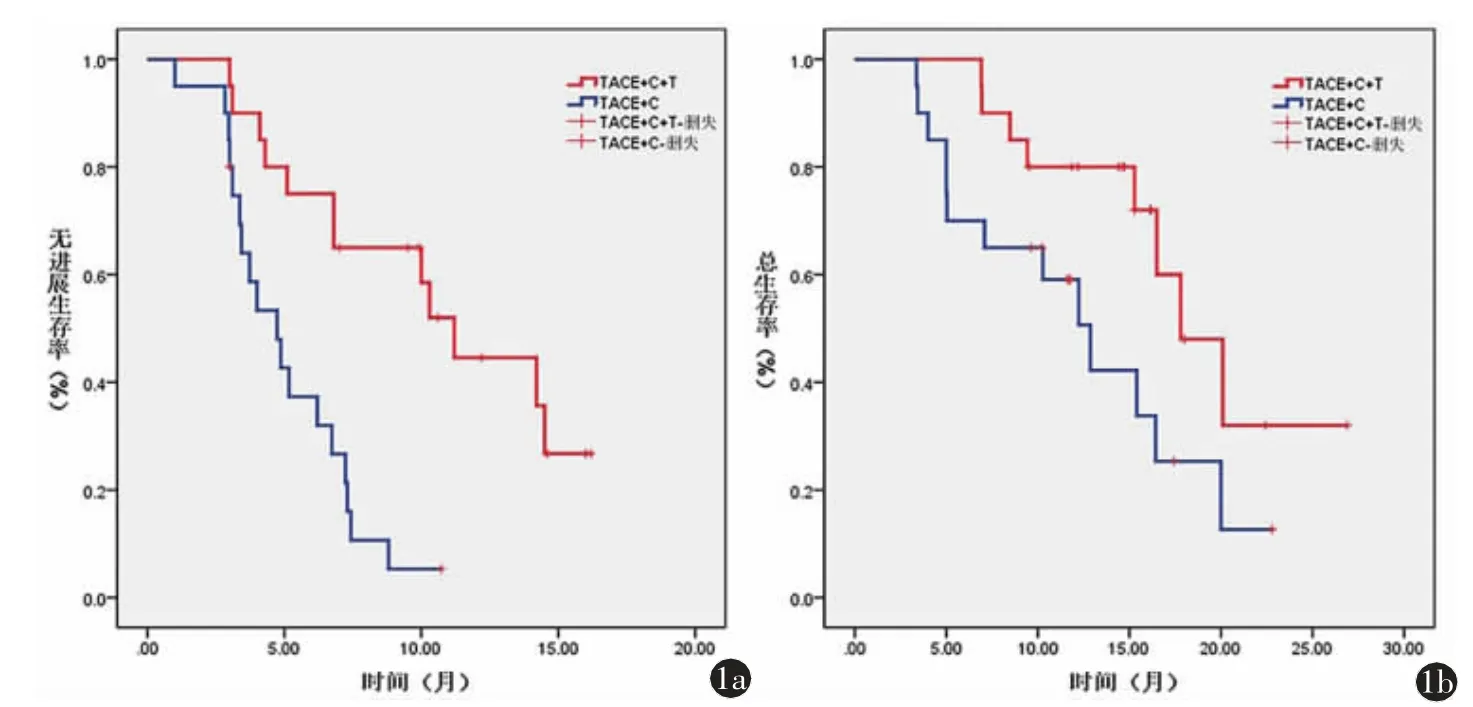
图1 TACE+C+T 组和TACE+C 组的Kaplan-Meier 生存曲线。a)无进展生存期;b)总生存期。
2.3 两组疗效的对比
所有患者在首次联合治疗后8 周评估肿瘤治疗反应。TACE+C+T 组PR 12 例、SD 6 例、PD 2例。TACE+C 组PR 5 例、SD 9 例、PD 6 例。TACE+C+T 组的ORR 高于TACE+C 组(60.0%比25.0%,P=0.025),两组DCR 之间无统计学差异(90.0%比70.0%,P=0.235)。
2.4 两组不良反应发生情况
根据CTCAE 5.0 版,主要依据频率和严重程度等级来评估治疗期间发生的AEs。如表2 所示,两组中最常见的不良事件是淋巴细胞减少、血小板减少、高血压。两组之间各不良反应发生率无统计学差异(P>0.05),唯一的Ⅳ级不良反应为淋巴细胞减少,发生在TACE+C 组,患者在停药并对症治疗后缓解。本研究中没有发生与毒性有关的死亡。
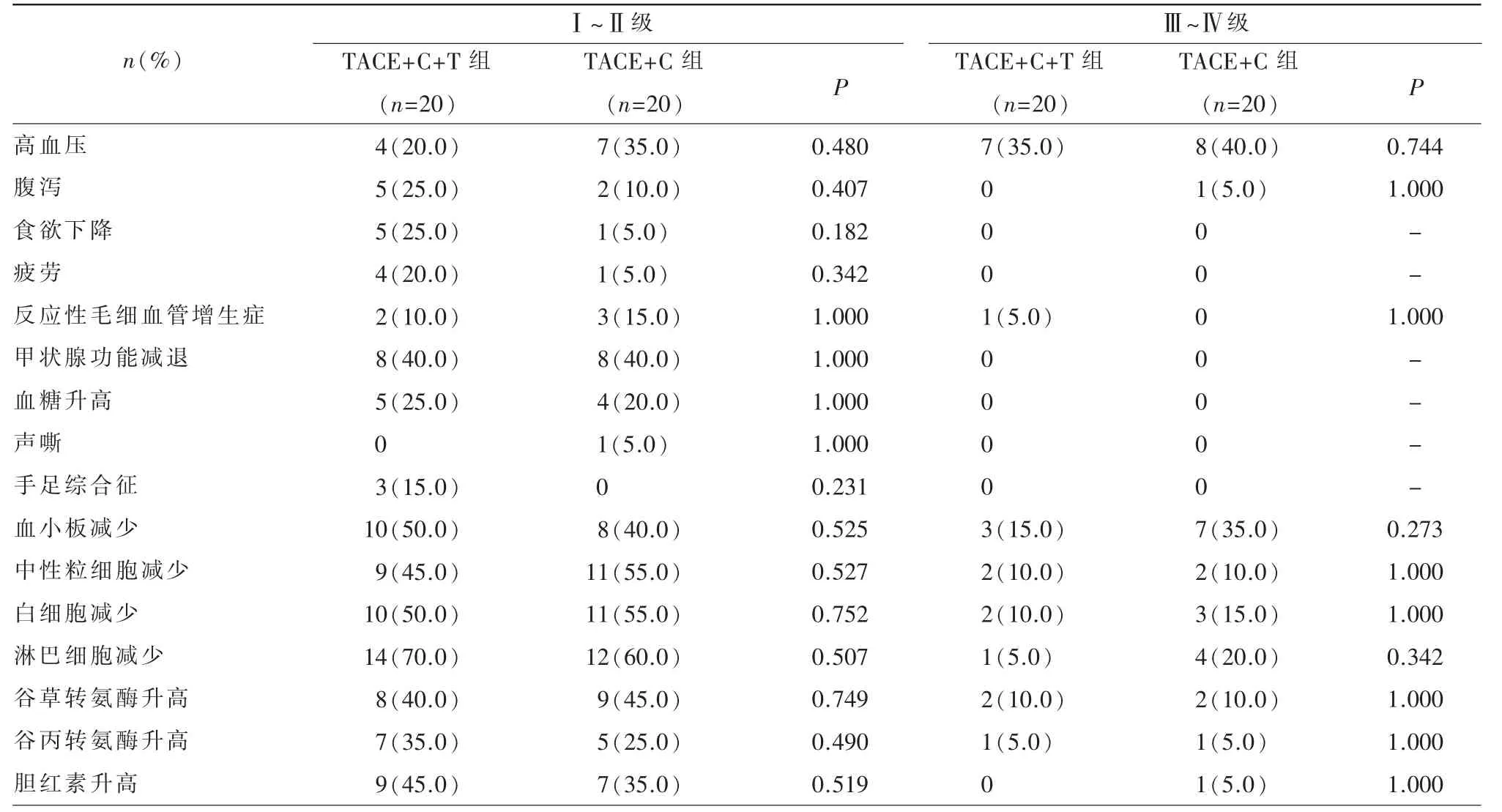
表2 两组治疗相关不良事件[例(%)]
3 讨论
本研究评估了TACE+C+T 联合治疗晚期HCC的疗效和安全性,并与TACE+C 方案进行对比。结果显示,TACE 联合卡瑞利珠和TKIs 治疗可以获得更长的PFS 和OS,这与Liu 等[10]研究相似,在其结论中TACE 联合仑伐替尼和卡瑞利珠治疗不可切除的HCC 的中位OS 和PFS 分别为24 个月和11.4 个月。此外,TACE+C+T 组在治疗后首次评估也显示出更好的ORR(60.0%比25.0%,P=0.025)。Qu 等[11]对110 例不可切除HCC 进行对比分析,其中56 例接受TACE 联合仑伐替尼和PD-1 单抗治疗,54 例仅接受TACE 治疗,结果联合组的ORR 高于TACE 组(67.9%比29.6%,P<0.001)。在一项多中心研究中[12],TACE 联合卡瑞利珠单抗和阿帕替尼联合方案治疗HCC 在中位OS、PFS 和ORR 显著高于单独TACE 治疗组[中位OS:(24.1比15.7)个月,P=0.008;中位PFS:(13.5 比7.7)个月,P=0.003;ORR:59.5%(50/84)比37.4%(55/147),P=0.002]。在本研究中,TACE 联合卡瑞利珠和TKIs组合的ORR 为60.0%,与上述研究相似。另一方面,当肿瘤直径较大时,TACE 的效果也会降低[13],在TACE 的基础上联合系统治疗也会更好地控制肿瘤(图2~5)。因此,相较于单一的疗法,TACE联合系统治疗可能是晚期HCC 有希望的方向之一。

图2~5 女,34 岁,原发性肝癌伴多发肺转移,治疗方案为TACE 联合卡瑞利珠单抗和仑伐替尼,治疗期间持续口服仑伐替尼12 mg,卡瑞利珠单抗以每3 周一次200 mg,共14 周期。图2 a)CT 增强动脉期示肝右叶巨块型肝癌;b)CT 平扫示右肺下叶结节状高密度影,结合病史考虑肺转移。图3 首次TACE。a)肝右叶见块状肿瘤染色,肝右动脉分支参与供血;b)右肾上极动脉和右肾包膜动脉参与肿瘤供血;c)、d)分别栓塞后,碘油沉积良好,肿瘤染色消失。图4 联合治疗1 个月CT。a)CT 增强动脉期示肝右叶病灶内可见斑片状碘油沉积,中央见片状坏死区域,周边见部分强化,病灶范围整体缩小;b)CT 平扫示右肺下叶结节状高密度影,较前明显缩小。图5 治疗约14 个月CT,肝内病灶控制稳定,右侧结肠旁沟区及腹膜后多发转移,评估进展。a)CT 平扫肝脏右叶增大变形,见巨大混杂密度肿块影;b)CT 增强动脉期,病灶边缘实性成分不均匀强化;c)CT 增强动脉期,右侧结肠旁沟区见软组织影,轻度强化;d)CT 增强动脉期,腹膜后多发软组织影,轻度强化。
笔者分析这种疗效的差异与TACE 治疗后肿瘤微环境的改变有关。首先,TACE 栓塞肿瘤供血动脉引起肿瘤坏死降低肿瘤负荷[14,15]。其次是本研究纳入的多为乙型肝炎患者,乙型肝炎患者的T 细胞功能失调会使肿瘤微环境处于免疫抑制状态[16],而TACE 可通过产生更合适T 细胞防御的炎性环境改善这种免疫抑制状态,有利于肿瘤免疫治疗[17]。第三,面对免疫治疗,癌细胞会采取各种策略改变或者终止抗肿瘤免疫即“免疫规避机制”,从而降低免疫治疗的疗效[18],研究证明VEGF在逃避抗肿瘤免疫中起到关键作用[19],靶向VEGF/VEGFR 轴的药物可以帮助建立免疫支持性肿瘤微环境并提高肿瘤免疫力[20],同时改善肿瘤血管功能使血管正常化减轻免疫抑制[21]。由TACE 产生更具炎症性的肿瘤微环境,联合卡瑞利珠单抗免疫治疗及TKIs 提高肿瘤免疫力和增强免疫治疗抗肿瘤作用的反馈闭环形成。本研究结果也证明,TACE 联合卡瑞利珠单抗和TKIs 的协同抗肿瘤作用要优于TACE 联合卡瑞利珠单抗。
最后,TACE+C+T 或TACE+C 的联合应用在安全性方面也是可以接受的,没有观察到新的或致死的不良事件。两组中最常见的不良事件是淋巴细胞减少、血小板减少、高血压。在整个研究过程中,唯一的Ⅳ级不良反应发生在TACE+C 组。值得注意的是本研究中反应性毛细血管增生症的发病率低于既往研究[22-24],经分析可能是本研究的TACE+C+T 组中选择了更多的卡瑞利珠单抗联合阿帕替尼的组合(13/20,65.0%),研究证明这种组合模式可以显著降低反应性毛细血管增生症的发生率[25]。总体而言,患者不良反应是可以耐受的。
本研究也有一些局限性。首先,样本量较小,而且是一项回顾性研究,提示可能存在选择偏差。第二,随访时间较短,需要更长的随访时间来验证生存时间。未来需要进行前瞻性、多中心、随机对照的临床试验来评估三联疗法的疗效。
综上所述,TACE 联合卡瑞利珠单抗和酪氨酸激酶抑制剂治疗晚期HCC 患者效果优异且安全性可控,与TACE 联合卡瑞利珠单抗的治疗方案相比,患者的治疗反映更好,生存时间延长,值得进一步推广。