PARP-1/PI3K双靶点抑制剂的设计、合成与生物活性
黄至诚,叶 柳,杜 宇,古宏峰,高凡云,朱启华,徐云根
(中国药科大学药物化学系,南京 210009)
聚腺苷酸二磷酸核糖聚合酶-1(poly ADPribose polymerase-1,PARP-1)抑制剂通过其特殊的合成致死机制发挥抗肿瘤作用[1],但在临床上主要用于治疗乳腺癌易感基因1/2(breast cancer susceptibility gene 1/2,BRCA1/2)突变或缺失的肿瘤,适应证有限;此外,临床研究证明,由于BRCA1/2 的二次突变导致同源重组修复途径恢复[2-4],从而对PARP-1 抑制剂产生耐药性,这进一步限制了PARP-1 抑制剂的临床应用。因此,拓展PARP-1抑制剂的适应证以及克服耐药性问题迫在眉睫[5]。PI3K 信号通路在多种肿瘤细胞中均被激活,广泛参与细胞的生长、存活、迁移等生命周期活动[6-8]。研究表明,抑制PI3K 信号通路会导致细胞内单链损伤增加,同时还会下调BRCA1/2 的表达,进而抑制同源重组修复途径,使肿瘤细胞对PARP-1 抑制剂的敏感性增加[9-10]。目前已经展开了数项PARP-1 抑制剂和PI3K 抑制剂联合用于治疗肿瘤的试验且已经取得较好的进展[11-12]。
虽然药物联用可以达到协同增效的目的,但药物联用存在自身的局限性,比如更加复杂的药物代谢特性、更强的不良反应等[13-14]。与之相比,双靶点抑制剂不但可以作用于多个病理环节而发挥协同作用,还可以避免药物与药物之间相互作用引发的安全性问题。因此,开发PARP-1/PI3K双靶点抑制剂对于克服PARP-1 抑制剂的耐药性、扩展PARP-1 抑制剂的适应证以及降低由于药物联用产生的不确定性具有重大的现实意义。课题组前期得到了多个对PARP-1/PI3K 抑制活性优异的化合物[15-17],但存在水溶性较差的问题。本研究在课题组已有的研究基础上,以成药性为导向,以化合物XW-1 和WZ-1 为先导化合物,通过引入脲基团,构造成盐位点以提高化合物的水溶性,设计并合成了11 个目标化合物,并对其进行PAPR-1 和PI3K 酶抑制活性和多种肿瘤细胞抗增殖活性测试,具体的设计策略见图1。
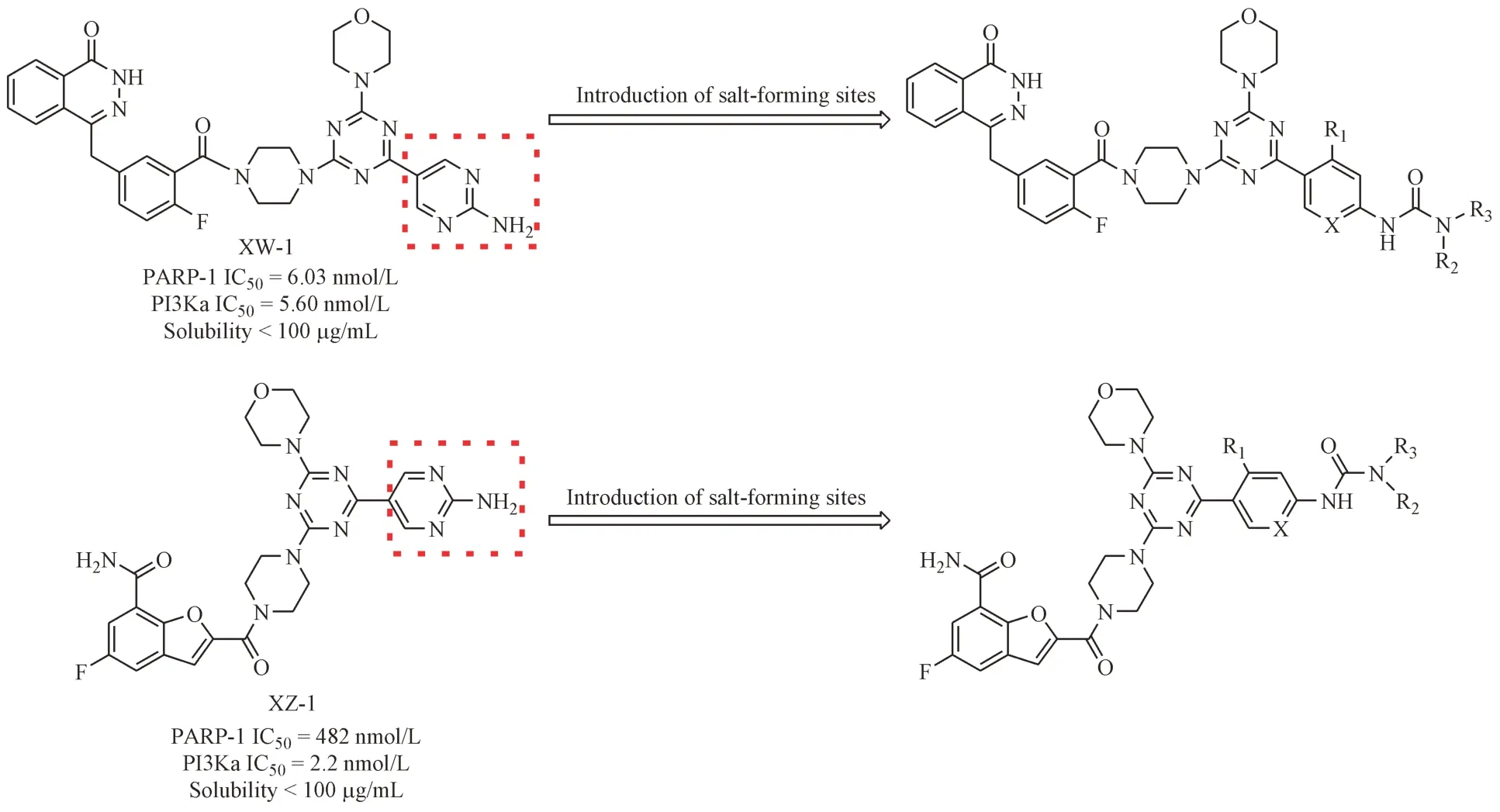
Figure 1 Design strategy of target compounds
1 合成路线
以化合物1[15]和2[15]为原料,通过缩合反应得到中间体3,再分别与4-氨基苯硼酸频哪醇酯(4a)、2-氨基吡啶-5-硼酸频哪醇酯(4b)或2-氨基-4-三氟甲基吡啶-5-硼酸频哪醇酯(4c)发生Suzuki反应得到关键中间体5a ~ 5c。再与氯甲酸苯酯反应生成中间体6a ~ 6c,最后与不同的胺(7a ~ 7d)反应生成目标化合物8a ~ 8f。合成路线见图2。
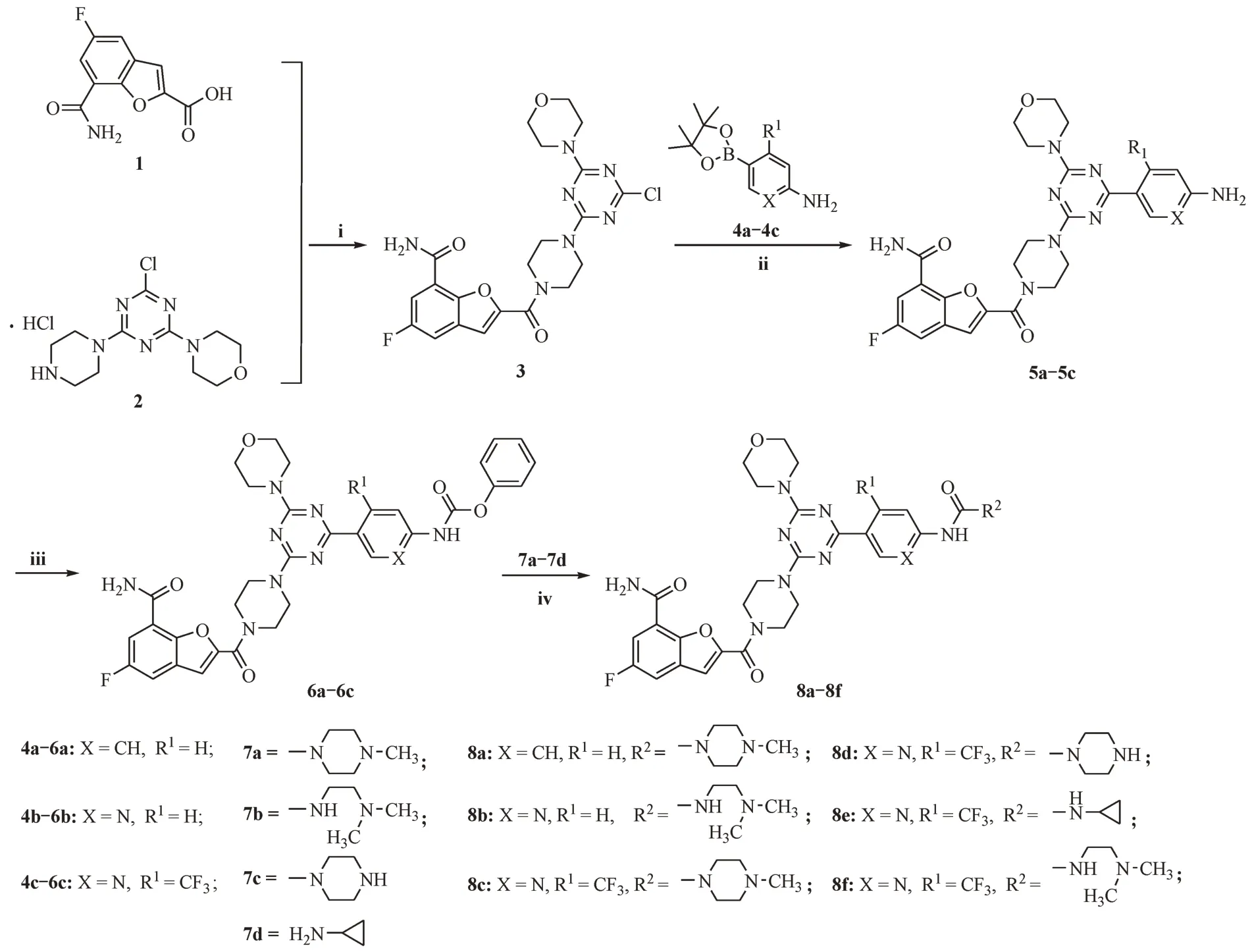
Figure 2 Synthetic routes of compounds 8a-8f
以化合物2 和9 为原料,通过缩合反应得到中间体10,再分别与4-氨基苯硼酸频哪醇酯(4a)、2-氨基吡啶-5-硼酸频哪醇酯(4b)或2-氨基-4-三氟甲基吡啶-5-硼酸频哪醇酯(4c)发生Suzuki 反应得到关键中间体11a ~ 11c。再与氯甲酸苯酯反应生成中间体12a ~ 12c,最后与不同的胺(7a、7b 和7d)反应生成目标化合物13a ~ 13e。合成路线见图3。
2 实验部分
2.1 仪器与试剂
Micros Q-TOF 型高分辨分析仪器(美国Waters公司);Avance NEO 400 MHz 核磁共振仪(美国Bruker 公司);RY-1 型熔点仪(天津市分析仪器厂);200 ~ 300 目硅胶(山西诺泰生物科技有限公司);HSG F254 型号TLC 硅胶板(山东青岛海洋化工有限公司);常用试剂均为市售分析纯试剂。PARP-1蛋白和TMB显色液(义翘神州公司);pADPr抗体(美国Santa Cruz公司);抗鼠IgG-HRP(美国CST 公司);HCT116、HCC1937、MDA-MB-231 和MDA-MB-468(中科院上海细胞库);HCT116R(中国药科大学郝海平课题组,中科院上海细胞库);胎牛血清(美国Sciencell 公司);McCOY’s 5A 培养基、RPMI 1640 培养基和L-15 培养基(江苏凯基生物技术股份有限公司);MTT 试剂(美国My Bio-Science 公司);96 孔细胞培养板(美国Thermo 公司);其他的测定缓冲溶液为实验室内部配制。
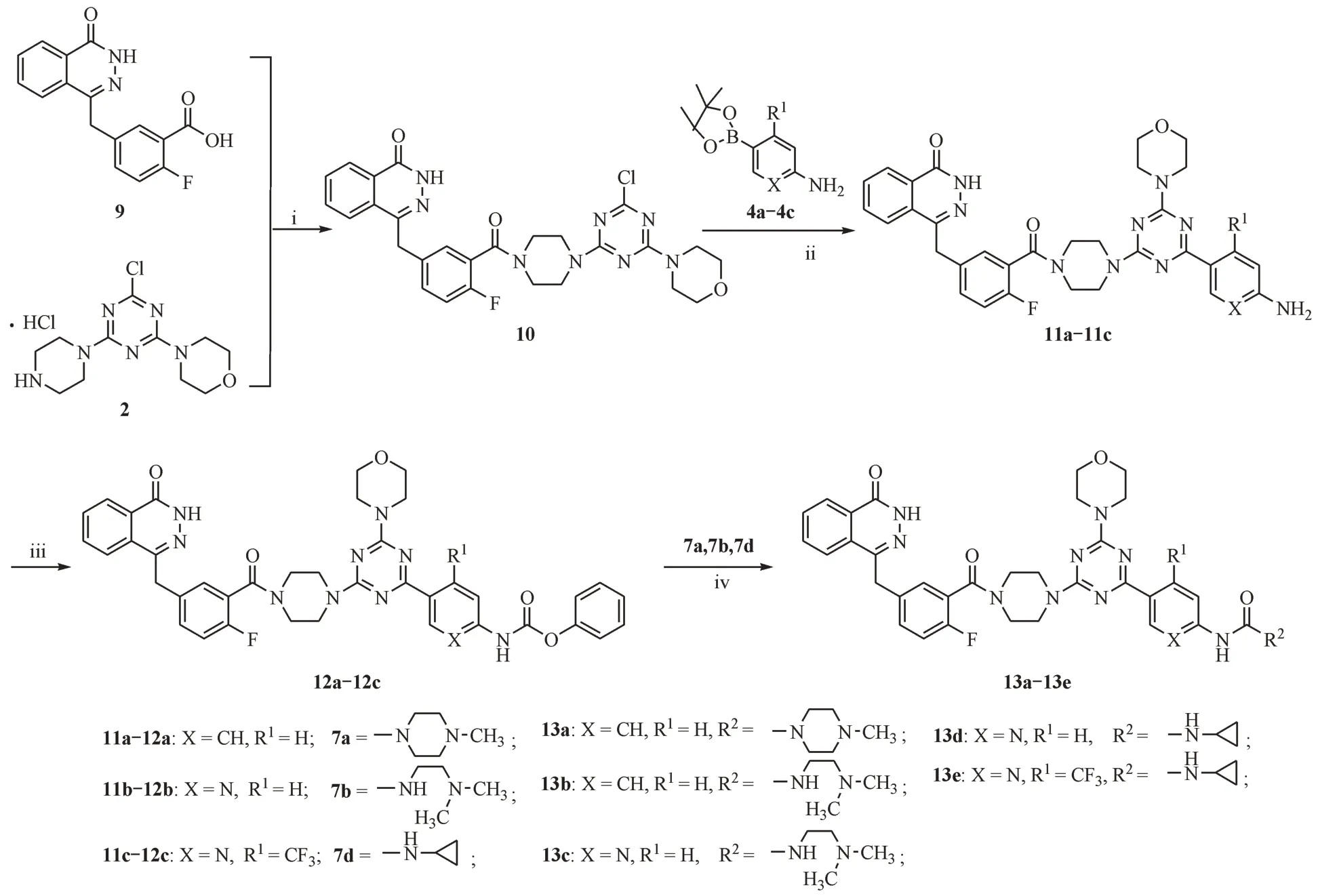
Figure 3 Synthetic routes of compounds 13a-13e
2.2 化学合成
2.2.1 中间体3 的合成 向100 mL 三颈瓶中加入化合物1(0.20 g,0.89 mmol)、化合物2(0.29 g,0.89 mmol)、PyBOP(0.56 g,1.07 mmol)、DIEA(0.44 mL,2.69 mmol)和DMF(5 mL),加毕,25 ℃搅拌反应2 h,TLC(二氯甲烷-甲醇,6∶1)监测反应完全。加水(40 mL)和乙酸乙酯(30 mL),分取有机层,水层再用乙酸乙酯(25 mL×2)萃取,合并有机层,依次用水和饱和氯化钠溶液各洗一次,无水硫酸钠干燥,抽滤,滤液减压浓缩,硅胶柱色谱纯化(二氯甲烷-甲醇,200∶1 ~ 20∶1),得白色固体(0.35 g,79.0%)。mp:144 ~ 146 ℃;1H NMR (400MHz,DMSO-d6)δ∶7.97(s,1H,12-NH2),7.89(s,1H,12-NH2),7.78(dd,J= 8.4,2.7 Hz,1H,Ar-H),7.63(dd,J= 9.9,2.7 Hz,1H,Ar-H),7.55(s,1H,Ar-H),4.00 ~ 3.60 (m,16H,17、18、20、21、30、31、33、34-CH2);MS(ESI):m/z[M+H]+Calcd.:490.1,Found:490.3。
2.2.2 中间体5a ~ 5c 的合成 向100 mL 三颈瓶中加入中间体3(0.20 g,0.41 mmol)、原料4a ~ 4c(0.45 mmol)、碳酸钾(0.16 g,1.14 mmol)的水溶液(1.5 mL),四三苯基膦钯(0.05 g,0.04 mmol)和1,4-二氧六环(15 mL),加毕,氮气保护,转移至100 ℃反应8 h,TLC(二氯甲烷-甲醇,6∶1)监测反应完全。冷却至室温,硅藻土抽滤,滤饼用乙酸乙酯洗涤,滤液减压浓缩,硅胶柱色谱纯化(二氯甲烷-甲醇,200∶1 ~ 10∶1),得白色固体。
2.2.3 中间体6a ~ 6c 的合成 向100 mL 三颈瓶中加入原料5a ~ 5c(0.31 mmol)、氯甲酸苯酯(1.53 mmol)、DIEA(2.48 mmol)和DCM(20 mL),加毕,25 ℃搅拌反应4 h,TLC(二氯甲烷-甲醇,10∶1)监测反应完全;反应液依次用饱和碳酸氢钠溶液、水、饱和氯化钠溶液洗1次,合并有机相,无水硫酸钠干燥,抽滤,滤液减压浓缩,得透明油状物,不经纯化直接投下一步。
2.2.4 中间体10 的合成 向100 mL 三颈瓶中加入化合物9(0.50 g,1.68 mmol)、化合物2(0.54 g,1.68 mmol)、PyBOP(1.06 g,2.02 mmol)、DIEA(1.11 mL,6.71 mmol)和DMF(20 mL),加毕,25 ℃搅拌反应2 h,TLC(二氯甲烷-甲醇,6∶1)监测反应完全。加水(80 mL)和加乙酸乙酯(50 mL),分取有机层,水层再用乙酸乙酯(40 mL×2)萃取,合并有机层,依次用水和饱和氯化钠溶液各洗一次,无水硫酸钠干燥,抽滤,滤液减压浓缩,硅胶柱色谱纯化(二氯甲烷-甲醇,200∶1 ~ 20∶1),得黄色固体(0.83 g,87.0%)。mp:148 ~ 150 ℃;1H NMR (400MHz,DMSO-d6)δ∶12.57(s,1H,9-NH),8.27 (d,J= 7.8 Hz,1H,Ar-H),7.99 ~ 7.81(m,3H,Ar-H),7.48 ~ 7.43(m,1H,Ar-H),7.38(d,J= 6.5 Hz,1H,Ar-H),7.25(t,J= 9.0 Hz,1H,Ar-H),4.35(s,2H,12-CH2),3.80 ~ 3.63(m,14H,23、24、26、27、36、37、39-CH2),3.27 ~ 3.20(m,2H,40-CH2);MS(ESI):m/z[M+H]+Calcd.:565.1,Found:565.3。
2.2.5 中间体11a ~ 11c 的合成 向100 mL 三颈瓶中加入中间体10(0.20 g,0.29 mmol)、原料4a ~4c(0.32 mmol)、碳酸钾(0.11 g,0.81 mmol)的水溶液(1.5 mL),四三苯基膦钯(0.04 g,0.03 mmol)和1,4-二氧六环(15 mL),加毕,氮气保护,转移至100 ℃反应8 h,TLC(二氯甲烷-甲醇,6∶1)监测反应完全。冷却至室温,硅藻土抽滤,滤饼用乙酸乙酯洗涤,滤液减压浓缩,硅胶柱色谱纯化(二氯甲烷-甲醇,200∶1 ~ 10∶1),得白色固体。
2.2.6 中间体12a ~ 12c 的合成 向100 mL 三颈瓶中加入原料11a ~ 11c(0.24 mmol)、氯甲酸苯酯(1.20 mmol)、DIEA(1.93 mmol)和DCM(20 mL),加毕,25 ℃搅拌反应4 h,TLC(二氯甲烷-甲醇,10∶1)监测反应完全;反应液依次用饱和碳酸氢钠溶液、水、饱和氯化钠溶液洗一次,合并有机相,无水硫酸钠干燥,抽滤,滤液减压浓缩,得透明油状物,不经纯化直接投下一步。
2.2.7 目标化合物8a ~ 8f 的合成 向100 mL 三颈瓶中加入中间体6a ~ 6c(0.31 mmol)、原料7a ~7d(0.62 mmol)、DIEA(0.93 mmol)和四氢呋喃(25 mL),加毕转移至70 ℃反应4 h,TLC(二氯甲烷-甲醇,6∶1)监测反应完全。滤液减压浓缩,硅胶柱色谱纯化(二氯甲烷-甲醇,100∶1 ~ 10∶1),得白色固体。
2.2.8 目标化合物13a ~ 13e 的合成 向100 mL三颈瓶中加入中间体12a ~ 12c(0.24 mmol)、原料7a、7b 或7d(0.48 mmol)、DIEA(0.72 mmol)和四氢呋喃(25 mL),加毕转移至70 ℃反应4 h,TLC(二氯甲烷-甲醇,6∶1)监测反应完全。滤液减压浓缩,硅胶柱色谱纯化(二氯甲烷-甲醇,100∶1 ~ 10∶1),得白色固体。
2.3 酶抑制活性测试
以奥拉帕尼为阳性对照。96 孔板每孔加入组蛋白的PBS 溶液[20 µg(0.14 µmol)/mL] 100 µL,冰箱4 ℃孵育过夜。倒出PBS 溶液,PBST 洗板2 次。每孔加入封闭液200 µL,室温孵育2 h 后,倒出封闭液,PBST 洗板2 次,PARP1 缓冲液洗板1 次。每孔依次加入含或不含有化合物的反应缓冲液50 µL 和PARP 蛋白(0.2 µg/mL,溶于PARP 缓冲液)50 µL,室温反应45 min。倒出反应缓冲液,PBST 洗板2 次。每孔加入pADPr 抗体(1∶1 500)100 µL,室温孵育1 h。倒出溶液,PBST 洗板2 次。每孔加入抗鼠IgG-HRP(1∶2 000)100 µL,室温孵育30 min。倒出溶液,PBST 洗板4 次。每孔加入TMB 显色液100 µL,避光反应约15 min(观察颜色),每孔加入2 mol/L H2SO450 µL 以终止反应。使用多功能酶标仪在450 nm 波长下测量吸收度,通过吸收度计算出PARP-1 抑制活性,以半数抑制浓度IC50表达。
PI3K 酶抑制活性测试委托上海睿智生物医药有限公司完成。以BKM120 为阳性药,采用ADPGlo 方法测定PI3K 抑制活性。用Echo 转移的1 ×激酶缓冲液50 nL 到384 孔板的化合物孔,阴性对照孔和阳性对照孔中分别转移50 nL的DMSO。用1 × 激酶缓冲液配制2倍终浓度的激酶溶液。在化合物孔和阳性对照孔分别加2 倍终浓度的激酶溶液2.5 µL,在阴性对照孔中加2.5 µL 的1 × 激酶缓冲液,振荡混匀后室温孵育10 min。再用1 × 激酶缓冲液配制2 倍终浓度的ATP 和底物P1P2 的混合溶液,每孔加入2 倍终浓度的ATP 和底物的混合溶液2.5 µL 以起始反应,振荡混匀后室温反应60 min,再加入ADP-Glo 试剂5 µL,振荡混匀后室温孵育180 min。最后每孔加入激酶检测试剂10 µL,振荡混匀后室温孵育30 min。使用酶标仪读取吸收度,并计算各化合物的抑制率。
2.4 肿瘤细胞抗增殖活性测试
以奥拉帕尼和BKM120为阳性对照,采用MTT法测试目标化合物对人乳腺癌细胞MDA-MB-231和MDA-MB-468,BRCA1 突变的人结直肠癌细胞HCC1937、BRCA2 突变的人结直肠癌细胞HCT116以及对奥拉帕尼耐药的BRCA2突变的人结直肠癌细胞HCT116R的体外抗细胞增殖活性。分别将处于对数生长期的细胞以每孔1 500 ~ 4 000 个细胞的密度接种在96 孔板上。培养18 h 后,弃去培养基,施药区最大药物浓度孔加入2倍终浓度的药液(100 µL),设置3 个复孔,两倍梯度稀释得8 个浓度,最终体系为200 µL。孵育7 d 后,每孔加入MTT 试剂20 µL,孵育4 h 后,弃去培养基和MTT,每孔加入DMSO 150 µL 以溶解甲瓒,摇床上振荡10 min,使用多功能酶标仪在570 nm 波长下测量吸收度,通过吸收度计算出细胞增殖抑制率,以半数抑制浓度IC50表达。
3 结果与讨论
3.1 图谱解析
N-(4-(4-(4-(7-氨基甲酰基-5-氟苯并呋喃-2-羰基)哌嗪-1-基)-6-吗啉-1,3,5-三嗪-2-基)苯基)-4-甲基哌嗪-1-甲酰胺(8a)
白色固体,收率62.8%。mp:204 ~ 206 ℃;1H NMR(400 MHz,DMSO-d6)δ:8.84(s,1H,40-NH),8.26(d,J= 8.4 Hz,2H,Ar-H),7.97(s,1H,12-NH2),7.89(s,1H,12-NH2),7.77(dd,J= 8.2,2.7 Hz,1H,Ar-H),7.65 ~ 7.58(m,3H,Ar-H),7.55(s,1H,Ar-H),4.10 ~ 3.82(m,12H,17、18、20、21、30、34-CH2),3.72 ~ 3.66(m,4H,31、33-CH2),3.54 ~ 3.49(m,4H,44、48-CH2),2.44 ~2.35(m,4H,45、47-CH2),2.24(s,3H,49-CH3);13C NMR(101 MHz,DMSO-d6)δ∶169.64,165.04(d,J= 5.05 Hz),164.47,159.88,158.87,157.51,155.06,150.97,147.83,144.48,130.01,129.37(d,J= 11.1 Hz),129.07(2C),121.67(d,J= 8.08 Hz),118.82(2C),114.56,114.29,111.56,111.52,111.30,111.05,66.52(2C),54.96(2C),46.19(2C),44.14(2C),43.75(2C);HRMS(ESI):m/z[M+H]+Calcd. for C33H37FN10O5:673.293 2,Found: 673.293 8。
2-(4-(4-(6-(3-(2-(二甲基氨基)乙基)脲基)吡啶-3-基)-6-吗啉-1,3,5-三嗪-2-基)哌嗪-1-羰基)-5-氟苯并呋喃-7-甲酰胺(8b)
白色固体,收率82.3%。mp:178 ~ 180 ℃;1H NMR(400 MHz,DMSO-d6)δ∶9.51(s,1H,Ar-H),9.06(s,1H,40-NH),8.45(dd,J= 8.7,2.3 Hz,1H,12-NH2),7.98 ~ 7.86(m,2H,12-NH2,ArH),7.81(s,1H,Ar-H),7.70(dd,J= 8.2,2.7 Hz,1H,Ar-H),7.57(dd,J= 9.7,2.7 Hz,1H,Ar-H),7.51 ~7.46(m,2H,42-NH,Ar-H),4.01 ~ 3.93(m,2H,17-CH2),3.89 ~ 3.73(m,10H,18、20、21、30、34-CH2),3.65 ~ 3.59(m,4H,31、33-CH2),3.25 ~3.20(m,2H,45-CH),2.32(t,J= 6.4 Hz,2H,44-CH2),2.14(s,6H,47、48-CH3);13C NMR(101MHz,DMSO-d6)δ∶168.38,164.79(d,J= 5.05 Hz),164.47,158.87,159.69(d,J =239 Hz),156.08,154.94,150.96,148.28,147.84,138.02,129.42,129.31,125.73,121.70,121.62,114.57,114.30,111.57(d,J= 4.04 Hz),111.31,111.07(d,J= 3.03 Hz),66.49(2C),58.69(2C),45.26(2C),43.76(2C),37.21(2C);HRMS(ESI):m/z[M+H]+Calcd. for C31H36FN11O5:662.288 5,Found:662.289 1。
N-(5-(4-(4-(7-氨基甲酰基-5-氟苯并呋喃-2-羰基)哌嗪-1-基)-6-吗啉-1,3,5-三嗪-2-基)-4-(三氟甲基)吡啶-2-基)4-甲基哌嗪-1-甲酰胺(8c)
白色固体,收率79.5%。mp:184 ~ 186 ℃;1H NMR(400 MHz,DMSO-d6)δ∶9.97(s,1H,Ar-H),8.81(s,1H,40-NH),8.28(s,1H,12-NH2),7.95(s,1H,12-NH2),7.89(s,1H,Ar-H),7.77(dd,J= 8.2,2.7 Hz,1H,Ar-H),7.62(dd,J= 9.8,2.7Hz,1H,Ar-H),7.54(s,1H,Ar-H),3.96 ~ 3.90(m,6H,17、18、21-CH2),3.83 ~ 3.75(m,8H,20、30、31、34-CH2),3.69 ~ 3.61(m,6H,33、44、48-CH2),2.37 ~ 2.31(m,4H,45、47-CH2),2.21(s,3H,49-CH3);13C NMR(101 MHz,DMSO-d6)δ∶169.61,164.50,164.47,159.87,158.92,157.49,156.27,154.53,153.96,151.20,150.87,147.84,136.43,129.37(d,J= 10.1 Hz),125.53,124.35(d,J=275 Hz),121.66(d,J= 8.08 Hz),114.40(d,J=27.2 Hz),111.52,111.17(d,J= 25.2 Hz),109.84,66.41(2C),54.55(2C),45.67(2C),43.95(2C),43.14(2C),28.42(2C);HRMS(ESI):m/z[M+H]+Calcd. for C33H35F4N11O5:742.275 9,Found:742.276 6。
N-(5-(4-(4-(7-氨基甲酰基-5-氟苯并呋喃-2-羰基)哌嗪-1-基)-6-吗啉-1,3,5-三嗪-2-基)-4-(三氟甲基)吡啶-2-基)哌嗪-1-甲酰胺(8d)
白色固体,收率70.4%。mp:218 ~ 220 ℃;1H NMR(400 MHz,DMSO-d6)δ∶10.03(s,1H,Ar-H),8.81(s,1H,40-NH),8.26(s,1H,12-NH2),7.91(s,1H,12-NH2),7.85(s,1H,Ar-H),7.75(dd,J= 8.2,2.7 Hz,1H,Ar-H),7.61(dd,J= 9.7,2.7Hz,1H,Ar-H),7.53(s,1H,Ar-H),3.95 ~ 3.89(m,6H,17、18、21-CH2),3.80 ~ 3.75(m,6H,20、30、34-CH2),3.69 ~ 3.62(m,4H,31、33-CH2),3.61 ~3.55(m,4H,44、48-CH2),2.97 ~ 2.92(m,4H,45、47-CH2);13C NMR(101 MHz,DMSO-d6)δ∶169.59,164.50,159.87,158.93,157.49,156.23,154.53,151.22,150.87,147.84,136.77,136.45,129.37(d,J= 10.1 Hz),125.60,123.34(d,J= 275 Hz),121.65(d,J= 8.08 Hz),114.40(d,J= 27.2 Hz),111.52,111.17(d,J= 25.2 Hz),109.82,66.41(2C),44.37(4C),43.74(4C),43.44(2C);HRMS(ESI):m/z[M+H]+Calcd. for C32H33F4N11O5:728.260 2,Found:728.260 8。
2-(4-(4-(6-(3-环丙基脲基)-4-(三氟甲基)吡啶-3-基)-6-吗啉-1,3,5-三嗪-2-基)哌嗪-1-羰基)-5-氟苯并呋喃-7-甲酰胺(8e)
白色固体,收率83.4%。mp:208 ~ 210 ℃;1H NMR(400 MHz,DMSO-d6)δ∶9.76(s,1H,Ar-H),8.78(s,1H,40-NH),8.20(s,1H,12-NH2),7.91(s,1H,12-NH2),7.86(s,1H,Ar-H),7.82(s,1H,Ar-H),7.75(dd,J= 8.1,2.7 Hz,1H,Ar-H),7.61(dd,J= 9.7,2.7 Hz,1H,Ar-H),7.53(s,1H,42-NH),3.98 ~ 3.86(m,6H,17、18、21-CH2),3.82 ~3.74(m,6H,20、30、34-CH2),3.66 ~ 3.61(m,4H,31、33-CH2),2.63 ~ 2.58(m,1H,44-CH),0.70 ~0.64(m,2H,45-CH2),0.49 ~ 0.43(m,2H,46-CH2);13C NMR(101 MHz,DMSO-d6)δ∶169.45,164.50,164.47,159.87,158.90,157.50,155.43,155.38,151.42,150.89,147.84,137.20,136.88,129.35(d,J= 9.09 Hz),124.92,123.22(d,J=274 Hz),121.65(d,J= 8.08 Hz),114.41(d,J=27.2 Hz),111.55,111.17(d,J= 25.2 Hz),108.41,66.41(2C),43.74(4C),22.78(2C),6.75(2C);HRMS(ESI):m/z[M+H]+Calcd.for C31H30F4N10O5:699.2337,Found:699.234 2。
2-(4-(4-(6-(3-(2-(二甲基氨基)乙基)脲基)-4-(三氟甲基)吡啶-3-基)-6-吗啉-1,3,5-三嗪-2-基)哌嗪-1-羰基)-5-氟苯并呋喃-7-甲酰胺(8f)
白色固体,收率85.8%。mp:222 ~ 224 ℃;1H NMR(400 MHz,DMSO-d6)δ∶9.81(s,1H,Ar-H),8.79(s,1H,40-NH),8.17(s,1H,12-NH2),7.91(s,1H,12-NH2),7.85(s,1H,Ar-H),7.75(dd,J= 8.2,2.7 Hz,1H,Ar-H),7.61(dd,J= 9.8,2.7Hz,1H,Ar-H),7.53(s,1H,Ar-H,),7.46(s,1H,42-NH),4.01 ~ 3.86(m,6H,17、18、21-CH2),3.85 ~3.75(m,6H,20、30、34-CH2),3.69 ~ 3.61(m,4H,31、33-CH2),3.29 ~ 3.24(m,2H,45-CH2),2.41(t,J= 6.3 Hz,2H,44-CH2),2.26(s,6H,47、48-CH3);13C NMR(101 MHz,DMSO-d6)δ∶169.49,164.50,164.46,159.87,158.90,157.50,155.58,154.66,151.42,150.88,147.84,137.47(d,J= 68.6 Hz),136.50,129.35(d,J= 9.09 Hz),124.82,123.25(d,J= 275 Hz),121.65(d,J= 8.08 Hz),114.41(d,J= 27.2 Hz),111.54,111.17(d,J= 25.2 Hz),108.41,108.35,66.41(2C),58.67(2C),45.45(2C),43.73(2C),37.43(2C);HRMS(ESI):m/z[M+H]+Calcd. for C32H35F4N11O5:730.275 9,Found:730.276 6。
N-(4-(4-(4-(2-氟-5-((4-氧代-3,4-二氢酞嗪-1-基)甲基)苯甲酰基)哌嗪-1-基)-6-吗啉-1,3,5-三嗪-2-基)苯基)-4-甲基哌嗪-1-甲酰胺(13a)
白色固体,收率81.5%。mp:188 ~ 190 ℃;1H NMR(400 MHz,DMSO-d6)δ∶12.61(s,1H,9-NH),8.78(s,1H,46-NH),8.28 ~ 8.25(d,J= 8.0 Hz,1H,Ar-H),8.24 ~ 8.21(d,J= 8.0 Hz,2H,Ar-H),7.98(d,J= 8.0 Hz,1H,Ar-H),7.93 ~ 7.88(t,J= 8.0 Hz,1H,Ar-H),7.87 ~ 7.82(t,J= 8.0 Hz,1H,Ar-H),7.59(d,J= 8.6 Hz,2H,Ar-H),7.46(m,1H,Ar-H),7.39(dd,J= 6.5,2.3 Hz,1H,Ar-H),7.26(t,J= 9.0 Hz,1H,Ar-H),4.35(s,2H,12-CH2),3.99 ~ 3.63(m,14H,23、24、26、27、36、37、40-CH2),3.49 ~ 3.43(m,4H,39、50-CH2),3.28 ~3.24(m,2H,54-CH2),2.36 ~ 3.30(m,4H,51、53-CH2),2.21(s,3H,55-CH3);13C NMR(101 MHz,DMSO-d6)δ∶169.62,165.05,164.50,159.85,158.11,155.68,155.03,145.34,144.46,135.31,135.28(d,J= 6.06 Hz),133.96,132.20(d,J =8.08 Hz),132.00,130.01,129.57(2C),129.41(d,J= 4.04 Hz),129.09,128.40,126.55,125.96,124.22,124.04,118.80(2C),116.54,116.32,66.51(2C),54.84(2C),46.01(2C),44.00(2C),43.75,36.94(2C);HRMS(ESI):m/z[M+H]+Calcd. for C39H42FN11O4:748.340 5,Found:748.340 8。
1-(2-(二甲基氨基)乙基)-3-(4-(4-(2-氟-5-((4-氧代-3,4-二氢酞嗪-1-基)甲基)苯甲酰基)哌嗪-1-基)-6-吗啉-1,3,5-三嗪-2-基)苯基)脲(13b)
白色固体,收率85.4%。mp:192 ~ 194 ℃;1H NMR(400 MHz,DMSO-d6)δ∶12.61(s,1H,9-NH),9.01(s,1H,46-NH),8.30 ~ 8.21(m,3H,Ar-H),7.98(d,J= 8.1 Hz,1H,Ar-H),7.94 ~ 7.88(m,1H,Ar-H),7.86 ~ 7.80(m,1H,Ar-H),7.53 ~7.43(m,3H,Ar-H),7.38(d,J= 8.6 Hz,1H,Ar-H),7.26(t,J= 9.0 Hz,1H,Ar-H),6.22(t,J= 5.4Hz,1H,48-NH),4.35(s,2H,12-CH2),3.99 ~ 3.58(m,14H,23、24、26、27、36、37、40-CH2),3.28 ~3.16(m,4H,39、50-CH2),2.36(t,J= 6.2 Hz,2H,51-CH2),2.20(s,6H,53、54-CH3);13C NMR(101MHz,DMSO-d6)δ∶169.61,165.04,164.50,161.52,159.85,158.12,155.68,155.31,145.33,144.42,135.29(d,J= 4.04 Hz),133.95,132.24(d,J= 6.06 Hz),132.16,131.99,129.57,129.51(d,J= 4.04 Hz),129.35(2C),128.39,126.55,125.95,124.23,124.04,116.95(2C),116.53,116.32,66.51(2C),58.85(2C),45.51,45.43(2C),43.74,37.35,36.94;HRMS(ESI):m/z[M+H]+Calcd. for C38H42FN11O4:736.340 5,Found:736.341 2。
1-(2-(二甲基氨基)乙基)-3-(5-(4-(4-(2-氟-5-((4-氧代-3,4-二氢酞嗪-1-基)甲基)苯甲酰基)哌嗪-1-基)-6-吗啉-1,3,5-三嗪-2-基)吡啶-2-基)脲(13c)
白色固体,收率81.4%。mp:180 ~ 182 ℃;1H NMR(400 MHz,DMSO-d6)δ∶12.60(s,1H,9-NH),9.57(s,1H,Ar-H),9.10(s,1H,46-NH),8.49(s,1H,Ar-H),8.27(d,J= 7.8 Hz,1H,Ar-H),8.04 ~ 7.95(m,2H,Ar-H),7.91(t,J= 7.6 Hz,1H,Ar-H),7.84(t,J= 7.5 Hz,1H,Ar-H),7.54(d,J=8.8 Hz,1H,Ar-H),7.50 ~ 7.44(m,1H,Ar-H),7.39(dd,J= 6.5,2.3 Hz,1H,Ar-H),7.26(t,J=9.0 Hz,1H,48-NH),4.35(s,2H,12-CH2),3.97 ~3.63(m,16H,23、24、26、27、36、37、39、40-CH2),3.29 ~ 3.24(m,2H,50-CH2),2.43(s,2H,51-CH2),2.24(s,6H,53、54-CH3);13C NMR(101 MHz,DMSO-d6)δ∶168.38,164.80,164.50,159.85,158.11,156.10,155.68,154.90,148.31,145.33,138.02,135.30(d,J =3.03 Hz),133.96,132.23(d,J= 9.09 Hz),132.00,129.57,129.40(d,J=4.04 Hz),128.39,126.55,125.96,125.68,124.20,124.02,116.54,116.33,111.06,66.48(2C),58.83(2C),45.43(2C),43.76,37.38(2C),36.93(2C);HRMS(ESI):m/z[M+H]+Calcd. for C37H41FN12O4:737.335 8,Found:737.336 5。
1-环丙基-3-(5-(4-(4-(2-氟-5-((4-氧代-3,4-二氢酞嗪-1-基)甲基)苯甲酰基)哌嗪-1-基)-6-吗啉-1,3,5-三嗪-2-基)吡啶-2-基)脲(13d)
白色固体,收率86.8%。mp:236 ~ 238 ℃;1H NMR(400 MHz,DMSO-d6)δ∶12.60(s,1H,9-NH),9.43(s,1H,Ar-H),9.11(s,1H,46-NH),8.50(s,1H,Ar-H),8.27(dd,J= 7.8,1.5 Hz,1H,Ar-H),8.12(s,1H,Ar-H),7.98(d,J= 8.0 Hz,1H,Ar-H),7.93 ~ 7.87(m,1H,Ar-H),7.84(td,J= 7.5,7.1,1.3 Hz,1H,Ar-H),7.52(d,J= 8.9 Hz,1H,Ar-H),7.49 ~ 7.43(m,1H,Ar-H),7.39(dd,J=6.5,2.3 Hz,1H,Ar-H),7.26(t,J= 9.0 Hz,1H,48-NH),4.35(s,2H,12-CH2),3.92 ~ 3.66(m,14H,23、24、26、27、36、37、40-CH2),3.26(s,2H,39-CH2),2.66 ~ 2.60(m,1H,50-CH),0.70 ~ 0.62(m,2H,51-CH2),0.50 ~ 0.42(m,2H,52-CH2);13C NMR(101 MHz,DMSO-d6)δ∶168.33,164.79,164.49,159.85,158.10,155.92,155.68,155.64,148.31,145.33,138.07,135.30(d,J= 3.03 Hz),133.96,132.19(d,J= 8.08 Hz),132.00,129.57,129.41(d,J= 4.04 Hz),128.39,126.55,125.95,125.76,124.20,124.02,116.54,116.32,111.06,66.48(2C),43.75(2C),36.93(2C),22.74(2C),6.79(2C);HRMS(ESI):m/z[M+H]+Calcd. for C36H36FN11O4∶706.293 6,Found:706.294 1。
1-环丙基-3-(5-(4-(4-(2-氟-5-((4-氧代-3,4-二氢酞嗪-1-基)甲基)苯甲酰基)哌嗪-1-基)-6-吗啉-1,3,5-三嗪-2-基)-4-(三氟甲基)吡啶-2-基)脲(13e)
白色固体,收率81.2%。mp:228 ~ 230 ℃;1H NMR(400 MHz,DMSO-d6)δ∶12.60(s,1H,9-NH),9.61(s,1H,Ar-H),8.79(s,1H,46-NH),8.27(d,J= 7.7 Hz,1H,Ar-H),8.13(s,1H,Ar-H),7.97(d,J= 7.9 Hz,1H,Ar-H),7.89(s,1H,Ar-H),7.83(s,1H,Ar-H),7.56(s,1H,Ar-H),7.46(s,1H,Ar-H),7.39(dd,J= 6.6,2.3 Hz,1H,Ar-H),7.25(t,J= 9.0 Hz,1H,48-NH),4.35(s,2H,12-CH2),3.86 ~ 3.64(m,14H,23、24、26、27、36、37、40-CH2),3.25(s,2H,39-CH2),2.62(d,J= 7.0 Hz,1H,50-CH),0.69(d,J= 7.1 Hz,2H,51-CH2),0.48(s,2H,52-CH2);13C NMR(101 MHz,DMSOd6)δ∶169.42,164.53,164.49,159.85,158.10,155.67,155.42,155.39,151.46,145.32,137.03(q,J= 32.3 Hz),135.30(d,J= 3.03 Hz) 133.93,132.21(d,J= 8.08 Hz),131.99,129.56,129.38,128.40,126.55,125.96,124.88,124.17,123.99,121.84,116.55,116.33,108.41(d,J= 6.06 Hz),66.40(2C),43.75(2C),36.95(2C),22.78(2C),6.75(2C);HRMS(ESI):m/z[M+H]+Calcd. for C37H35F4N11O4:774.281 0,Found:774.281 8。
3.2 生物活性实验
为了研究目标化合物的抗肿瘤活性,测试了全部11 个化合物的酶抑制活性以及3 个化合物的体外抗细胞增殖活性。选取的细胞有野生型人乳腺癌细胞MDA-MB-231 和MDA-MB-468、BRCA 突变的人结直肠癌细胞HCC1937 和HCT116 以及对奥拉帕尼耐药的BRCA 突变的人结直肠癌细胞HCT116R。实验结果见表2和表3。
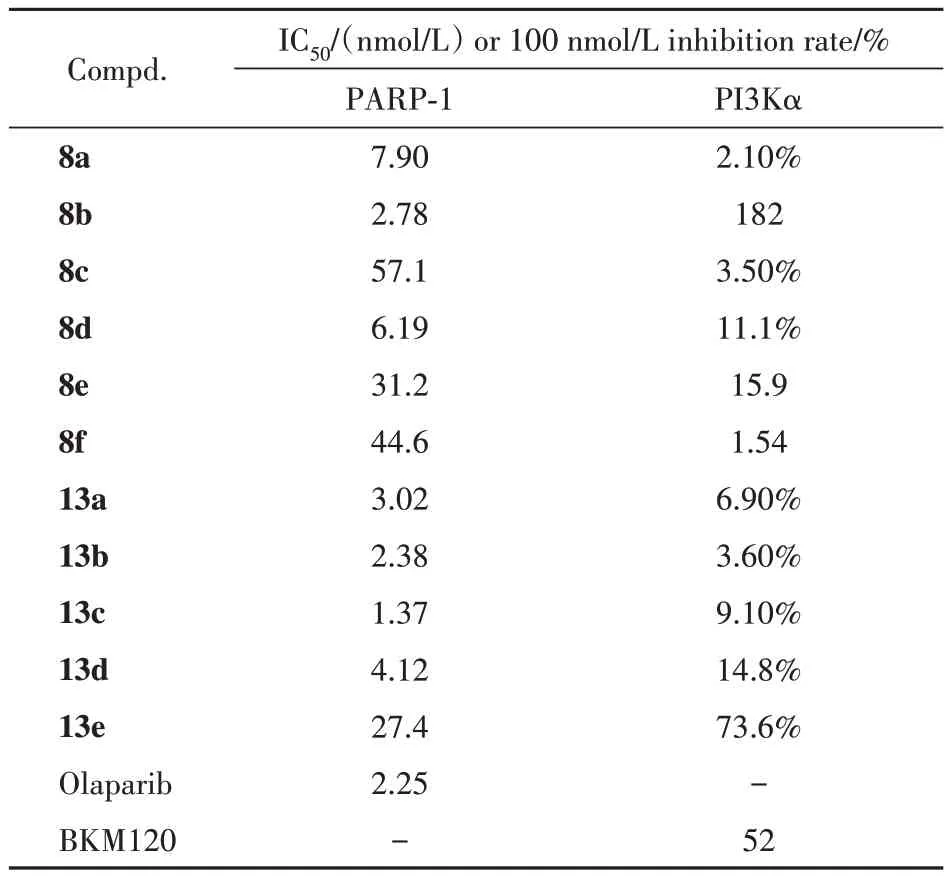
Table 2 Enzyme inhibition of 8a-8f and 13a-13e against PARP-1 and PI3K (n = 3)
Table 3 Effects of compound 8b,8e and 8f against tumor cell lines (± s, n = 4)
Table 3 Effects of compound 8b,8e and 8f against tumor cell lines (± s, n = 4)
Compd.8b 8e 8f Olaparib BKM120 IC50/(µmol/L)MDA-MB-231 3.61 ± 0.11 1.76 ± 0.16 0.54 ± 0.002 10.30 ± 0.80 1.77 ± 0.03 MDA-MB-468 1.30 ± 0.93 0.10 ± 0.10 0.19 ± 0.18 1.00 ± 0.15 2.72 ± 2.41 HCC1937 4.27 ± 1.17 1.11 ± 0.47 0.91 ± 0.27 11.22 ± 1.92 1.65 ± 0.47 HCT116 7.26 ± 0.08 0.99 ± 0.22 1.10 ± 0.13 4.60 ± 0.51 0.78 ± 0.05 HCT116R 6.92 ± 3.70 1.07 ± 0.71 1.22 ± 0.59 50.82 ± 0.66 1.30 ± 0.55
由表2 可知,化合物8a ~ 8f 的PARP-1 抑制活性稍弱于化合物13a ~ 13e,但化合物8e 和8f 显示出稍好的PI3K 抑制活性。由13a ~ 13d 可知,当芳香环的4 位没有取代基时,由化合物13d 与PI3Kα蛋白的对接结果可知,三嗪环与吡啶环之间的夹角较小,吡啶环的2位氨基与PI3Kα 蛋白的氨基酸残基之间未能形成氢键相互作用(图4-A),因此PI3K 抑制活性大幅度降低。当芳香环的4 位引入三氟甲基后,由化合物13e 与PI3Kα 蛋白的对接结果可知,三嗪环与吡啶环之间形成的夹角增大,吡啶环2 位氨基与PI3Kα 蛋白的氨基酸残基之间形成了氢键作用(图4-B),从而提高了PI3K 抑制活性。因此,相比于4 位无取代基的化合物13a ~13d,化合物13e 的PI3K 抑制活性明显得到提升,但是会损失小部分的PARP-1 抑制活性。同时,由8c ~ 8f 可知,通过脲基团连接的末端片段体积或刚性不宜过大,否则也会对PI3K 的抑制活性产生不利影响,但是不会影响PARP-1 的抑制活性。甚至,如果在末端片段的位置有裸露的NH 基团,反而提高了PARP-1的抑制活性。
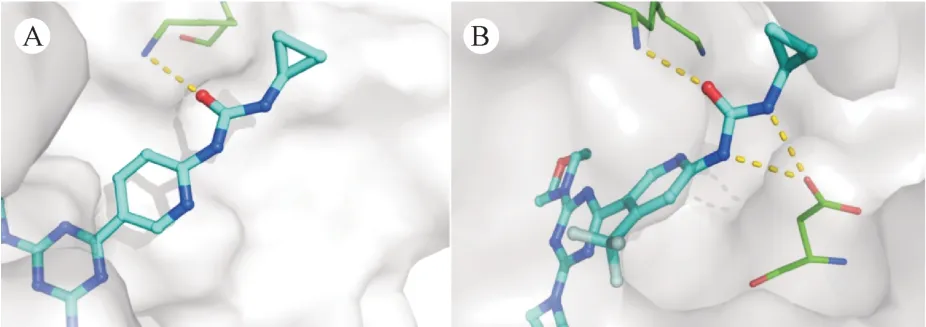
Figure 4 Binding model analysis of compound 13d and 13e with PI3Kα
根据酶抑制活性测定结果,选择对两个靶点的抑制活性均较好的化合物8b,8e和8f,测试它们的抗肿瘤细胞增殖活性。由表3 可知,3 个化合物对 MDA-MB-231、MDA-MB-468、HCC1937 和HCT116R 的增殖抑制活性强于阳性药奥拉帕尼;其中8e 和8f 对HCT116R 的IC50达到1 µmol/L 水平。体外抗肿瘤活性实验结果与酶抑制活性结果基本一致。
本研究选择化合物8b和8f制成相应的盐酸盐并进行水溶性测试。其中化合物8f的水溶性较好,为2.9 mg/mL,化合物8b 的水溶性为1.1 mg/mL,与先导化合物相比,化合物的水溶性得到了显著的提升。
4 总结与展望
PARP-1 抑制剂对BRCA1/2 突变的肿瘤患者具有较好的疗效,但存在临床适应证窄和易产生耐药性等问题,从而限制了PARP-1 抑制剂的广泛应用。PI3K 抑制剂可以抑制BRCA1/2 的表达,从而使肿瘤细胞对PARP-1 抑制剂敏感。因此,开发PARP-1 和PI3K 双靶点抑制剂有望拓展PARP-1 抑制剂的临床使用范围,解决PARP-1 抑制剂的耐药性问题。
本研究中,以课题组前期研究获得的PARP-1和PI3K 双靶点化合物XW-1 和WZ-1 为先导物,以提高化合物水溶性为目标,通过连接脲基团并引入成盐位点,设计合成了11个目标化合物。化合物结构经过1H NMR、13C NMR 和 HRMS 确证。通过PAPR-1和PI3K抑制活性评价和肿瘤细胞增殖抑制活性测定,发现化合物8f 不仅具有较强的PAPR-1和PI3K 抑制活性,同时对所选的5 种肿瘤细胞具有优异的增殖抑制活性。与先导化合物相比,化合物8f 盐酸盐的水溶性得到显著提升。本研究为进一步开发成药性好、抑制活性强的PARP-1/PI3K双靶点抑制剂提供了实验依据。

