朱砂体内汞暴露与幼鼠记忆功能障碍的相关性
胡赵良,邹文宇,宋 敏,杭太俊,陆宇婷
(中国药科大学药物分析系,南京 210009)
朱砂(Cinnabaris)是传统矿物类中药材,主含硫化汞(α-HgS > 98%),性味甘,微寒,归心经。因其具有镇惊安神之功效,朱砂常配伍用于儿童中成药中,用于治疗小儿高热、小儿惊风等[1]143。《中华人民共和国药典》(2020 版)收载了35 种含朱砂儿科制剂,如小儿惊风散、小儿至宝丸、小儿清热片等[1]。
汞是公认的有毒重金属,各种形式的汞化合物都可能造成体内汞暴露量增高,引发毒性反应[2]。朱砂作为含汞中药材,不合理使用导致的汞中毒事件时有报道[3-5],使其安全性备受质疑。儿童作为特殊的用药群体,对汞化合物的毒性尤为敏感,因此含朱砂儿童专用制剂的临床使用应当更为慎重。汞的毒性累及人体各个器官,对中枢神经系统损害尤甚[6]。对于处在发育阶段的儿童,长期高水平的汞暴露可引起神经发育障碍,包括记忆功能障碍、儿童自闭症、注意力缺陷、阅读及运动障碍等[7-8]。其中记忆功能障碍是儿童汞中毒后较为常见的一种表现,即使摆脱汞暴露,记忆功能也不易恢复[9]。
虽然朱砂的水溶性与口服生物利用度极低,毒性远小于其他形式的汞化合物,但已有研究表明,复方配伍与胃肠道消化作用能显著增加机体对朱砂中汞的吸收,并促进汞进入大脑[10]。此外,儿童的血脑屏障发育不完善,更易受有害重金属的影响[11],极大地增加了含朱砂儿童专用制剂引发记忆功能障碍的风险。
因此,本研究以幼年大鼠为实验对象,使用冷原子-原子荧光光谱法(CV-AFS)测定幼鼠灌胃给予低、中、高剂量水平朱砂后不同发育阶段的血汞暴露量,观察海马神经元形态变化,测试大鼠的记忆功能,并利用相关性分析揭示朱砂与记忆功能障碍间的剂量-血汞暴露量-毒性效应关系,从而为含朱砂儿童专用制剂的临床合理使用提供科学指导与理论依据。
1 材 料
1.1 试 剂
朱砂(凤凰县红飞药用朱砂有限责任公司,批号:20190401,硫化汞含量:98.8%,总汞含量:0.85 mg/mg,可溶性汞盐小于0.10%,符合《中华人民共和国药典》2020 年版一部“朱砂”项下的要求[1]143),汞单元素标准物质(中国计量科学研究院,批号:19041)。其余试剂均为市售分析纯试剂。
1.2 仪 器
AF-640A 冷原子-原子荧光光谱仪(北京瑞利分析仪器有限公司);AF-2型汞元素荧光空心阴极灯;Morris 水迷宫设备、Xeye Aba V3.2 动物行为轨迹视频分析系统(北京天鸣宏远科技发展有限公司);正置显微镜(德国Leica 公司);BS21S 分析天平(德国Sartorius 公司)。所有玻璃仪器均使用20%硝酸浸泡24 h以上,并用超纯水洗净。
1.3 动 物
清洁级SD 幼年大鼠32 只(雌性,3 周龄,体质量为50 ± 2 g,浙江维通利华实验动物技术有限公司,合格证号SCXK(浙)2019-0001),在清洁级无汞环境下饲养,每个鼠笼4 只大鼠。饲养室温度(24 ± 1)℃,相对空气湿度40% ~ 45%,12 h/12 h 光照/黑暗交替,自由饮水摄食。所有动物实验操作均经过中国药科大学动物伦理委员会批准(批号:2020-03-007),符合实验室动物饲养和使用指导原则。
2 方 法
2.1 实验动物分组与处理
大鼠适应性喂养3 d后按体质量随机分为4个剂量组:对照组(C group)、朱砂低剂量组(L group)、中剂量组(M group)、高剂量组(H group),每组8 只。根据《中华人民共和国药典》规定的朱砂最高摄入限度0.5 g/d[1]143,按人鼠间体表面积折算大鼠剂量约为50 mg/kg,设置为低剂量,该剂量的5 倍(250 mg/kg)、20倍(1 000 mg/kg)分别为中、高剂量。对照组灌胃给予0.5%CMC-Na 水溶液,朱砂组分别灌胃给予朱砂混悬液(50 mg,250 mg,1 000 mg/kg;以0.5%CMC-Na 水溶液作为混悬介质),每日1 次,连续灌胃14周。
每日记录大鼠体质量、饮水量、摄食量,观察大鼠状态;分别于第8周、10周、12周、14周末次给药24 h 后,眼内眦静脉丛取血0.3 mL 至含有肝素钠的离心管中,混匀,置-80 ℃保存待测;于第13 周进行Morris 水迷宫实验;于第14 周末次给药24 h后,腹腔注射乌拉坦(1.2 g/kg)麻醉大鼠,暴露胸腔,心脏灌注生理盐水约250 mL,低温条件下取大鼠脑组织,称重后置于4%多聚甲醛中固定24 h。
2.2 大鼠血汞暴露量的测定
2.2.1 大鼠全血样品前处理 取全血0.2 mL,置50 mL凯氏烧瓶中,加入HNO3-HClO4(4∶1) 5 mL,混匀,过夜。于120 ~ 140 ℃加热消解2 h,保持微沸,必要时补加HNO3适量,加热至溶液澄清透明,溶液体积约1 mL,停止加热,放冷。用5%HNO3-0.05% K2Cr2O7转移至10 mL 量瓶中,稀释至刻度,摇匀,作为供试品溶液。同法制备空白溶液。
2.2.2 冷原子-原子荧光光谱检测条件 以2%HNO3溶液为载流;0.1%KBH4-0.2%KOH 水溶液为还原剂;蠕动泵转速为100 r/min;PMT 负高压为-270 V;主灯电流为30 mA;原子化器温度为200 ℃(冷原子,低温);载气氩气流量为400 mL/min;辅助气流量为400 mL/min;原子化器高度为7mm;连续流动程序为:进样(8 s);停泵(4 s);注入(25 s);停泵(1 s);以峰面积定量,峰形对称且平滑。
2.3 大鼠海马组织形态学病理检测
固定后的脑组织经脱水透明,石蜡包埋后切片,切片厚度为3 µm,烘干脱蜡后进行HE染色,对切片进行脱水透明,用中性树胶封片。在正置显微镜下观察和拍摄。
2.4 Morris水迷宫实验
Morris 水迷宫实验在直径150 cm,高60 cm 的宫体中进行,宫体被平均分为4个象限,并在第4象限(目标象限)放置直径为10 cm,高为30 cm 的平台,水温为23 ~ 25 ℃。Morris 水迷宫实验过程分为连续6 d的定位航行实验和第7天的空间探索实验两部分。定位航行实验期间,设置平台可见,训练大鼠对平台位置的记忆,每天训练2 次,每次游泳时间为90 s;空间探索实验期间,撤去平台,测试大鼠的记忆能力,分别记录90 s 内大鼠平台潜伏期、目标象限潜伏期、平台停留时间、目标象限停留时间、目标象限停留总时间(平台停留时间 + 目标象限停留时间)以及穿台次数。
2.5 统计分析
所有数据以±s表示,使用SPSS 23软件进行两组之间的双尾独立样本Student’st-test、Spearman 相关性分析与Pearson 相关性分析,当P<0.05 时具有统计学意义。使用GraphPad Prism 8软件绘制结果统计图,使用R 语言Pheatmap 包绘制相关性热图。
3 结 果
3.1 朱砂对幼年大鼠生长发育、体质量及脑组织脏器系数的影响
给药期间,各组大鼠饮水摄食正常,生长发育情况良好,未见明显中毒症状。如图1 所示,各组大鼠体质量增长速度接近,无统计学差异;给药结束后,剥取脑组织,称重,计算脏器系数(脑重/体质量 × 100),无统计学差异。
3.2 大鼠灌胃朱砂后血汞暴露量检测
3.2.1 大鼠血汞暴露量检测方法学验证 对建立CV-AFS 血汞暴露量测定方法进行了线性、专属性、精密度、回收率、稳定性考察。以全血系列标准样品荧光峰面积(Y)对血汞暴露量(C, ng/mL)进行回归。典型回归方程为Y= 32.26C+ 52.86,相关系数r= 0.999 6。结果表明,血汞暴露量在5 ~ 80ng/mL 的范围内线性关系良好,定量限浓度为5 ng/mL。分别配制低、中、高3个质量浓度水平(10、35、60 ng/mL)的全血总汞标准样品各6份,同法操作并测定。结果表明,本法测定大鼠血汞暴露量的专属性良好,内源性物质对测定无干扰;低、中和高浓度样品的批内和批间精密度良好(RSD 均小于15%);加样回收率在91.68% ~ 109.1%之间。全血样品在-80 ℃冰箱冰冻保存30 d,反复冻融3次,消解结束后室温放置2 d 的稳定性均良好,适用于血汞暴露量的测定。
3.2.2 大鼠血汞暴露量测定结果 各组大鼠不同发育阶段的全血总汞浓度如图2 所示。正常生理条件下,大鼠全血总汞质量浓度范围在10 ~ 30ng/mL,且全血总汞浓度随周龄增加而上升[12-13]。实验结果显示,随着给药时间延长,各剂量组大鼠血汞暴露量呈上升趋势,在给药10周内,血汞暴露量显著升高,继续给药2 ~ 4 周,上升速度放缓,趋于平稳,呈现出时间依赖性。低、中、高剂量组大鼠给药后的血汞暴露量随朱砂剂量依次升高,并且均显著高于对照组(P< 0.001),呈现出明显的剂量依赖性。
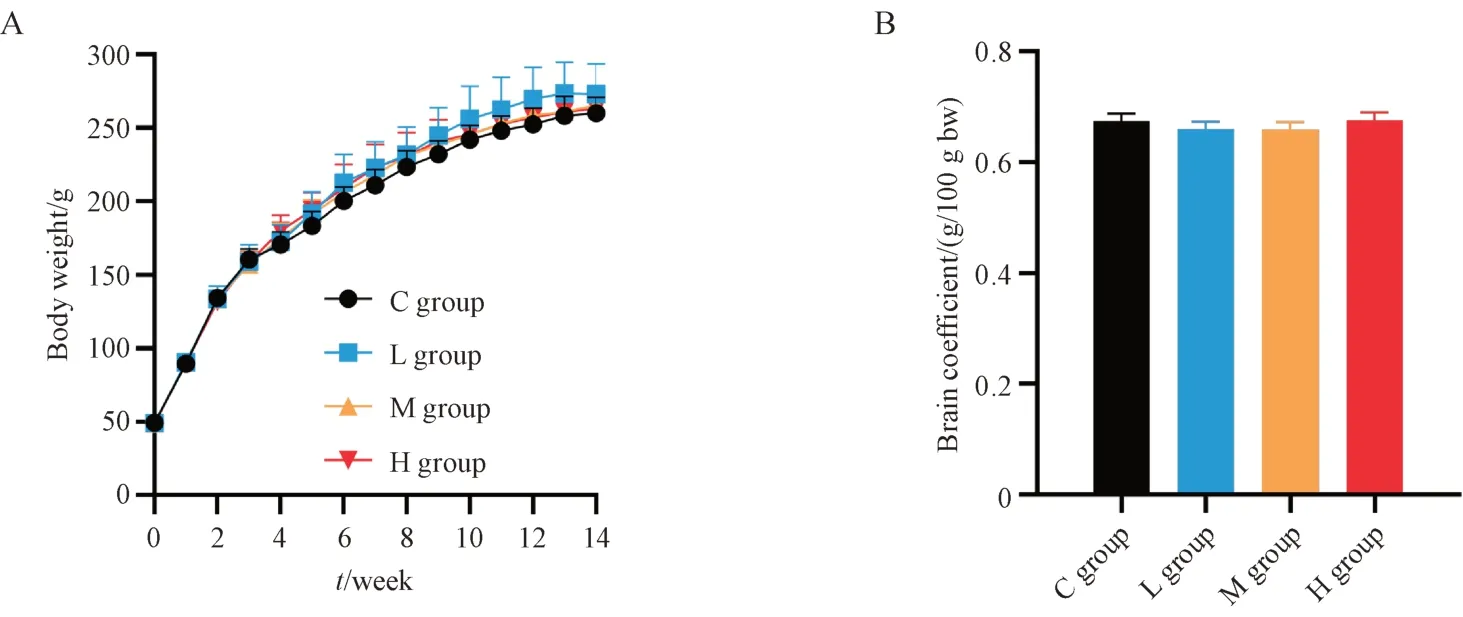
Figure 1 Effect of Cinnabaris on rats’ body weights and brain coefficients (± s, n = 8)
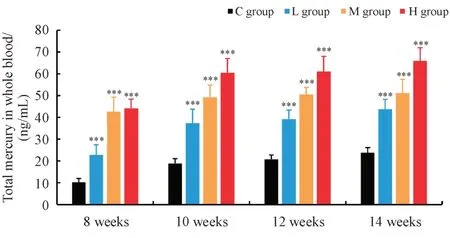
Figure 2 Total mercury concentration in the rats’whole blood samples at different growth phases (± s, n = 8)
3.3 朱砂对幼年大鼠海马神经元形态结构的影响
各组大鼠海马CA1 区、CA3 区及DG 区HE 染色结果如图3 所示。对照组大鼠各区域海马锥体细胞排列整齐,层次清楚,锥体细胞核大而圆,核仁明显、数目多;朱砂低剂量组大鼠仅CA3 区锥体细胞出现轻微核固缩;中剂量组大鼠海马DG 区未见明显病变,CA1 区、CA3 区均出现不同程度的锥体细胞核固缩,CA3 区较为严重,且锥体细胞形态不规则;高剂量组大鼠DG 区同样未见明显病变,CA1 区、CA3 区锥体细胞核固缩程度较重、细胞形态不规则,且CA3 区出现锥体细胞排列紊乱的病理改变。
3.4 朱砂对幼年大鼠记忆功能的影响
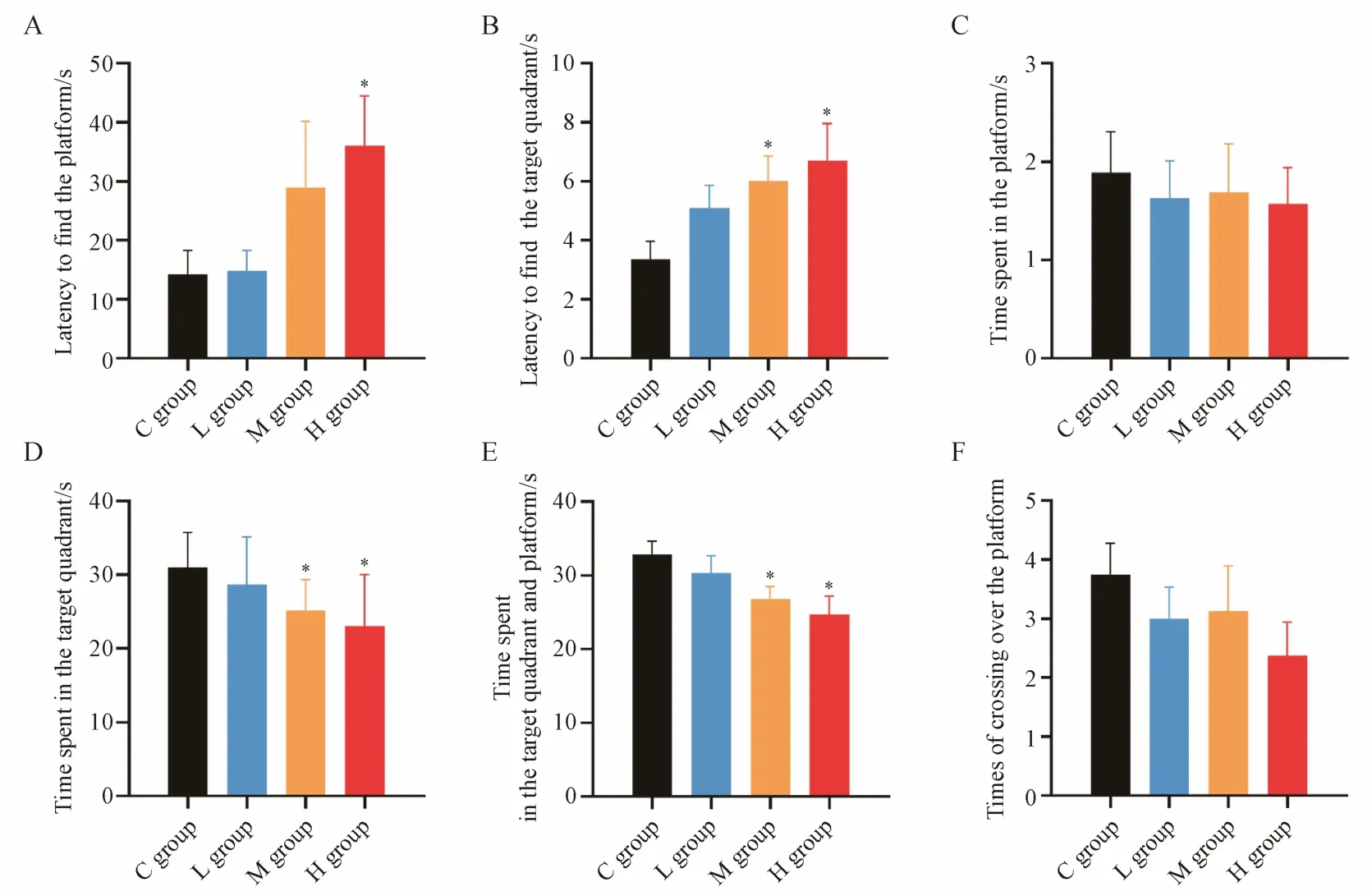
如图4 所示,灌胃给予朱砂14 周后,与对照组比较,低、中、高剂量组大鼠平台停留时间略有缩短,平台穿越次数减少,但无显著差异;平台潜伏期与目标象限潜伏期随朱砂给药剂量升高而延长,相较于对照组,中剂量组大鼠平台潜伏期有显著差异(P< 0.05),高剂量组大鼠平台潜伏期与目标象限潜伏期均有显著差异(P< 0.05);目标象限停留时间与目标象限停留总时间则随朱砂给药剂量升高而缩短,相较于对照组,中、高剂量组大鼠均有显著差异(P< 0.05)。长期给予高剂量朱砂可导致大鼠记忆功能受损,剂量越高,对记忆功能的影响越大。
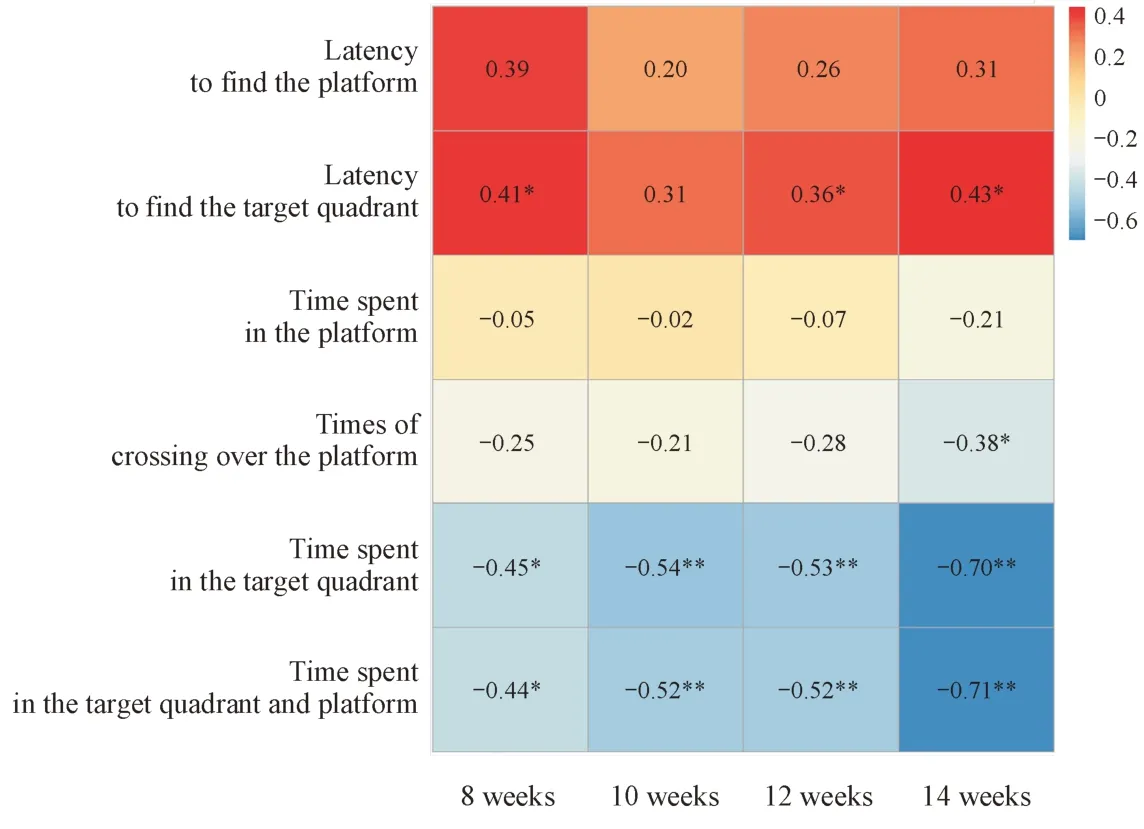
3.5 朱砂与记忆功能障碍的剂量-血汞暴露量-毒性效应相关性分析
对给药剂量和不同发育阶段各组大鼠的血汞暴露量进行Spearman 相关性分析;对各发育阶段血汞暴露量与水迷宫实验指标进行Pearson相关性分析,结果如图5 所示。结果表明,给药8 ~ 14 周,大鼠血汞暴露量与朱砂剂量的Spearman 相关系数分别为0.87、0.94、0.95 和0.93,呈现极强的正相关(r> 0.87,P< 0.01)。目标象限潜伏期与给药8周、12周、14周的血汞暴露量呈现弱到中等程度的正相关(0.36 Figure 3 Effects of Cinnabaris on rats’ morphological features of hippocampal pyramidal neurons by HE staining (× 200) Figure 4 Effects of Cinnabaris on rats’ memory functions (± s, n = 8) 由于朱砂含有大量重金属汞,其临床使用安全性备受关注。欧美等国家和地区对含朱砂中药按化学药品重金属杂质进行严格的总汞量控制,并警告公众警惕其质量不合格以及潜在的毒性风险[14-15]。但是从化学角度分析,朱砂属于共价化合物,极难溶于水,不易被人体吸收,用总汞量评价朱砂难免会高估其健康风险。本组前期朱砂体外溶出研究表明,在模拟胃肠液中朱砂的生物可利用汞含量仅为0.12 µg/g[16],在医生指导下使用,相对安全。但简单的体外实验不能完全模拟复杂的体内过程,因此以体内汞暴露量评估朱砂的汞中毒风险更为科学合理。由于体内过高的汞暴露会严重损伤儿童的记忆功能,而朱砂引起的儿童汞暴露风险评估却鲜有报道,《中华人民共和国药典》对含朱砂儿童专用制剂也缺乏明确的安全限量。因此本实验以幼年大鼠为对象,围绕给予朱砂后体内汞暴露量与记忆功能损伤展开研究,为含朱砂儿童专用制剂的合理使用提供科学指导。 为了监测给予朱砂后大鼠体内汞暴露水平,需要选择准确可靠,容易获得的生物样本进行检测。常用于评价机体汞暴露水平的生物样本有血液、尿液和毛发[17]。本组前期研究显示,成年大鼠灌胃朱砂后,极少量的汞能被吸收进入血液,并分布至脑、肝、肾等组织中,并且脑组织中的汞含量随血汞暴露量上升而增加[10]。此外,血样可及性高、易采集,本研究选择血液作为生物样本,用于评估大鼠体内的汞暴露水平。血液中95%左右的巯基存在于红细胞,由于Hg2+对巯基有高度的亲和力,可迅速结合红细胞,同时又可与血浆蛋白结合,选择全血作为研究汞在血液中动态变化规律的检测对象,使得汞暴露水平监测更加准确可靠。血汞暴露量检测结果表明,大鼠血汞暴露量呈时间和剂量依赖式增高。前期研究表明,全血与脑组织中汞均表现出消除缓慢的特征[10],因此在多次给予高剂量朱砂后,汞极易在脑中蓄积,极大地增加了朱砂对中枢神经系统的健康风险。 海马是大脑组织中负责记忆的关键区域,根据神经元形态与排布关系,海马通常被分为CA1、CA2、CA3和DG 区。海马神经元从内嗅区发起,沿穿缘通路投射于齿状回(dentategyrus,DG)颗粒细胞与CA1 区锥体细胞;DG 区颗粒细胞再通过苔状纤维通路投射于CA3 区锥体细胞;最后由CA3 区锥体细胞发出轴突,通过Schaffer 通路投射至CA1 区锥体细胞,由此构成了海马的三突触回路。三突触回路是记忆形成的结构基础,其中任何环节突触联系的损伤都会影响记忆功能。因此,本研究重点考察了各组大鼠海马HE 染色中CA1 区、CA3区与DG 区神经元的形态变化,以评价朱砂对记忆功能相关组织结构的影响。病理检查结果表明,朱砂对DG 区颗粒细胞形态影响较小;而随着朱砂剂量增高,低剂量组大鼠脑组织CA3 区锥体细胞出现轻微核固缩,中、高剂量组大鼠脑组织CA1 区与CA3 区锥体细胞的病变程度依次加重,呈现剂量依赖性,且CA3 区较CA1 区更为严重。海马组织各区域病变程度的不同可能与神经元类型对汞暴露的敏感程度及组织内汞局部暴露浓度差异有关。 Figure 5 Heatmap of Pearson correlation coefficients between in-vivo mercury exposure at different growth phases andevaluation indicators of Morris water-maze test (n = 8) Morris 水迷宫实验广泛应用于评价动物的空间学习记忆功能。结果表明,朱砂低剂量组大鼠在水迷宫实验中与对照组大鼠无明显差异,而朱砂中、高剂量组大鼠的平台与目标象限潜伏期依次延长,平台与目标象限停留时间依次缩短,且多数指标与对照组大鼠有显著差异,并呈现剂量依赖性。HE 染色与Morris 水迷宫实验的结果,分别从组织结构与记忆功能的角度,共同验证了长期高剂量的朱砂摄入能够引起记忆功能障碍的结论。 对朱砂和记忆功能障碍之间的剂量-血汞暴露量-毒性效应关系进行相关性分析,结果表明,朱砂剂量与各个发育阶段的血汞暴露量之间均存在极强的正相关性,而血汞暴露量与水迷宫实验中的4个指标都存在显著的相关性。由此可以证明,体内过高的汞暴露是朱砂引起记忆功能障碍的主要危险因素,且记忆功能障碍程度与朱砂呈现出剂量-血汞暴露量-毒性效应依赖式增加。 综上所述,幼年大鼠长期超剂量给予朱砂后,体内汞暴露水平增高,血液中的汞能透过血脑屏障侵入脑组织,破坏海马组织正常形态结构,影响记忆功能。因此,在含朱砂儿科制剂的临床使用过程中,应防止超剂量长时间服用,以避免朱砂中汞对儿童大脑记忆功能的损害。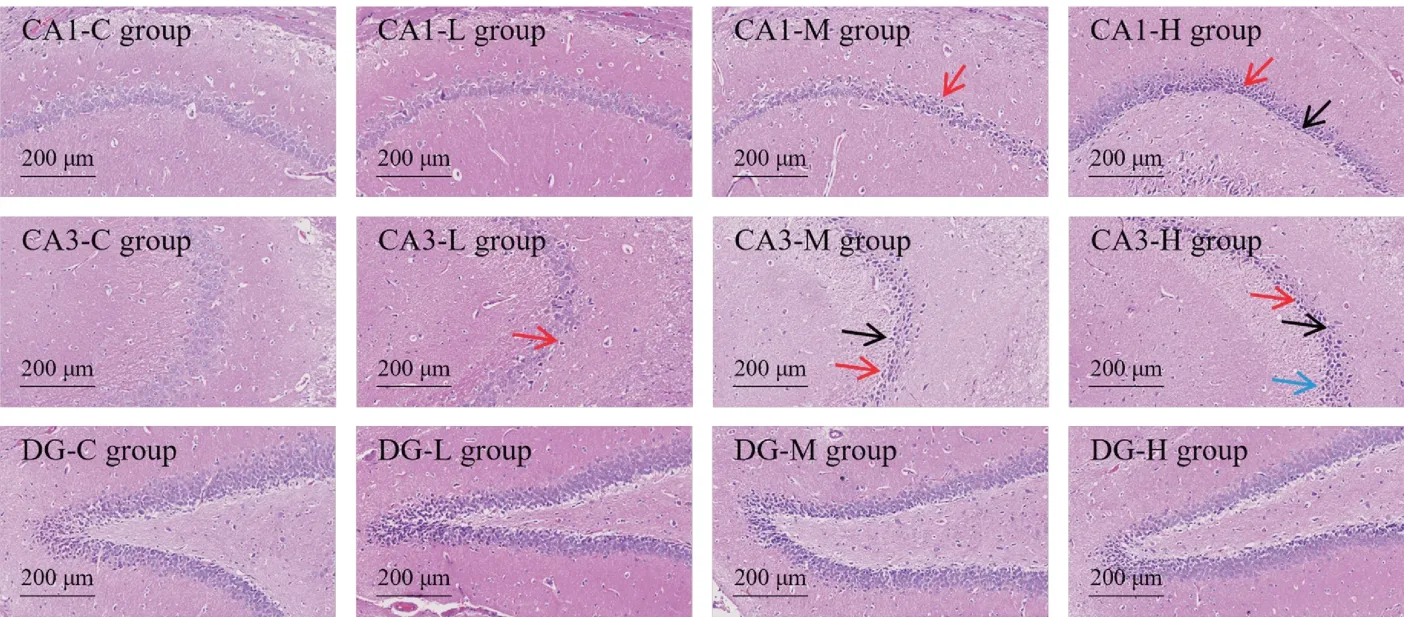
4 讨 论