口服新型降糖多肽ODA的设计及其口服降糖活性
安东贤,姚文兵,高向东,田 浤
(中国药科大学生命科学与技术学院 江苏省生物药物成药性研究重点实验室,南京 211198)
GLP-1 由小肠L 细胞分泌产生,经GLP-1R 介导,以葡萄糖依赖的方式作用于胰岛β 细胞,促进胰岛素分泌[1],刺激β细胞的增殖和分化,抑制β细胞的凋亡,从而增加胰岛β 细胞的数量[2],抑制胰岛α 细胞分泌胰高血糖素[3],降低肝脏糖异生[4]和肝脏脂肪贮存量[5],还能减少肠蠕动、抑制胃排空[6]、降低食欲,有助于控制摄食,减轻体重[7]。GIP由小肠K 细胞合成和分泌,与GIPR 结合后发挥生物学效应[8]。GIP 既可以在高血糖条件下促进胰岛素分泌,也可以在低血糖条件下促进胰高血糖素分泌,因此可作为双功能多肽对血糖水平进行调控,防止血糖过度波动[9]。GIP 还能促进糖尿病模型鼠的胰岛β 细胞生长分化与存活[10]。长期使用GIP 受体激动剂或者过表达GIP 的小鼠糖代谢得到改善,且无体重增加的不良反应[11-12]。GLP-1 和GIP 也被称为肠促胰岛素分泌肽,简称肠促肽[13]。目前认为,GLP-1 和GIP 这两种内源性多肽发挥了餐后促胰岛素分泌的大部分作用[14],使得GLP-1R和GIPR成为了治疗2型糖尿病的良好靶点。
在目前的糖尿病治疗中,肠促肽类降糖药物占据了重要地位,其中以GLP-1R 激动剂为主[15]。由于糖尿病是一种复杂的综合代谢性疾病,针对单一靶点的治疗药物往往具有局限性,而能够靶向多种靶点以实现协同效应的治疗药物不仅能使疗效最大化,还能降低不良反应[16]。礼来制药公司研发的Tirzepatide(LY3298176)是1 周注射1 次的GLP-1R/GIPR 双激动剂,已经获得FDA 批准上市,用于治疗2 型糖尿病。在与索马鲁肽头对头的临床试验比较中,高、中、低剂量组Tirzepatide 的降糖效果均优于索马鲁肽[17]。在减重方面,高剂量的Tirzepatide 效果优于索马鲁肽[18]。然而Tirzepatide和市场上绝大多数治疗2 型糖尿病的受体激动剂药物一样,通过皮下注射给药,降低了患者的依从性[19]。目前,丹麦诺和诺德公司研制的口服索马鲁肽(oral semaglutide,Rybelsus®)是市面上唯一一款可口服的GLP-1R 激动剂,但是其在人体内的绝对生物利用度只有1%[20],因此开发患者依从性较高的口服肠促肽受体激动剂具有良好的应用前景。
本实验室前期基于GLP-1R 激动剂Exendin-4的结构特征,利用计算机辅助设计得到了具有降糖活性的口服GLP-1R 激动剂OHP2[21]。与口服索马鲁肽不同,OHP2 无促吸收剂单独给药即可被口服吸收,在糖尿病小鼠模型中表现出了良好的药效,如降低血糖、减少体质量和缓解高血脂等[22]。本研究为进一步优化OHP2的治疗潜力,在保留了其降糖活性和口服吸收能力的基础上,引入了GIP的活性位点,以期为临床提供更多的可口服降糖多肽候选分子。
1 材 料
1.1 试 剂
DMEM 高糖培养基、DMEM/F-12 培养基(美国Gibco 公司);胰蛋白酶、G418(美国Sigma-Aldrich公司);胎牛血清(FBS,美国CLARK Bioscience 公司);Exendin-4(上海吉尔生化有限公司);OHP2(南京金斯瑞生物科技有限公司);ODA(合肥森尔生物科技有限公司);异硫氰酸荧光素(异构体Ⅰ,FITC,上海阿拉丁生化科技股份有限公司);Pierce BCA 法蛋白测定试剂盒(美国Thermo Scientific 公司);牛血清白蛋白(BSA,广州赛国生物科技有限责任公司);氨苄青霉素、链霉素、潮霉素(上海生工生物工程有限公司);Steady-Glo®Luciferase Assay System(美国Promega 公司);RIPA(强)裂解液(上海碧云天生物技术有限公司)。其他试剂均为市售分析纯。
1.2 动 物
C57BL/6JGpt 雄性小鼠(5 周龄),SPF 级,购自杭州子源实验动物科技有限公司,合格证号:SCXK(浙)2019-0004。所有动物实验均符合中国药科大学动物伦理委员会标准。
1.3 细胞株
CHO-GLP-1R-Luc(A11A)细胞株、人结直肠腺癌细胞株Caco-2 由中国药科大学江苏省生物药物成药性研究重点实验室保存。
1.4 仪 器
AccuriC6 Plus 流式细胞仪(美国BD 公司);Infinite 200Pro多功能荧光酶标仪(瑞士Tecan公司);ERS-2 细胞电阻仪(美国Merck Millipore 公司);血糖仪(三诺生物传感股份有限公司)。
2 方 法
2.1 ODA序列设计和结构特征
2.1.1 ODA 序列设计 基于OHP2 的结构,引入GIP 活性位点,同时OHP2 耐酶解位点保持稳定,得到增强GIP 激动活性的ODA 序列(由合肥森尔生物科技合成)。从RCSB PDB 蛋白质数据库(https://www. rcsb. org)获取Exendin-4 和GLP-1 受体胞外结构域的PDB 文件(5OTT)、GIP 和GIP 受体胞外结构域的PDB 文件(2QKH),利用MOE(Molecular Operating Environment)分子操作系统和Rosetta Design 在线设计服务系统(http://rosettadesign.med.unc.edu)进行亲和力打分计算。
2.1.2 圆二色光谱(CD)检测ODA 的二级结构使用去离子水溶解样品至0.5 mg/mL,用圆二色光谱仪Jasco J-810,在室温下以1 nm 分辨率,50 nm/min的扫描速度在190 ~ 250 nm 范围内对样品进行检测。
2.1.3 SWISS-MODEL 模拟ODA 的三级结构 利用蛋白质结构服务器SWISS-MODEL(http://swissmodel.expasy.org)进行同源建模,ODA 和OHP2 均以Exendin-4 为模板序列,选择全球性模型质量估测(GMQE)值最高的建模结果。
2.2 ODA的入胞能力研究
2.2.1 流式细胞术法检测ODA 在Caco-2 细胞中的入胞能力 细胞铺板:Caco-2 细胞密度为每毫升1 × 105个细胞。细胞给药:每孔加入FITC 标记的ODA 5 µg,孵育2 h。细胞清洗:获取细胞并清洗后用200目细胞过滤网过滤。流式细胞术检测:经阴性对照管确定细胞群所在位置后,检测阴性对照管的荧光强度,并据此设立FITC 阴性门和FITC阳性门。
2.2.2 荧光酶标仪法检测ODA 在Caco-2 细胞中的入胞能力 细胞培养铺板和给药方法同“2.2.1”项。细胞裂解:每孔加入RIPA 细胞裂解液30 µL,室温置于摇板机上350 r/min 裂解5 min。FITC 标记ODA 含量测定:使用多功能荧光酶标仪测定FITC 标记的ODA 荧光强度,条件为激发波长488 nm,发射波长525 nm。细胞总蛋白含量测定:BCA 试剂盒检测每孔内总蛋白浓度。计算每孔FITC 标记的ODA 的含量与细胞总蛋白含量的比值。
2.3 ODA的跨膜转运能力研究
2.3.1 细胞培养 细胞铺板:Caco-2 细胞密度为每毫升1 × 105个细胞,每孔接种单细胞悬液250 µL于Transwell上室,下室加完全培养基1.5 mL,培养21 d。细胞给药:使用细胞电阻仪测定细胞跨膜电阻,选取跨膜电阻在200 ~ 1 000 Ω/cm2的孔[23],在上室加入FITC 标记的ODA(0.2 mg/mL)。孵育8 h,每隔1 小时从下室取样100 µL,然后向下室补充HBSS缓冲液100 µL。
2.3.2 跨膜转运量测定 使用多功能荧光酶标仪测定下室中FITC 标记的ODA 荧光强度,检测条件为激发波长488 nm,发射波长525 nm。
2.4 ODA的体外生物活性研究
2.4.1 荧光素酶报告基因法评价ODA 对GLP-1R的激活能力 细胞培养:使用含10%胎牛血清、潮霉素B、G418 的DMEM/F12 培养基培养A11A 细胞。细胞铺板:A11A 细胞密度为每毫升2 × 105个细胞,培养4 h。细胞给药:ODA 初始浓度为4 800nmol/L,按4倍倍比梯度稀释得到9个浓度,每孔加入药物20 µL,孵育4 h。化学发光强度测定:每孔加入Steady-Glo 100 µL,350 r/min 振荡15 min。振荡结束后每孔吸取样品180 µL 转移至全白酶标板,使用多功能酶标仪测定化学发光强度。
2.4.2 分子对接模拟ODA 与GIPR 结合能力 靶标分子预处理:从RCSB PDB 蛋白质数据库(https://www. rcsb. org)下载GIP 和GIP 受体胞外结构域的PDB文件(2QKH),选择Quick Prepare 对分子进行加氢去水并赋予电荷,修正PDB 结构缺陷。定义活性位点(site)以确定配体分子结合部位。配体分子预处理:通过MOE 同源建模获得配体分子的PDB 文件,加氢去水并赋予电荷。分子对接:选择蛋白-蛋白对接以半柔性对接方法计算结果。
2.5 ODA在小鼠体内的降糖活性研究
2.5.1 实验动物 选取5 周龄的C57BL/6J 雄性小鼠饲养一个星期适应环境。正式实验前小鼠需禁食16 h,并将小鼠随机分组并称重标记。
2.5.2 药物配制 3%碳酸氢钠溶液,Exendin-4溶液(0.02 mg/mL),葡萄糖溶液(0.2 g/mL),OHP2溶液(0.424 mg/mL),ODA 溶液(0.848 mg/mL,0.424 mg/mL,0.212 mg/mL)。
2.5.3 给药测定 阳性对照组皮下注射给药Exendin-4 溶液(0.10 mg/kg),实验组OHP2 溶液(0.424 mg/mL)和ODA 溶液(0.848 mg/mL,0.424mg/mL,0.212 mg/mL)用3% NaHCO3溶液稀释4 倍,口服灌胃给药。每组小鼠给药时刻记为-30 min,0 min 时按2 g/kg 的剂量给每组小鼠腹腔注射葡萄糖溶液,用血糖仪测量小鼠血糖值。
3 结 果
3.1 ODA序列设计和结构特征
基于GLP-1(HAEGTFTSDVSSYLEGQAAKEFIAWLVKGRG)、GIP(YAEGTFISDYSIAMDKIHQQDFVNWLLAQKGKKNDWKHNITQ) 、 Exendin-4(HGEGTFTSDLSKQMEEEAVRLFIEWLKNGGPSS -GAPPPS)和OHP2(HGEGTFTSDLSSQMEEEAVKEFIEWLVNGGPSSGAPPPSC)的分子结构,在保留OHP2 良好的抗酶解活性以及口服GLP-1R 激动活性的前提下,通过进一步引入GIP 的活性位点,本实验设计了一条新型口服降糖多肽——ODA。通过Rosetta Design 评估其对GLP-1 和GIP 两个受体的亲和力,亲和力强度与打分绝对值呈正相关。打分结果显示,与OHP2 相比,ODA 保留了GLP 结合能力,同时提高了GIP受体亲和力。(表1)。
为了得到ODA 的二级结构信息,本实验对ODA 的CD 谱进行分析。如图1-A 所示,与Exendin-4 和OHP2 的谱线相似,ODA 的谱线在193 nm附近处出现明显的正峰,在208 nm 和222 nm 处出现2 个负峰,表明这3 种分子的二级结构以α 螺旋为主。此外,ODA 的谱线向短波长方向移动,即发生蓝移,表明ODA 的疏水性增加,亲水性降低。提示ODA 有较好的亲脂性,能够较容易地与细胞膜产生接触。
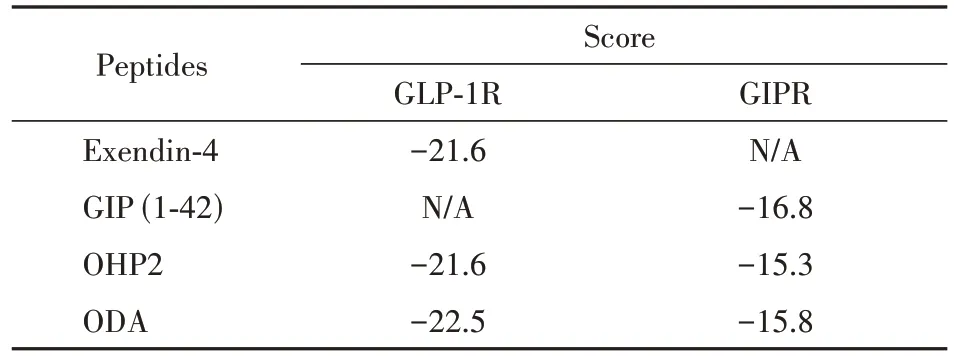
Table 1 Affinity values of ODA and related peptides for GLP-1R and GIPR
本实验通过SWISS-MODEL 模拟预测ODA 的三级结构,由于序列的同源相似性,ODA 和OHP2的三级结构模拟均以Exendin-4 为模板序列。Exendin-4,OHP2 和ODA 的GMQE 分别为0.71,0.73 和0.68。如图1-B 所示,ODA 的三级结构在突变位点处与Exendin-4,OHP2均有一定差异。
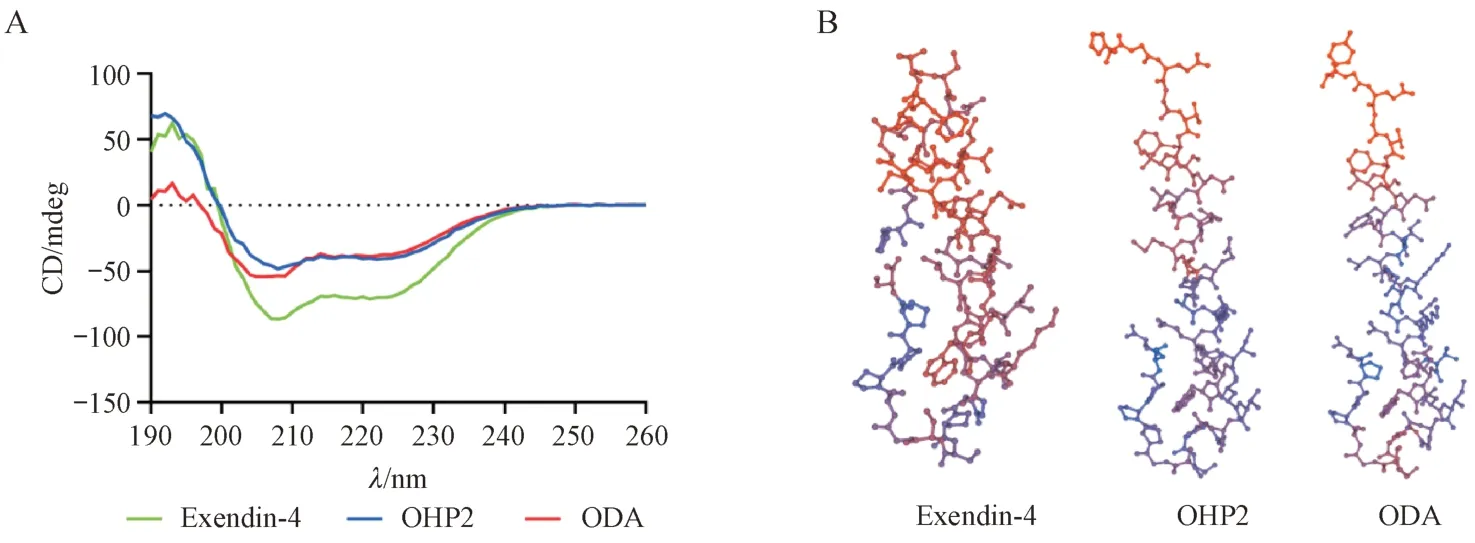
Figure 1 Determination of Exendin-4, OHP2 and ODA
3.2 ODA的胞吞能力优于OHP2
为了评价ODA 的胞吞能力,对ODA 进行了流式细胞术和荧光酶标仪法分析。如图2-A 所示,与阴性对照Exendin-4 相比,ODA 组的FITC+细胞率显著提高(P< 0.01)。荧光酶标仪结果显示,孵育2 h 后每毫克细胞总蛋白中FITC 标记的ODA 含量(5 055.0 ± 1 299.1 ng/mg)显著高于OHP2 组(2 836.4 ± 471.1 ng/mg)(P< 0.01)(图2-B)。这些结果表明,在Caco-2 细胞中,ODA 比OHP2 的入胞能力更强。
3.3 ODA的转胞吞能力优于OHP2
本实验通过Transwell法考察ODA在单层细胞模型上的跨膜转运水平。结果如图3-A所示,在1、2、3、4和8 h的5个采样点,ODA组在下室中的浓度明显高于Exendin-4 组和OHP2 组。孵育8 h 后,下室中ODA 的质量浓度为(96.7 ± 6.3 ng/mL),显著高于Exendin-4 组(53.6 ± 2.5 ng/mL)(P< 0.0001)和OHP2组(76.6 ± 4.3 ng/mL)(P< 0.01)(图3-B)。这些结果显示,在Caco-2 细胞的Transwell 单层细胞模型中,ODA具有更强的跨膜转运能力。

Figure 2 Endocytosis of Exendin-4, OHP2 and ODA in Caco-2 cells
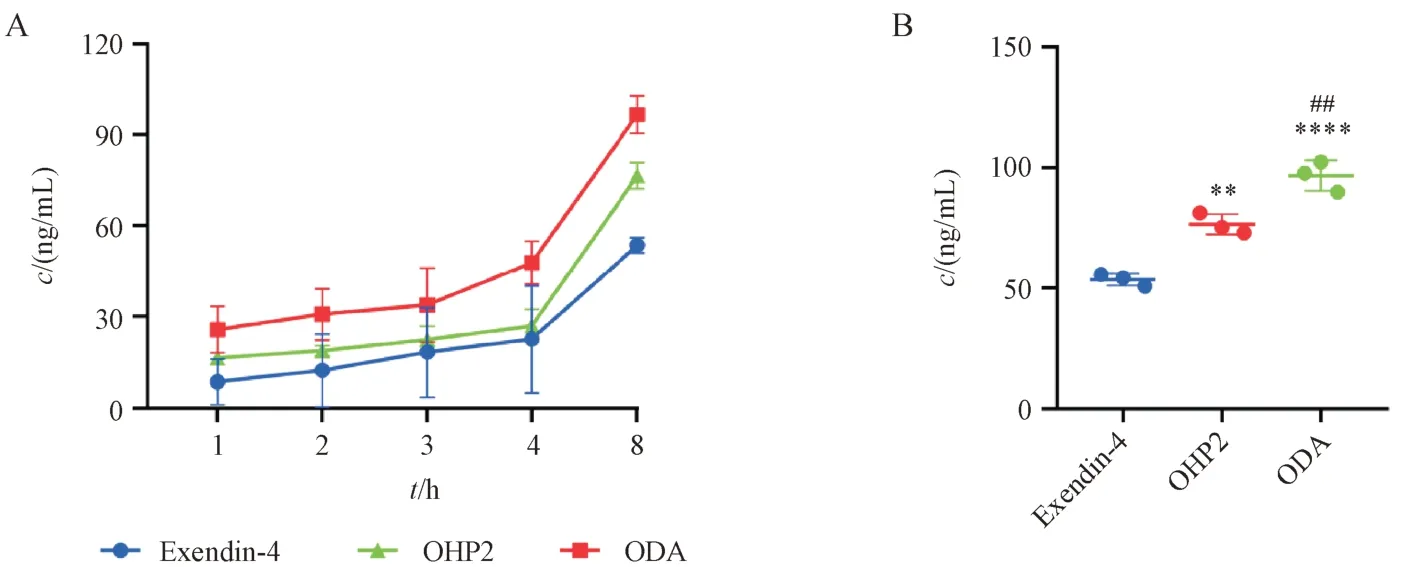
Figure 3 Transcytosis of Exendin-4, OHP2 and ODA in Caco-2 cells (± s, n = 3)
3.4 ODA保留了GLP-1R激动活性并可结合GIPR
本实验采用荧光素酶报告基因法评估了ODA对GLP-1R 的激活能力,结果如图4-A 所示,Exendin-4、OHP2 和ODA 均呈剂量依赖性地激活GLP-1R下游信号通路,促进了荧光素酶的表达。OHP2和ODA 激活GLP-1R 的EC50分别为4.540 和5.506 nmol/L,虽然ODA 的EC50比OHP2 略高,但和其处在同一数量级上,表明ODA 保留了对GLP-1R的激动活性。利用MOE 将ODA 与GIPR 胞外结构域进行分子对接模拟,预测ODA 与GIPR 的结合模式与相互作用。结果如图4-B 所示,GIPR 分子表面以亲水亲脂性展示,ODA 序列中的15Asp,16Lys,19Gln,20Lys,24Gln,26Leu 与GIPR 形成了较强的氢键,稳定了ODA 与GIPR 的结合,提示ODA 具有潜在的GIPR激动能力。
3.5 ODA在小鼠体内的降糖活性优异
选取健康C57BL/6J 小鼠,通过腹腔注射葡萄糖耐量试验(IPGTT)考察口服不同剂量ODA 对血糖的控制作用,以皮下注射Exendin-4 组为阳性对照,ODA 单次口服给药的糖耐量试验结果如图5-A所示,与PBS 组相比,口服高、中、低剂量的ODA后,小鼠血糖值相对于基础值的偏移显著降低,血糖时间曲线中峰值明显变低,曲线下面积显著减小。各组血糖时间曲线下面积计算结果显示,高剂量组(922.6 ± 93.7 mmol/L·min)、中剂量组(1 021.9 ± 84.8 mmol/L·min)和低剂量组(1 035.1 ± 152.0 mmol/L·min)的 AUC 同样显著低于PBS 组(1 322.3 ± 99.5 mmol/L·min)(P<0.000 1)(图5-B)。另一方面,口服ODA 高、中、低剂量组与口服OHP2 组(952.1 ± 81.5 mmol/L·min)相比,曲线下面积无显著性差异。这些结果表明,口服低剂量ODA(0.53 mg/kg)能达到与口服OHP2(1.06 mg/kg)相当的降糖水平,提示ODA 具有较好的血糖控制能力。
Figure 4 ODA binding ability to GLP-1R and GIPR in vitro

Figure 5 IPGTT of ODA in healthy mice (± s, n = 8)
4 讨 论
口服索马鲁肽是目前市场上唯一一款可口服的GLP-1R 激动剂,依赖促吸收剂N-[8-(2-羟基苯甲酰基)-氨基]辛酸钠(SNAC)才能实现口服吸收。SNAC 可在胃部升高局部区域的pH,通过短期局部缓冲作用保护索马鲁肽防止胃蛋白酶的降解[24]。同时SNAC 具有亲脂性,能够有效地插入到上皮细胞膜中,轻微改变细胞膜的流动性,促进索马鲁肽的跨细胞转运[25]。因此SNAC 只能短暂地促进吸收,口服索马鲁肽的绝对生物利用度依然较低,仅有0.4% ~ 1%[26]。本实验室前期工作中设计得到的OHP2 与之相比更有优势,单独给药即有1.31%的绝对生物利用度,并且结构简单,无非天然氨基酸引入和侧链脂肪酸修饰等[22]。
综合代谢性疾病如肥胖和糖尿病等通常具有异质性和并发性等特点,单一靶点药物治疗有一定局限性[27]。因此本研究利用RCSB PDB 蛋白数据库,MOE 和Rosetta Design 软件在OHP2 的结构基础上引入了GIP的活性位点,得到新型口服降糖多肽ODA。通过CD 光谱和SWISS-MODEL 研究了ODA 的分子结构,发现ODA 与Exendin-4 和OHP2相比,其亲水性降低,亲脂性增加,三级结构也有一定差异。通过流式细胞术和荧光酶标仪研究ODA 的入胞能力,虽然ODA 入胞的阳性细胞率小于OHP2组,但是入胞量即每毫克总蛋白中的ODA含量却几乎是OHP2 的两倍,结果表明ODA 的胞吞作用更强。并且通过Caco-2 细胞构建Transwell单层细胞肠道吸收模型研究ODA 的跨细胞转运能力,与入胞能力研究实验结果一致,ODA 的跨细胞转运量显著高于Exendin-4 组和OHP2 组。这些结果表明ODA 的口服吸收能力显著优于OHP2。利用基于A11A 细胞的荧光素酶报告基因法研究ODA 对GLP-1R 的激动活性,虽然ODA 的EC50比OHP2 略高,但仍处于同一数量级,表明ODA 较好地保留了对GLP-1R 的激活能力。利用MOE 进行了ODA 与GIPR 的分子对接,模拟了二者结合的空间状态和相互作用,ODA 序列中多个氨基酸位点与GIPR 形成了较强的氢键,表明ODA 能与GIPR结合且较为稳定。通过IPGTT 实验研究ODA 在健康小鼠体内的血糖控制能力,结果表明,口服低剂量ODA 即可发挥优异的降糖活性,展现出口服ODA治疗2型糖尿病的巨大潜力。
综上所述,本研究设计得到的口服ODA 保留了OHP2 对GLP-1R 的激活能力,增强了与GIPR 的结合能力,从而服用小剂量ODA 即可达到降糖疗效。此外,简单的分子结构不仅更易于工业化生产,还能避免过度修饰带来的生物安全隐患。未来,口服ODA 将为糖尿病患者提供更安全、更便利、更有效的用药选择。

