非酒精性脂肪性肝病细胞模型中胆固醇代谢紊乱机制
章玉婷,王安慧,杨晋妮,林佳纯,田 媛,董海娟,张尊建,宋 瑞*
(1中国药科大学药物质量与安全预警教育部重点实验室,南京 210009;2中国药科大学公共实验室平台,南京 210009)
非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)是一种与2 型糖尿病、肥胖和心血管疾病密切相关的代谢综合征。它包含一系列肝脏病理特征,从以肝脏总胆固醇和甘油三酯水平升高为主要特征的单纯脂肪变性,到更为严重的伴随继发性炎症和线粒体功能障碍的非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH),最后发展为不可逆转的肝硬化甚至肝细胞癌[1-4]。近年来,受高脂高糖饮食和久坐不动等不良生活方式的影响,NAFLD 患病率已高达25%且仍呈现逐年升高趋势[5]。然而,目前还没有获得美国食品药品监督管理局(FDA)批准的药物用于临床[6]。因此,亟须深入了解疾病发病机制并寻找有效的治疗靶点。
肝脏是胆固醇生物合成的主要部位,胆固醇可转化为胆汁酸(bile acids, BAs)、维生素和类固醇,也可酯化生成胆固醇酯后以脂滴的形式储存,以维持细胞内的胆固醇稳态[7-8]。一项横断面研究发现,NAFLD 患者血清和肝脏中甘油三酯(triglyceride,TG)和总胆固醇(total cholesterol,TC)水平显著升高[9],此外,肝活检组织的脂质组学分析结果表明,单纯脂肪变性和NASH 患者肝脏中游离胆固醇累积[10]。动物实验研究表明,高脂高胆固醇饮食喂养foz/foz小鼠可诱导其肝脏胆固醇积聚,导致脂肪性肝炎和肝纤维化的产生,而降低肝脏胆固醇水平可改善肝脏疾病的严重程度[11]。另外,胆固醇累积还会影响线粒体和内质网(endoplasmic reticulum,ER)的功能,诱导肝细胞凋亡和坏死,最终导致肝脏损伤加剧[12-13]。这些研究表明,肝脏胆固醇代谢失调与NAFLD/NASH 疾病的发生发展密切相关[14]。
有文献报道棕榈酸(palmitic acid,PA)诱导的L02脂肪变性细胞模型中胆固醇水平升高,并发现胆固醇生物合成相关的基因表达显著增加[15]。但影响细胞内胆固醇稳态的其他因素,如胆固醇摄取、转化和储存的相关基因和蛋白表达情况是否发生变化还尚未见相关研究报道。因此,本研究基于PA 构建的HepG2 脂肪变性细胞模型,从基因、蛋白和代谢物水平系统研究NAFLD 状态下细胞内胆固醇稳态的变化,为基于胆固醇稳态调控治疗NAFLD提供有益参考。
1 材 料
1.1 试 剂
棕榈酸钠、二甲基亚砜(DMSO)(美国Sigma-Aldrich 公司);CCK-8(上海百赛生物技术有限公司);DMEM 高糖培养基、胰蛋白酶和PBS(美国Gibco 公司);胎牛血清(FBS,以色列Biological Industries 公司);牛血清白蛋白(free-fatty acid,BSA,索莱宝生物科技有限公司);甘油三酯和总胆固醇测定试剂盒(南京建成生物工程研究所);Trizol、HiScrip Ⅲ qRTSuperMix 和AceQ qPCR SYBR Green Master Mix(南京诺唯赞医疗科技有限公司);RIPA 裂解液、PMSF、Triton X-100、油红O 染色试剂盒、增强型BCA 蛋白检测试剂盒、SDSPAGE 制备试剂盒(碧云天生物技术有限公司);CHOP 和GRP78 一抗(美国Affinity 公司);STARD1、LXRα、ABCG5 和β-actin 一抗(武汉爱博泰克公司);丁基羟基甲苯(BHT,上海阿拉丁生化科技股份有限公司);(2, 2, 4, 4-d4)-胆酸(CA-d4)(美国Cambridge Isotope Laboratories 公司);(2, 2,4, 4-d4)-石胆酸(LCA,美国Glpbio 公司);其他试剂均为市售分析纯。
1.2 仪 器
Infinite 200Pro 多功能酶标仪(瑞士Tecan 有限公司);Light Cycler96 实时荧光定量PCR 仪(美国罗氏公司);化学发光成像系统(上海Tanon 公司);JY92-IIN超声波细胞粉碎机(宁波新芝生物科技公司);UPLC-MS/MS 8040 液质联用色谱仪(日本Shimadzu 公司),包含LC-30AD 泵、SIL-30AD 自动进样器、CTO-20A 柱温箱、DGU-20A5R 脱气机、CMB-20A 系统控制器、MS-8040 三重四极杆质谱检测器;FinniganTMTSQ Quantum Discovery MAX 液相三重四极杆质谱联用系统(赛默飞世尔科技有限公司),包括Surveyor 液相色谱仪,Surveyor 自动进样器, TSQ Quantum三重四极杆质谱仪。
1.3 细胞株
人肝癌细胞系HepG2 细胞购自科佰生物科技有限公司。
2 方 法
2.1 PA-BSA溶液制备
称取一定量的棕榈酸钠,加入适量纯水,于70 ℃下加热至完全溶解,配制成100 mmol/L 棕榈酸溶液。然后用含2% BSA 的DMEM(含1% FBS)溶液稀释,配成浓度为1.5 mmol/L 的PA-BSA 储备液[16],0.22 µm 滤膜过滤除菌后待用。使用前用培养基稀释至所需浓度。
2.2 细胞培养
HepG2 细胞用含10% FBS 的高糖DMEM 完全培养基,于5% CO2、37℃培养箱中培养,显微镜下观察细胞状态及密度,融合至80% ~ 90%时,采用胰蛋白酶消化,按1∶2/1∶3进行传代。
2.3 细胞活力检测
选择处于对数生长期的HepG2 细胞,以每孔8 × 103个细胞的密度接种至96 孔板中,培养12 h使细胞贴壁,然后更换成含1% FBS 的DMEM 培养基饥饿12 h,随后用不同浓度的PA(0.075, 0.15,0.3 mmol/L)分别处理细胞24、48和72 h,每个浓度组均分别设置对照组(含细胞)和空白组(不含细胞),加入对应体积的2% BSA 处理相同时长,每组设6个复孔,平行实验3次。处理结束后,每孔加入CCK-8 试剂10 µL,于37 ℃避光孵育3 h,在450 nm处测定吸收度并计算细胞存活率。
2.4 油红O染色
取生长状态良好的HepG2 细胞接种于6 孔培养板中,完全培养基培养12 h后,饥饿12 h,弃去培养基,用0.3 mmol/L PA处理72 h,对照组加入相同体积的2% BSA。处理结束后,按照改良油红O 染色试剂盒说明书操作,并在倒置显微镜下观察细胞内脂质累积情况。
2.5 细胞内TC、TG含量测定
将HepG2 细胞接种于6 孔板中,同方法“2.4”项下分组且对应处理72 h,每组设置6 个复孔。处理结束后,收集细胞,加入适量1% Triton X-100 于冰上裂解40 min,按照试剂盒说明书操作测定细胞内TC和TG含量,测定结束后,于4 ℃,14 000 r/min,离心20 min,用BCA 法测定上清液中的蛋白质含量(mg/mL),以对数据进行归一化处理。
2.6 实时荧光聚合酶链式反应(RT-qPCR)
采用Trizol 试剂提取培养细胞的总RNA,按照逆转录试剂盒说明书操作去除基因组DNA,并在37 ℃,15 min、85 ℃,5 s 的条件下合成cDNA。由SYBR Green master mix 5 µL、引物(0.5 mmol/L)1 µL、cDNA 2.5 µL 和ddH2O 1.5 µL 组成10 µL 体系进行PCR 反应。以GAPDH 为内参对照,用2-ΔΔCt法计算基因表达倍数变化。实验中所使用的引物如表1所示。
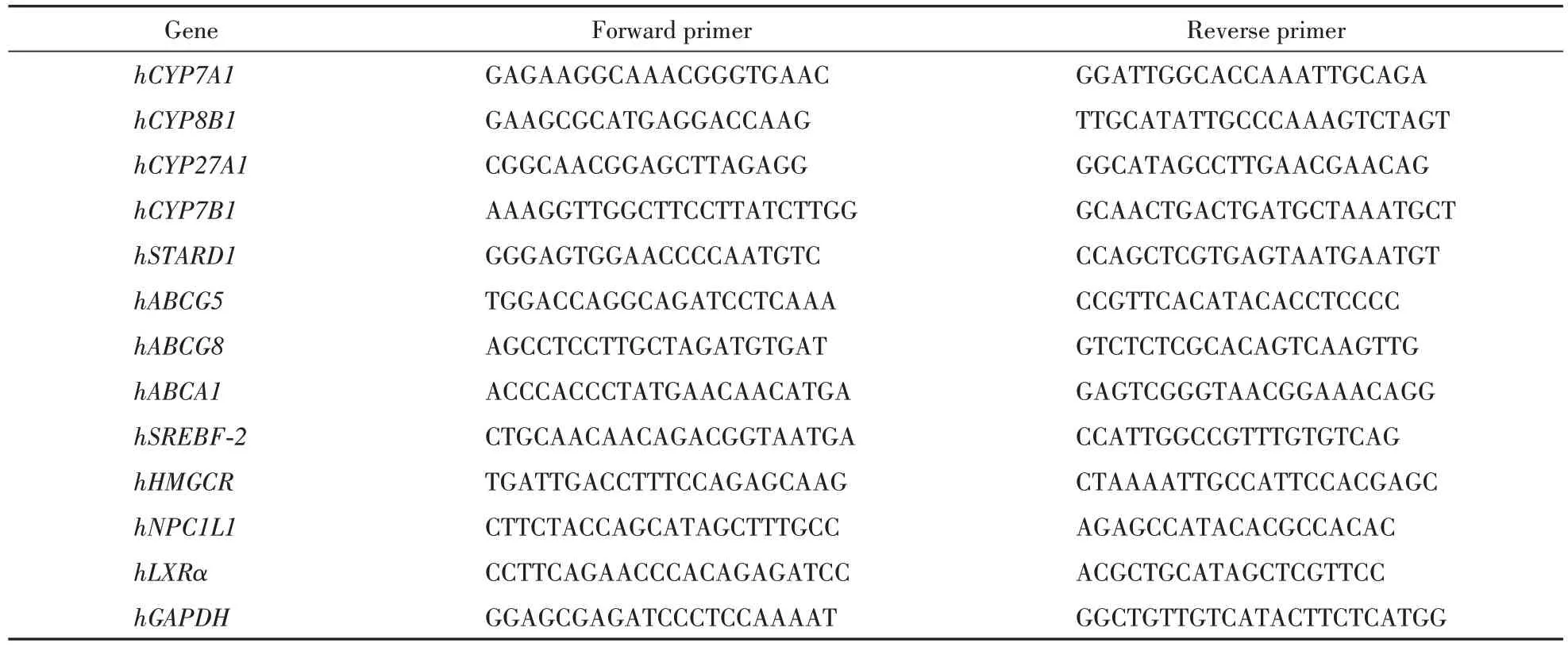
Table 1 Primer sequences used for real-time polymerase chain reaction
2.7 蛋白质免疫印迹(Western blot)
根据各孔细胞密度加入适量RIPA(含PMSF)裂解液,4 ℃裂解20 min,细胞刮收集细胞,4 ℃,14 000 r/min,离心20 min,采用BCA 法测定上清液中蛋白浓度,按每孔20 µg 折算上样量。上样并进行SDS-PAGE电泳(电泳时间:80 V、30 min;110 V、60 min),随后将凝胶上的蛋白质转移到PVDF 膜上。用5%脱脂牛奶阻断非特异性结合,并在4 ℃与STARD1、ABCG5、LXRα 一抗(1∶1 000)孵育过夜。TBST 清洗膜3 次后,与二抗(1∶8 000)在室温下孵育1 h,TBST 清洗膜3 次后,通过ECL 化学发光法显色。以β-actin 为内参对照,用ImageJ 软件分析各蛋白相对表达量。
2.8 LC-MS/MS测定胆汁酸和氧甾醇含量
2.8.1 细胞及培养液上清液中胆汁酸含量测定选取状态较好的HepG2 细胞接种于100 mm 培养皿中,同 “2.4”项下分组且对应处理72 h,每组设置7个重复,同时设置一皿无细胞但含相同培养液,以扣除外源干扰。精密吸取培养液上清液200 µL,加入甲醇(含胆汁酸内标CA-d40.1µg/mL 和LCA-d40.05 µg/mL)1.2 mL,涡旋5 min 以沉淀蛋白,4 ℃,14 000 r/min,离心10 min。取上清液1.2 mL,氮吹干燥后待用。用冰冷的PBS 洗涤细胞3 次,加入80%甲醇(含胆汁酸内标CA-d40.1 µg/mL 和LCAd40.05 µg/mL)3 mL,在-80℃冰箱中淬灭20 min(淬灭的目的是使细胞中的酶失活,终止细胞代谢),细胞刮收集细胞,冰浴超声破碎,4 ℃,14 000 r/min,离心20 min。将上清液转移并氮气干燥。干燥后的样本均用甲醇80 µL 复溶,供LC-MS/MS分析。每组各随机选取一皿用BCA 法测定其蛋白质含量(mg/mL),用于胆汁酸含量归一化[17-18]。
分析条件:Zorbax Bonus-RP 色谱柱(2.1 mm ×150 mm,3.5 µm);流动相:含0.01%甲酸和5 mmol/L醋酸铵的水溶液(A相)和甲醇溶液(B相);梯度洗脱程序设置如下:0 ~ 10 min,55% B ~ 60% B; 10 ~60 min,60% B;60 ~ 65 min,60% B ~ 80% B; 65 ~75 min,80% B;75 ~ 85 min,80% B ~ 90% B;85.01 ~88 min,100% B;88.01 ~ 93 min,55% B;柱温:42 ℃,进样量:5 µL,流速为0.3 mL/min。各胆汁酸对照品及其对应内标的离子对与碰撞能等详细信息见表2。
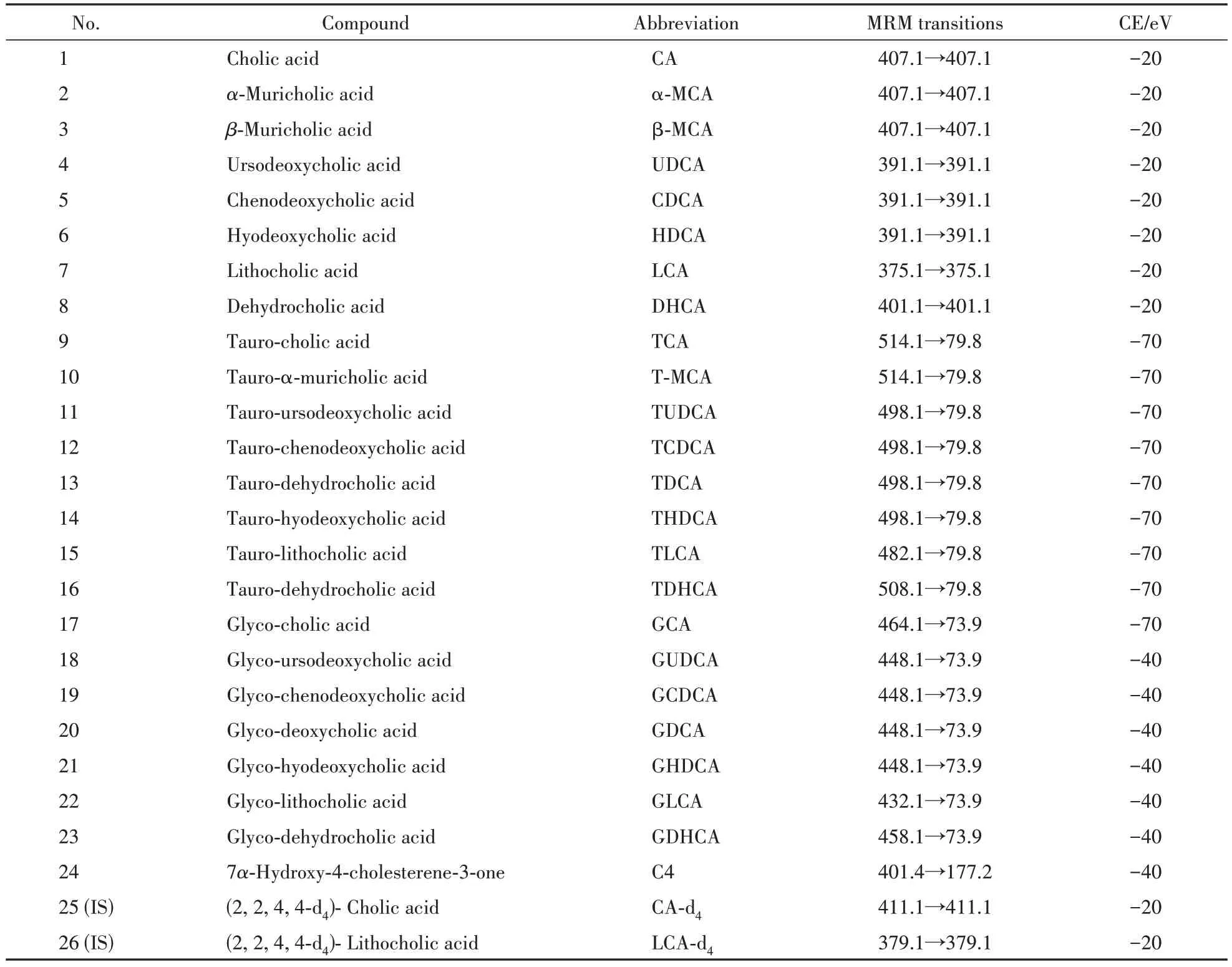
Table 2 Multiple reaction monitoring (MRM) parameters (Q1/Q3 transition pair; collision energy (CE)) of 25 bile acids and 3 deuterium-labeled internal standards used in the analysis
2.8.2 线粒体分离 将HepG2 细胞以每皿1 ×107个细胞的密度接种于150 mm细胞培养皿中,同“2.4”项下分组且对应处理72 h,每组设置3 个重复。PA 处理结束后,用冰冷的PBS 清洗细胞3 次,细胞刮收集细胞至离心管中,根据Minowa 等[19]报道的方法进行线粒体分离,将细胞重新悬浮在含有0.5% BSA 的Hypo 缓冲液中(0.5 mol/L NaCl,0.5 mol/L MgCl2,1 mol/L Tris-HCl),冰上静置10min 后转移至2 mL 玻璃匀浆器匀浆,随后加入适量的线粒体分离液(525 mmol/L 甘露醇,175 mmol/L 蔗糖,2.5 mmol/L EDTA,12.5 mmol/L Tris-HCl)充分混合,4 ℃,2 254 r/min,5 min,沉淀为完整的细胞、细胞碎片和细胞核。取上清液,4 ℃,2 667 r/min,10 min,除去残留细胞核。取上清液于4 ℃,9 017 r/min,10 min,得线粒体粗组分。氧甾醇含量以对应蛋白质含量(mg/mL)归一化。
2.8.3 线粒体氧甾醇含量分析 根据已有报道[20]进行线粒体脂质提取,甲醇40 µL 复溶后,经LC-MS/MS 8040 进样分析。分析条件如下:Waters Acquity UPLC BEH C18色谱柱(2.1 mm × 100 mm,1.7 µm);流动相A 为70% 甲醇、30% 水、0.1% 甲酸,流动相B为70% 乙腈、30% 甲醇、0.1% 甲酸;梯度洗脱程序设置如下:0 ~ 3 min,8% B;3 ~ 14 min,8% B ~ 20% B;14 ~ 31 min,20% B ~ 35% B; 31 ~32 min,35% B ~ 70% B;32 ~ 49 min,70% B; 51 ~54 min,100% B;56 ~ 59 min,8% B;柱温:40 ℃,进样量:5 µL。各氧甾醇对照品及内标的离子对与碰撞能等信息见表3。
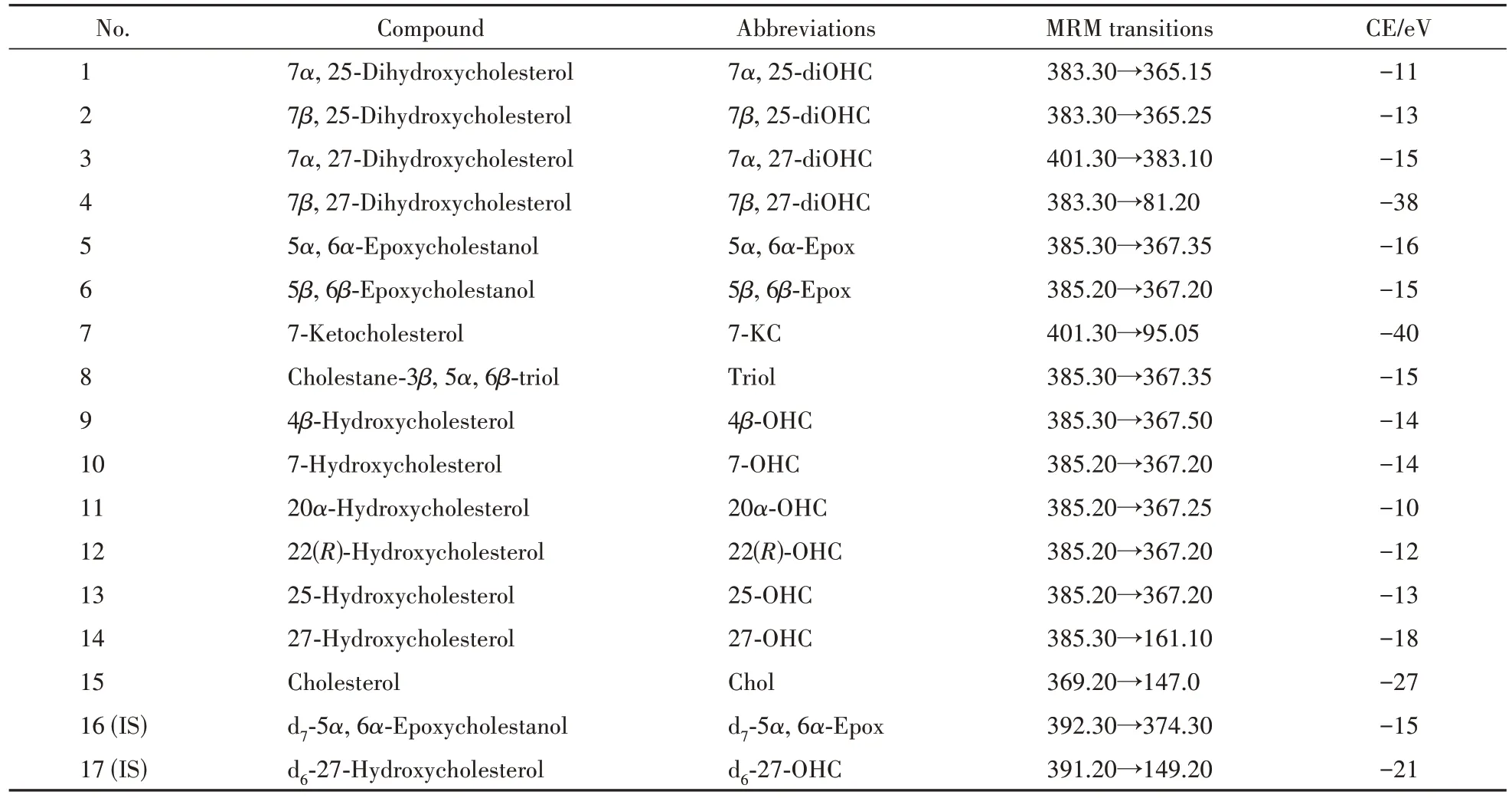
Table 3 MRM parameters (Q1/Q3 transition pair; CE) of 15 oxysterols and 2 deuterium-labeled internal standards used in the analysis
2.9 统计分析
实验所有数据均以平均值±标准差(±s)表示。利用Graphpad Prism 8.0 软件应用非配对t检验、单因素方差分析或两因素方差分析(ANOVA)进行统计分析,以P <0.05 认为具有统计学意义。
3 结 果
3.1 PA对细胞活力的影响
通过CCK-8 实验评估不同浓度PA 处理不同时长对HepG2 细胞的毒性。结果如图1 所示,3 种不同浓度的PA 处理1 ~ 3 d 对HepG2 细胞具有明显的毒性作用,且呈时间和剂量依赖性。
3.2 PA促进细胞脂质堆积
TG 与TC 含量测定结果如图2-A 所示,与对照组相比,0.3 mmol/L PA 处理72 h 后,细胞内TG 与TC 含量显著增加(P <0.000 1)。油红O 染色结果显示,对照组肝细胞形态正常,胞质内几乎无明显脂滴;而模型组中细胞形态不规则,细胞内可见大量橙红色脂滴(图2-B)。
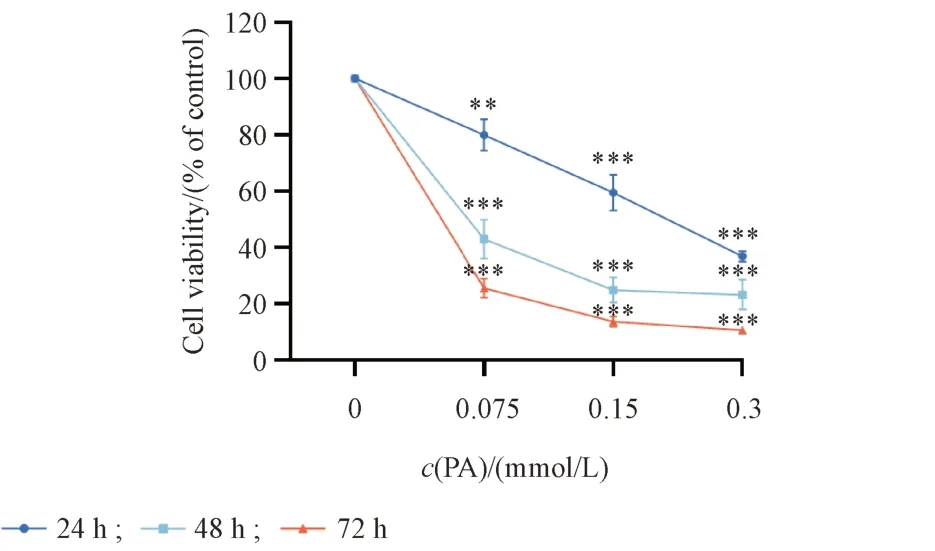
Figure 1 Effects of palmitic acid (PA) induced cytotoxicity in HepG2 cells. HepG2 cells were exposed to various concentrations of PA (0,0.075, 0.15, 0.3 mmol/L) for 24, 48, and 72 h, and cell viability was subsequently determined by CCK-8 assay (± s, n = 6)

Figure 2 Induction of lipid accumulation by PA in HepG2 cells
3.3 PA 对细胞胆固醇稳态相关基因与蛋白表达的影响
如图3 所示,与对照组相比,胆固醇合成相关基因SREBF-2和HMGCRmRNA 表达以及负责胆固醇摄取的NPC1L1mRNA 的表达均未发生显著变化。而胆汁酸替代合成途径限速酶STARD1mRNA的表达水平呈时间和浓度依赖性显著升高;与此同时,STARD1 蛋白表达也升高约2 倍(图4)。另外,随着PA 浓度增加和处理时间延长,胆汁酸合成限速酶CYP7B1和关键酶CYP8B1的基因表达均上调。然而,胆固醇外流相关基因表达没有发生显著变化(P> 0.05),但ABCG5 蛋白及其上游转录调控因子LXRα 表达水平均显著下降(P< 0.05)。
3.4 PA增加细胞及培养液中BAs水平
为了进一步观察生物大分子功能改变是否会体现在代谢物水平上,本研究利用LC-MS/MS 检测细胞及培养液中BAs 水平。C4 是胆汁酸合成过程中产生的一种稳定的中间体,可用于表征胆汁酸的合成速率[21]。结果如图5 所示,在细胞及培养液中均只检测到CA、CDCA 及C4 3 个物质。与对照组相比,PA 处理后细胞内CA、CDCA 与C4 水平均有不同程度的增加,培养液中CA 与CDCA 水平显著升高,而C4 含量较低,但总BAs 水平增加约1.5倍(P< 0.05,P< 0.01),这与STARD1和CYP7B1mRNA表达增加一致。
3.5 PA诱导细胞线粒体中27-OHC水平升高
为了更好地了解饱和脂肪酸对肝细胞亚细胞器的脂毒性机制,本实验采用差速离心法分离肝细胞线粒体,并利用LC-MS/MS 测定线粒体中氧甾醇水平。结果如图6 所示,胆固醇和替代合成途径的中间产物27-OHC 水平显著增加,而经典胆汁酸合成途径的中间产物7-OHC 含量无明显变化。另外,PA 对非酶途径产生的7-KC、5α,6α-Epox、5β,6β-Epox 和Triol 等氧甾醇含量也无显著影响。
4 讨 论
NAFLD 通常分为非酒精性脂肪肝(NAFL)和NASH,NASH 是NAFL 的一种进行性形式,涉及炎症和肝细胞损伤[22]。肝脏胆固醇稳态失调在NAFLD/NASH 的发生发展中具有重要作用,细胞内胆固醇蓄积不仅是肝脏损伤的调节因素,也是改善代谢性疾病的治疗靶点[14]。因此,深入了解疾病状态下胆固醇代谢过程对预防和治疗NAFLD具有重要意义。
一项病例对照研究结果表明,PA 和油酸(oleic acid,OA)是NAFLD 患者血清中含量最丰富的FFA[23],大多数研究使用PA 或OA 或FFA 混合物建立体外肝脏脂肪变性模型,以模拟人体疾病状态[24-25]。在评估与病理生理状态相关的脂毒性机制的实验中,由于FFA 溶解度的限制,FFA 与BSA的物质的量之比不宜超过5[16]。故本研究采用PA与BSA 物质的量之比为5 构建HepG2 细胞脂肪变性模型,探讨胆固醇代谢相关基因和蛋白表达变化,并基于细胞和亚细胞器水平观察疾病状态下胆固醇代谢过程,结果发现饱和脂肪酸诱导的细胞毒性可能与胆固醇代谢紊乱密切相关,该结果对了解NAFLD 中胆固醇代谢变化具有一定的意义。
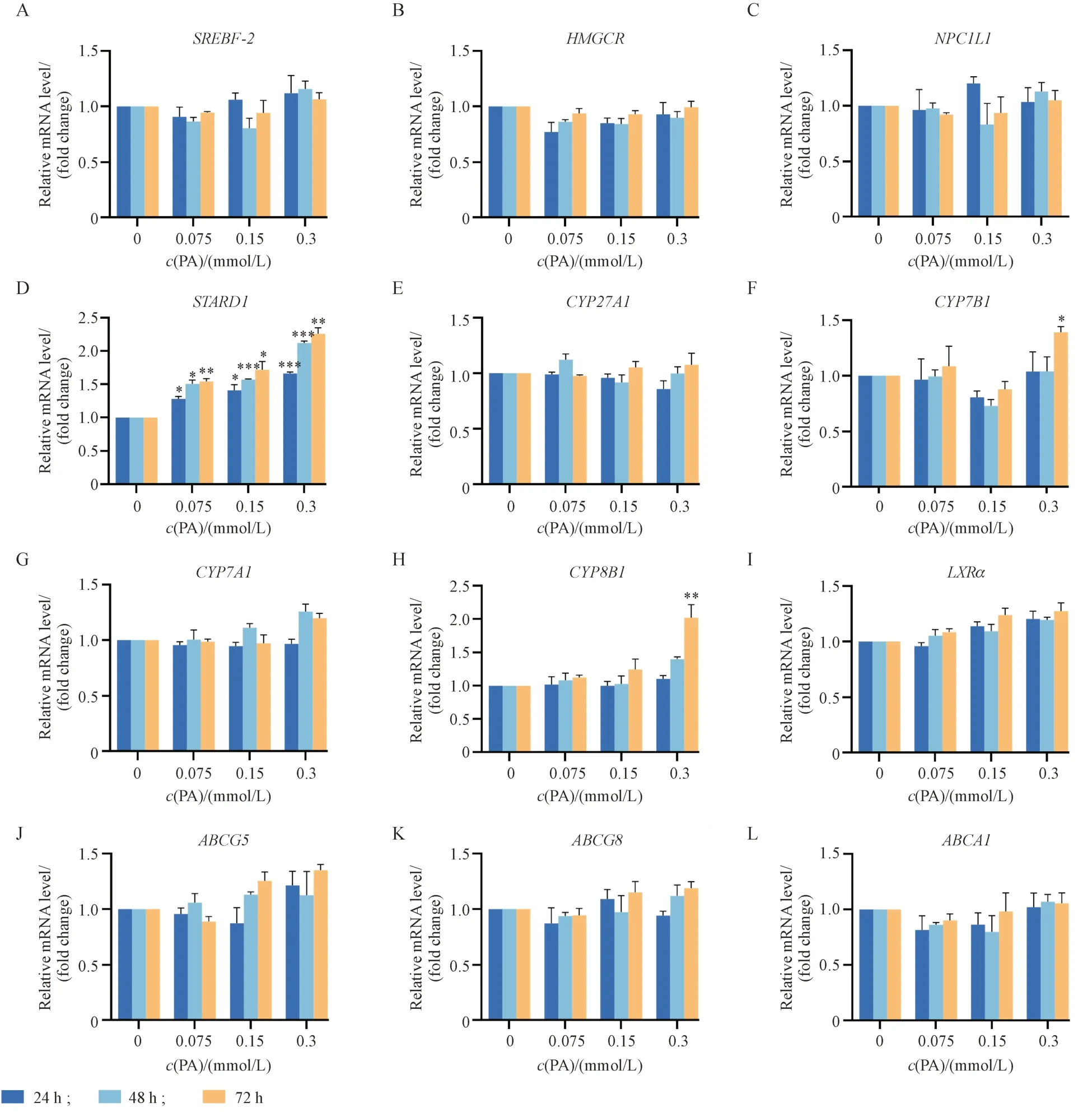
Figure 3 HepG2 cells were exposed to various concentrations of PA (0, 0.075, 0.15, 0.3 mmol/L) for 24, 48 and 72 h. The mRNA levels of cholesterol synthesis, including SREBF-2 and HMGCR (A-B), and NPC1L1, forcholesterol uptake (C), and the key genes of bile acids synthesis, including STARD1, CYP27A1, CYP7B1, CYP7A1 and CYP8B1 (D-H), and cholesterol efflux, including LXRα, ABCG5, ABCG8 and ABCA1 (I-L). The relative mRNA expression levels were determined by normalizing to GAPDH (± s, n = 3)
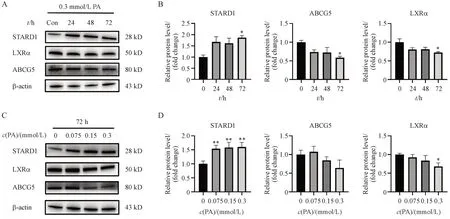
Figure 4 Effects of PA on the bile acids alternative synthesis pathway and cholesterol efflux, measured by blot. Time- (A) and dose-dependent(B) effect of PA on STARD1, LXRα, ABCG5 protein content; (C, D) Protein expression levels are normalized with β-actin (± s, n = 3)
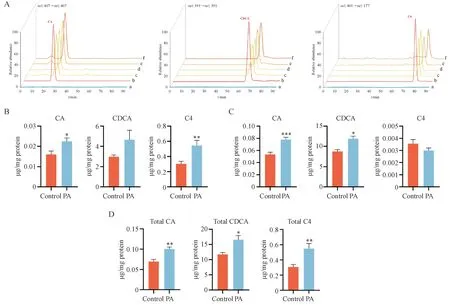
Figure 5 Effects of PA treatment on endogenous bile acids (BAs) content. Total BAs are measured in the media and cells from cultures treated with 0.3 mmol/L PA for 72 h and in corresponding untreated control using LC-MS/MS. Data are normalized relative to the amount of proteins in each condition
本研究首先评估了PA 对HepG2 细胞活力的影响,随着PA 浓度与处理时间增加,对细胞毒性也明显增强。采用0.3 mmol/L PA 处理72 h 后,可见细胞脂滴明显累积,TG 和TC 含量也显著升高,这与文献[26]的结果一致,表明肝细胞脂肪变性模型建立成功。此外,PA 刺激HepG2 细胞后,与胆固醇合成、摄取和外排相关mRNA 表达水平未发生显著变化。而NAFLD细胞模型中胆固醇合成与之前的研究结果[15]不一致,这可能是由于胆固醇对肝脏HMG-CoA 还原酶和SREBF-2 的代偿性抑制,以反馈细胞内胆固醇水平的升高[27]。另外,LXRα和ABCG5mRNA 和蛋白表达水平不一致,可能是由于其转录后翻译水平发生变化(如蛋白质合成速率低或降解速率较快)而导致的[28-29]。已有研究表明NASH 患者和高脂饮食诱导的大鼠肝脏胆汁酸合成相关基因,如CYP7A1,CYP8B1和CYP27A1表达水平显著增加[30]。此外,STARD1 作为胆汁酸替代合成途径的限速酶,其生物学功能是将胞质中的胆固醇运输至线粒体内膜进行代谢,其可通过调控BAs 的组成和水平在NASH 驱动的肝癌模型中发挥重要作用[31]。本研究发现胆汁酸合成途径相关基因和蛋白表达均显著增加。这些结果表明,PA 刺激HepG2 细胞后胆固醇稳态失调主要表现为胆固醇外流减少和胆固醇向代谢产物BAs 的转化速率增加。
为了进一步探讨细胞BAs 水平是否发生了与基因和蛋白相应的变化,本研究采用LC-MS/MS 测定了细胞内BAs 的含量,结果发现细胞和培养液中CA、CDCA 和C4 含量均显著增加。与该结果一致的是Jiao 等[30]发现NAFLD 患者血清CA、CDCA、DCA 和UDCA 水平显著升高,同时依据粪便总胆汁酸、初级胆汁酸和血清胆汁酸合成标志物C4 水平升高等结果说明NAFLD患者肝脏胆汁酸合成速率增加[32]。然而,外源性CDCA可以激活Kupffer细胞释放促炎细胞因子(如TNFα 和IL-1β),诱发炎症反应[33]。因此,细胞内初级胆汁酸水平升高在一定程度上会破坏细胞生长的微环境,导致肝细胞损伤,从而恶化NAFLD进程。

Figure 6 LC-MS/MS analysis of oxysterols levels in mitochondria. Cells were treated with 0.3 mmol/L PA for 72 h. Mitochondria were separated by differential centrifugation after PA treatment. Lipids were extracted with chloroform/methanol (2∶1) mixture. Data are normalized relative to the amount of mitochondria proteins in each condition. Total ion chromatograms (TIC) of oxysterol mixture standards (A) and samples (B); (C) Determination of oxysterols content in mitochondria (± s, n = 3)
胆固醇在线粒体膜结构中起主要作用,可以调节线粒体膜的流动性[34]。然而,线粒体游离胆固醇蓄积会破坏线粒体膜的完整性,导致线粒体功能障碍,从而诱导细胞凋亡[14]。此外,一些研究表明,NAFLD 患者血清中由胆固醇合成胆汁酸的中间产物4β-OHC、7-OHC、24S-OHC、25-OHC 和27-OHC 等均具有很强的生物活性。27-OHC 是由胆汁酸替代合成途径中的关键酶CYP27A1合成的一种胆固醇衍生物,可以调节巨噬细胞中SREBF-2的基因转录,进而影响胆固醇代谢[35]。27-OHC 还可以作为激活LXR 的生理性配体发挥一定的生物学效应。为了进一步了解氧甾醇在脂肪变性细胞模型中的变化及饱和脂肪酸对细胞的脂毒性机制,本研究采用LC-MS/MS 测定线粒体氧甾醇含量,结果发现线粒体胆固醇和27-OHC 水平显著增加,而其余氧甾醇均无明显改变,这可能是由于其相应的代谢酶定位在ER 或其他亚细胞器中,因而在线粒体中没有观察到差异。另外,本研究结果中CYP27A1 表达水平未发生显著变化,而线粒体中27-OHC含量显著升高,这可能与CYP27A1催化底物增加或胞质中介导27-OHC 经硫酸化修饰进行代谢的酶表达降低有关[36]。此外,27-OHC 水平升高,而LXRα 蛋白表达却表现出相反趋势,这可能是因为27-OHC的激动作用仅限于Kupffer细胞,并在很大程度上依赖于LXRβ,而27-OHC 在全肝中主要作为LXRα 的拮抗配体,说明27-OHC 对LXR 的兴奋和拮抗作用是细胞特异性的[37]。这些研究结果表明,PA 刺激后,线粒体胆固醇含量增加,且胆汁酸酸性合成中间体27-OHC 水平同步升高,这可能通过破坏线粒体膜的完整性加重肝细胞损伤。
综上所述,本研究详细描述了胆固醇代谢相关基因和蛋白质表达情况,并系统观察了细胞胆汁酸和线粒体氧甾醇水平变化。这些发现为NAFLD 疾病中肝脏胆固醇代谢变化提供了更清晰的认识。更重要的是,在该研究中发现STARD1基因和蛋白表达均显著升高,这表明胆汁酸替代合成途径在NAFLD 的发展中具有重要作用。另外,目前这些发现局限于外源诱导的细胞模型,而STARD1 对NAFLD 发展过程中胆汁酸替代合成途径的调节作用还须通过敲除或过表达等实验来进一步验证,从而部分支持STARD1 作为NAFLD 治疗靶点的潜力。

