二氢麦角胺改善阿尔茨海默病状态下的突触萎缩及其对认知功能的影响
陈佩佩,魏 杰,柳晓泉,刘昊晨
(中国药科大学代谢动力学研究中心,南京 211198)
阿尔茨海默病(Alzheimer’s disease,AD)是一种神经退行性疾病,主要表现为患者的认知功能受损,但其发病机制目前尚不清楚[1-2]。目前已批准的AD 治疗药物对认知功能的改善作用非常有限。因此,学者一直在努力寻找干预AD 的新策略。
越来越多的证据表明,突触功能损伤或突触缺失与AD 患者认知受损显著相关[3],这提示通过改善突触萎缩治疗AD 认知障碍可能是一种潜在的新策略。有研究表明狐猴酪氨酸激酶1(lemur tail kinase1,LMTK1)是影响突触生长的关键性激酶,周期依赖性蛋白激酶5(CDK5)在Ser-34 处磷酸化LMTK1,磷酸化的LMTK1 调控其下游蛋白TBC1D9B,进而负向调控GTP 酶Rab11A 介导的突触生长,CDK5-LMTK1-TBC1D9B-Rab11A 级联反应是一种调节核内体转运和突触形成的新的信号通路[4]。抑制LMTK1 可以明显改善突触萎缩,但尚未研究LMTK1 改善突触萎缩对认知功能的影响[5]。本研究采用计算机虚拟筛选的方法发现二氢麦角胺(dihydroergotamine, DHE)可以抑制LMTK1 的活性并可通过血脑屏障[6],故选择DHE来探究其对突触萎缩的改善作用及其对认知功能的影响。早在20 世纪70 年代就有临床研究报告了麦角生物碱制剂安得静(hydergine)治疗老年性脑萎缩的临床病例,随后hydergine 被广泛应用于老年人认知、情感障碍[7]。Kemali 等[8]发现麦角酸二乙胺可以提高突触密度并改善突触形态。DHE是一种生物活性较高的麦角生物碱衍生物,它对认知、记忆处理和运动控制可能具有调节作用[9-10]。本研究采用快速老化的AD 模型小鼠SAMP8,探究DHE 对AD 模型小鼠突触形态、突触可塑性及认知功能的影响。
1 材 料
1.1 试 剂
CCK8 试剂(上海翌圣生物科技有限公司);Western blot 及免疫染色相关试剂、嘌呤霉素(江苏碧云天生物科技有限公司);多克隆抗体PSD95、高尔基染液(武汉赛维尔生物科技有限公司);Alexa Fluor®488 山羊抗兔IgG(美国Cell Signaling Technology 公司);GAPDH 抗体、β Ⅲ-Tubulin 抗体(中国Proteintech公司);P-TBC1D9B抗体、P-LMTK1抗体(南京金斯瑞公司);DHE 标准品(美国MCE 公司);人淀粉样蛋白1-42(吉化生物公司);PCR 相关试剂(南京诺维赞生物科技有限公司);其余试剂 均为市售分析纯。
1.2 仪 器
倒置荧光显微镜 (日本Olympus 公司);水迷宫装置(北京众实迪创公司);ANY-maze 动物行为学采集分析软件(英国Global Biotech 公司);病理切片机(上海徕卡仪器公司);包埋机(武汉俊杰电子有限公司);PANNORAMIC 259 全景切片扫描仪(匈牙利3dhistech 公司);SynergyTMH1 全功能微孔板检测仪(美国伯腾有限公司);冰冻切片机,QuantStudio3 实时荧光定量PCR 系统(美国Themo公司);电泳仪、转膜仪(美国Bio-Rad 公司);多功能凝胶成像系统(中国Tanon公司)。
1.3 细胞与动物
鼠源神经母细胞瘤细胞C17.2细胞,购自北京北纳创联生物技术研究院;SPF级雄性衰老加速小鼠耐药1(senescence-accelerated mouse resistant 1,SAMR1)和衰老加速易感小鼠品系8(senescenceaccelerated prone mouse strain 8,SAMP8),3 月龄,购于武汉有度生物公司,生产许可证号SCXK(鄂)2021-0025。所有动物实验均符合动物伦理委员会标准。
2 方 法
2.1 动物分组与给药
AD 模型小鼠SAMP8 和对照小鼠SAMR1,适应性饲养1 个月,4 月龄时,将SAMP8 小鼠随机分为3 组(每组12 只),包括疾病组(SAMP8)、SAMP8+1 mg/kg DHE 组,以及SAMP8+2 mg/kg DHE 组。相同月龄的SAMR1 小鼠(n =12)作为正常空白对照组(blank-SAMR1)。小鼠腹腔注射给药,每天1 次,连续给药8 周后,进行后续实验。DHE的给药剂量和周期参照文献[11]。
2.2 Western blot实验
给药完成后,每组随机挑选3 只,处死,取海马,进行Western blot 实验(抗P-LMTK1,1∶2 500,抗P-TBC1D9B,1∶800),用凝胶图像系统记录结果。通过Image J软件分析结果。
2.3 Morris water maze水迷宫实验
每组剩余9 只小鼠进行水迷宫实验。实验流程参照文献[12],主要包含:可视化平台实验(visible platform trail,D1)、获得性训练实验(acquisition training trail,D2-6)、探索性实验(probe trail,D7)、反向实验(reversal trail,D8-D10)。对记录的指标进行分析,包括逃生潜伏期、平均速度、穿越次数以及在目标象限度过的时间等。
2.4 电生理实验
水迷宫实验结束后的小鼠,每组随机挑选3只麻醉取脑,于ACSF 中利用振动切片机切片放入28 ℃ ACSF 中进行孵育。转移至记录槽内,2 mL/min进行灌流。刺激脑片海马Schaffer侧枝,在CA1辐射层树突记录得到兴奋性突触后电位(EPSP)。双钨丝电极刺激脉冲(0.1 ms)每隔15 秒进行1 次,强度为0.5 mA。使用Axoclamp 2B amplifier在20 kHz采样,10 kHz过滤后输出。使用Digitdata 1200 进行数字信号转换。基线条件:每分钟4 次,波宽0.1 ms,持续记录10 min。使用一个高频刺激(high frequency stimulation,HFS,100 Hz)产生长时程增强(long-term potentiation,LTP),并在HFS后持续记录40 min。采用pCLAMP 10.0分别测量EPSP起点和终点与负峰得差值,计算其平均值。LTP诱导成功标志是HFS 后EPSP 的均值不小于基线的120%。
2.5 小鼠脑组织的免疫荧光实验
“2.4”项中剩余的6只小鼠处死后,取半脑,固定、包埋、切片、脱蜡至水及抗原修复后。进行封闭、一抗孵育(抗PSD95,1∶200)、二抗孵育(Alexa Fluor®488 山羊抗兔IgG,1∶500)、DAPI 染核及封片。使用Pannoramic 扫描仪扫描成像,用Caseviewer 2.4 软件打开进行观察。随后,使用Image-Pro Plus 6.0分析软件分别测量每张图片中海马区域阳性的累积光密度(integrated optical density,IOD)(右1)以及对应的组织像素面积(area),并计算出面密度(areal density,IOD/area)。
2.6 高尔基染色
将“2.5”项下剩余的半脑组织块经固定、切块、染色后,于80%的冰醋酸中过夜浸没,组织变软后置于30%蔗糖溶液中切片,晾干后进行显影定影。用Image-Pro Plus 6.0 分别测量每张400 倍图片中心完整神经元上的第2 或3 树突分支30 ~90 µm 长度范围内树突棘的个数,测量长度及计数该长度内树突棘数量,以每10 微米树突棘个数作为其密度 = 树突棘数量/树突长度 × 10。使用Image J 1.51K 分析软件中Neuron J 插件绘制每张400倍图片中心神经元胞体结构图,使用Shollanaly插件,以胞体为中心做间距为10 µm 的10 个同心圆,计数树突与同心圆的交点数,并计算出10个交点数之和。
2.7 细胞毒性CCK8实验
在96 孔板中以每孔2 × 103接种C17.2 细胞,孵育24 h,向其中加入0,4,40,400,2 000,4 000 nmol/L的DHE稀释液,每组设6个平行复孔。孵育24, 48, 72 h 后,每孔加入CCK-8 试剂10 µL,于培养箱内孵育3 h,用VersaMax 酶标仪测定450 nm 处的吸收度。
2.8 LMTK1 基因过表达和沉默C17.2 细胞株的构建及效率验证
dcas9-SAM 转录激活系统过表达LMTK1 由吉满生物科技设计合成。C17.2 细胞以每毫升1.5 ×105个密度接种于6 孔培养板,待细胞汇合30% ~40% 时依次感染dcas9-VP64 慢病毒、MS2-P65-HSF1_Hygro 慢病毒、gRNA-SAM 慢病毒(MOI =30),并在感染后依次使用杀稻瘟菌素(7.5 µg/mL)、潮霉素B(100 µg/mL)、嘌呤霉素(8 µg/mL)进行筛选。进行RT-qPCR 实验验证沉默的效率。以GAPDH 作为内参,采用2(-ΔΔ)Ct法计算LMTK1 的相对表达量。
siRNA 靶向LMTK1 的重组慢病毒(LMTK1-siRNA:5′-GCUCAGUGCAGCUCCUCAA-dTdT-3′)和对照慢病毒(Ctrl-siRNA:5′-UUCUCCGAACGUGUCACGUdTd-3′)合成于上海汉恒生物科技有限公司。沉默细胞株的构建步骤参考上述过表达细胞株的构建。感染后用8 µg/mL 嘌呤霉素筛选48 h。进行Western blot 实验验证转染效率,兔源LMTK1、兔源β-tubulin 抗体及兔源二抗稀释比分别为1∶1 000、1∶4 000、1∶4 000。
2.9 C17.2细胞的免疫荧光实验
取对数生长期的C17.2 细胞,以每孔40 个细胞接种于96孔板,37 ℃、5%CO2培养4 h,加入分化培养基,继续培养5 d,每48 小时更换新的分化培养基。第5 天,加药,继续培养24 h。固定、通透、封闭后,每孔加入兔源beta-Ⅲ Tubulin 抗体(1∶50)约50 µL, 4 ℃孵育过夜。PBST 洗涤后,加入Alexa Fluor®488 抗兔荧光二抗(1∶500)约100 µL,避光孵育1 h。DAPI 避光染色5 min,PBST 避光洗涤。观察并拍照。
2.10 数据统计分析
数据处理使用GraphPad Prism 8.0,采用单因素方差分析(One-way ANOVA)检验,P的多重检验采用Bonferroni 方法,结果以±s表示,P< 0.05被认为有显著性差异。
3 结 果
3.1 DHE对AD小鼠海马区域突触密度的影响
突触后密度蛋白95(postsynaptic density 95,PSD95)是突触后密度区树突棘的主要支架蛋白,可反映突触的密度和数量,被认为是突触后可塑性的生物标志物[13-14]。为探究DHE 对AD 模型小鼠海马体内突触密度及可塑性的影响,从各组动物中随机选取6 只进行海马体切片及PSD95 荧光染色,由于其中一张切片海马区域缺失,所以样本量为5。PSD95的荧光强度统计分析结果如图1所示:SAMP8小鼠海马中PSD95阳性细胞平均面密度较SAMR1 组显著降低(P< 0.05),SAMP8+2 mg/kg DHE 组PSD95 平均面密度明显升高(P< 0.05vsSAMP8),说明DHE 能够显著增加AD 模型小鼠海马内的突触密度并改善突触可塑性。
3.2 DHE对AD模型动物突触萎缩的影响
树突棘是兴奋性突触的主要突触后元素,是记忆和认知的关键结构。高尔基染色结果(图2)显示,与对照组(SAMR1)相比,AD 模型组小鼠海马体内树突棘密度显著降低(P< 0.05)和分支数量显著下降(P< 0.01),而DHE 给药后,树突棘密度和分支数量得到提高,其中DHE 高剂量组(2 mg/kg DHE)树突棘密度显著增加(P< 0.001vsAD 组)以及分支数量显著提高(P< 0.05vsAD组)。DHE可以显著改善AD小鼠的突触萎缩。
3.3 DHE对AD小鼠海马体突触可塑性的影响
长时程增强(long-term potentiation,LTP)是突触可塑性的特定表现形式[15],本实验通过测量海马CA1 区LTP 反映海马区突触可塑性的变化,每组3 只小鼠,每只测定2 次,其中一次LTP 诱导失败,所以样本量为5。结果表明(图3),与正常SAMR1 小鼠相比,AD 小鼠(SAMP8)fEPSP 斜率显著降低(P< 0.000 1),DHE 给药2 mg/kg 组fEPSP斜率显著升高,LTP 得到改善,DHE 能改善AD 小鼠海马的突触可塑性。
3.4 DHE 对AD 小鼠的认知功能和行为评价的影响
为了探究DHE 对AD 模型小鼠认知功能的改善作用,进行了Morris水迷宫实验评估小鼠的学习记忆能力。第1天的可视化平台实验中,观察到各组小鼠的逃生潜伏期和游泳速度没有显著性差异(P> 0.05),表明各组小鼠的视力和运动能力没有差别(图4-A)。获得性训练实验中,随着训练天数的增加,AD 组(SAMP8)和SAMP8+1 mg/kg DHE 组的逃生潜伏期未显示出规律性变化,对照组(SAMR1)、SAMP8+2 mg/kg DHE 组小鼠的逃生潜伏期逐渐缩短,并且,在训练的最后一天,SAMP8+2 mg/kg DHE 组的逃生潜伏期显著低于AD 组(图4-B)。探索性实验结果如图4-C所示,撤去平台后,对照组和DHE 高剂量给药组的小鼠在原平台所在区域穿越的次数以及所在象限中停留的时间均显著高于AD 对照小鼠。第10 天的反向实验(图4-D)表明,与AD 组相比,对照组以及SAMP8+2 mg/kg DHE 组的逃生潜伏期显著降低(P< 0.05)。综上所述,DHE 改善SAMP8 小鼠的认知功能。

Figure 1 Effect of dihydroergotamine (DHE) on the expression of postsynaptic dense 95 in hippocampus of Alzheimer’s disease (AD) mouse (± s, n = 5)

Figure 2 Effect of DHE on the density of dendritic spines and number of branches in hippocampus of AD mouse (± s, n = 6)

Figure 3 DHE improved impaired hippocampal long-term potentiation (LTP) in AD mice (± s, n = 5)
3.5 DHE 对AD 模型小鼠海马体内LTMK1 下游蛋白的影响
利用Western blot 实验探究SAMR1 和SAMP8小鼠海马体中LMTK1 磷酸化水平的变化以及DHE 对其下游TBC1D9B 磷酸化蛋白(P-TBC)表达的影响。结果如图5 所示,SAMP8 小鼠海马组织LMTK1 的磷酸化程度显著高于SAMR1 小鼠(P<0.01),并且相较SAMR1 小鼠,SAMP8 小鼠海马体内P-TBC 表达量显著增加(P< 0.05)。SAMP8 小鼠连续长期给予DHE 后,海马内P-TBC 表达显著下降,2 mg/kg DHE 组较1 mg/kg组P-TBC下调更加显著,DHE 对P-TBC 蛋白的下调作用具有一定的剂量依赖性。
3.6 DHE 对LMTK1 过表达C17.2 细胞突触萎缩的影响
为研究DHE对C17.2细胞的毒性作用,进行了CCK8 实验。2 µmol/L 的DHE 给药达到72 h 时,对C17.2细胞无显著毒性作用,细胞存活率为92%。
利用基因转录激活技术CRISPR-SAM 系统构建LMTK1 过表达的C17.2 细胞株,研究DHE 对LMTK1 过表达的神经祖细胞突触长度的影响。利用RT-qPCR测定3种稳转株的基因过表达效率,如图6 转录激活LMTK1 表达的效率为对照组的200% ~ 350%,选择转染效率最高的sgRNA3 进行免疫荧光实验,探究DHE 对已分化细胞突触长度的影响。结果显示(图6-B),当LMTK1 过表达,神经祖细胞C17.2 分化的突触长度相较于野生型细胞明显降低(P< 0.05)。与过表达细胞单独给予Aβ1-42相比,过表达细胞DHE 给药后突触长度显著增加(图6-C,P< 0.05)。表明DHE 对LMTK1过表达的C17.2细胞突触萎缩具有改善作用。
3.7 LMTK1 沉默后DHE 对C17.2 细胞突触萎缩的改善作用
为了验证DHE 是否通过抑制LMTK1 的活性发挥神经突触的改善作用。本研究通过对神经细胞C17.2 进行si-LMTK1 干扰,建立LMTK1 基因沉默的细胞株。图7 为Western blot 实验检测C17.2细胞内LMTK1 蛋白的沉默效率,其沉默效率为对照组的50%。沉默细胞系构建完成后,给予DHE,进行体外细胞免疫荧光实验,研究LMTK1沉默情况下DHE 对Aβ1-42诱导的突触萎缩的影响。沉默LMTK1 后,Aβ1-42和DHE 同时给药后,突触长度没有显著性改变。以上结果表明,当LMTK1沉默后,DHE 对抗Aβ1-42诱导的突触萎缩作用消失。综合上述实验结果表明DHE 对LMTK1具有靶向作用。
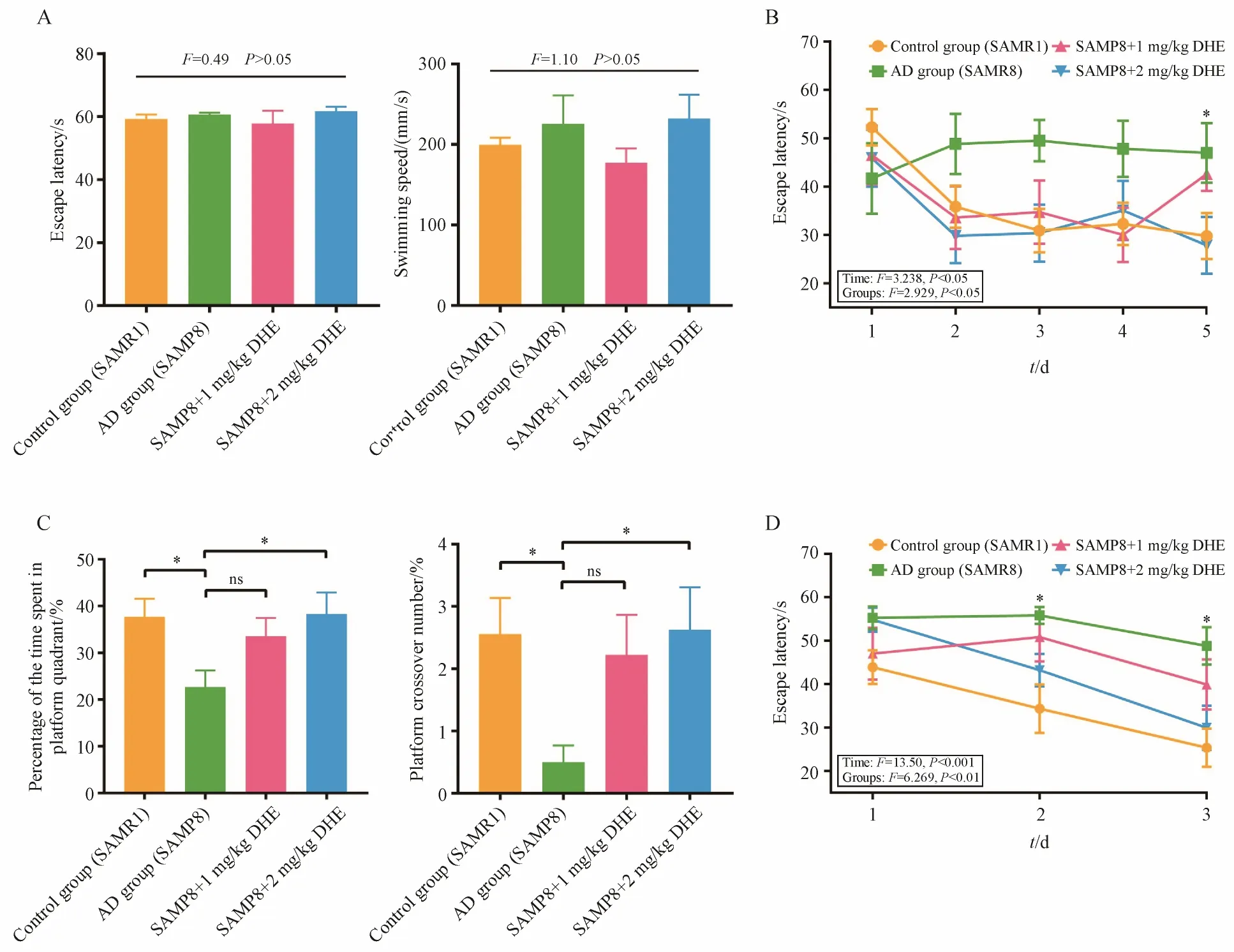
Figure 4 Effect of DHE on learning and spatial memory performance of AD mice in the morris water maze task (± s, n = 9)

Figure 5 Effect of DHE on expression of P-LMTK1 and P-TBC in hippocampus (± s, n = 3)

Figure 6 Effects of DHE on synaptic length after LMTK1 over-expression (± s)
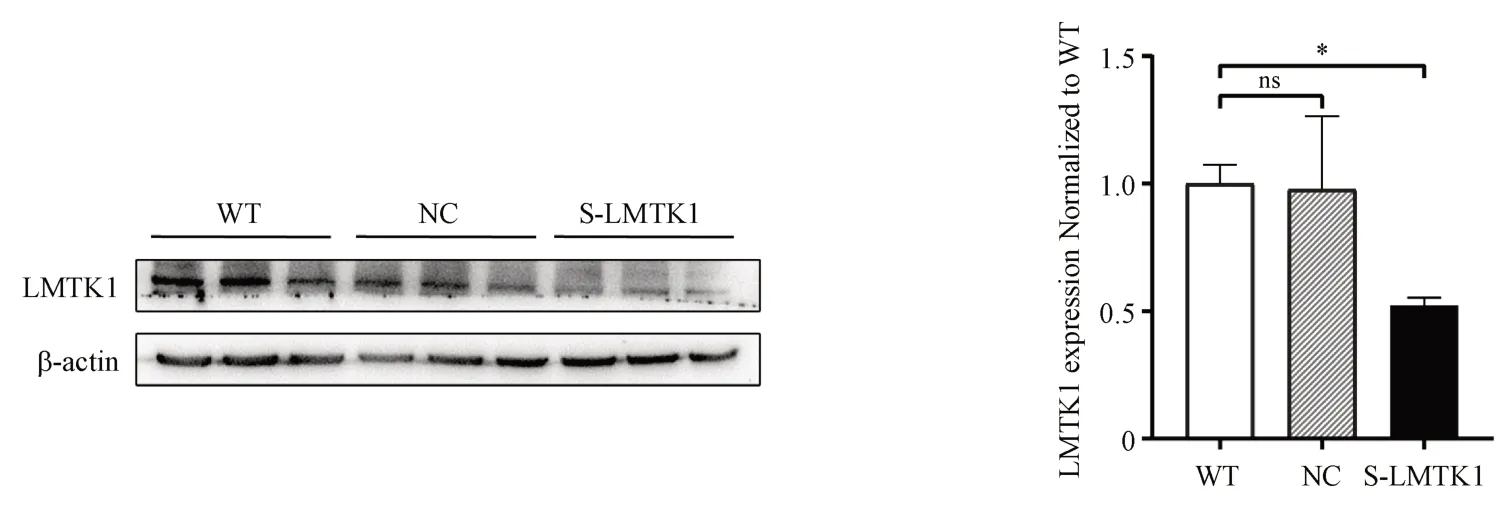
Figure 7 Relative expression of LMTK1 in control, negative control and S-LMTK1 groups (± s, n = 3)

Figure 8 Effects of DHE on synaptic length after LMTK1 silencing (± s, n = 10)
4 讨 论
越来越多的证据表明AD 早期阶段就会发生突触结构和功能损伤[16],但认知功能并未出现明显的下降,此阶段是AD药物干预的最佳时机[17-18]。在AD 早期增加突触密度以及改善突触可塑性有助于缓解AD 状态下的认知功能减退[19]。例如,代谢性谷氨酸受体5(mGluR5)沉默变构调节剂(SAM)被证明可以恢复海马突触密度,并改善AD状态下认知功能障碍[20]。Grimmig 等[20]通过给予老年小鼠虾青素饮食增加了海马体CA1-CA3 突触的突触可塑性,提高了记忆认知功能,本研究也发现改善AD 模型小鼠的突触损伤可以缓解认知功能障碍。
突触的形态和功能与认知功能密切相关,胞内体转运途径是神经突触生长的关键过程。胞内体转运途径主要包含3个步骤:首先将形成突触所需的物质“打包”成早期核内体,然后早期核内体将这些物质转运至突触并将其“打包”成循环核内体;最后循环核内体将蛋白插入到细胞膜中形成突触,早期核内体将需要降解的蛋白“打包”成晚期核内体[21]。其中Rab11A 是循环核内体转运过程中的关键效应蛋白。TBC1D9B 可以使Rab11A失活,抑制循环核内体的转运[22]。LMTK1 是一种丝氨酸/苏氨酸激酶,以Cdk5 依赖性方式使TBC1D9B 的磷酸化水平升高,磷酸化的TBC1D9B会导致Rab11A 失活,进而抑制循环核内体转运及突触的生长[5,23],但目前尚无LMTK1 的特异性抑制剂,本研究借助于计算机虚拟筛选发现DHE 可以抑制LMTK1 并且可以通过血脑屏障[6],但由于DHE 的选择性和活性不高,只有高剂量的DHE 显著改善了AD 模型小鼠的突触密度、突触可塑性以及认知功能。并证明在AD 小鼠海马组织内LMTK1 的磷酸化水平升高,DHE 可以显著降低LMTK1 下游蛋白TBC1D9B 的磷酸化水平,伴随着突触萎缩的改善、突触密度的增加及认知功能改善,上述结果提示,LMTK1 与认知功能密切相关。进一步的体外实验结果显示,DHE 能逆转过表达LMTK1 导致的突触萎缩,沉默LMTK1 后,DHE 对突触损伤的改善作用消失。已有大量的文献报道突触损伤与认知功能下降密切相关[16],上述体内外实验结果均提示DHE 可能通过靶向LMTK1,调控突触的生长,发挥认知功能的改善作用。由于DHE具有广泛的中枢活性,其对于认知功能的改善作用是否还涉及到其他的机制尚待进一步探究。
本研究发现DHE 可以显著增加AD 模型小鼠海马区突触密度并改善突触萎缩和认知功能,其改善作用可能是通过靶向突触生长的关键调控激酶LMTK1。这提示增加突触密度是未来改善AD患者认知功能的一种新策略。

