酶促自组装分子在肿瘤治疗和成像中的研究进展
任彦炜,李琦一,何 冰,李昊逾,赵 丽,李玉艳*
(1中国药科大学药物化学系,南京 211198;2中国药科大学基础医学与临床药学学院,南京 211198)
自组装是单体在无干预的情况下,从游离的、无规律分布的状态,借助分子间的非共价相互作用(如范德华力、静电力、疏水作用力、氢键和π-π堆积),自发形成具有特定结构的有序状态的过程[1]。自组装在自然界中普遍存在,细胞是一个经由自组装形成的聚集体[2-3],通过自组装,磷脂分子形成细胞膜结构[4],组蛋白和DNA 组成核小体[5],肌动蛋白和微管蛋白构成了细胞骨架[6]。从这些复杂生物结构的形成中汲取灵感,巧妙设计的小分子化合物经由自组装形成超分子纳米结构,在肿瘤治疗和成像、免疫分析、药物递送等领域显示出了巨大的应用前景,成为生物与药学发展的一个全新领域[7-9]。
近年来,采用酶促自组装(enzyme-instructed self-assembly,EISA)策略,在特异性酶的催化下,小分子化合物在肿瘤中形成超分子纳米结构的研究取得了重要进展[10]。细胞中的许多生物过程往往需要多种蛋白的参与,而酶是促进生物大分子形成、相互作用和发挥生物学功能的强大生物催化剂,具有高催化效率和底物专一的特性[11]。相关的酶,如碱性磷酸酶(alkaline phosphatase,ALP)、去乙酰化酶和酪氨酸酶已被证实与肿瘤的生长代谢存在密切联系。小分子化合物生物相容性好,对肿瘤的穿透性强,可以抵达病灶的内部。但是,存在缺乏靶向性导致不良反应较大,在肿瘤细胞的积聚能力较弱,停留时间短等问题[12]。借助肿瘤细胞上活性异常或过表达的酶,促进小分子化合物原位聚集,生成大分子的纳米结构,既实现了对肿瘤的靶向、蓄积和滞留,又降低了对正常组织潜在的副作用[13]。
EISA 在肿瘤的治疗和分子成像等领域存在巨大的研究和临床价值[14-15]。从ALP开始,多种酶已经被证实能够激活小分子进行自组装,它们的催化活性各异,有着不同的底物结构特征,拓宽了EISA的应用范围。在肿瘤的治疗方面,EISA已经进入亚细胞单位,实现了小分子化合物对细胞器的靶向自组装,诱发肿瘤细胞器功能性障碍,从而达到治疗癌症的目的[16]。在肿瘤的成像方面,EISA 可以极大程度地增强成像信号,帮助分子探针区分正常组织与病灶[13]。因此,本文对应用于EISA 的多种酶进行介绍,阐述了细胞器靶向治疗癌症的EISA策略,并介绍了EISA在肿瘤成像中的应用(图1)。
图1 酶促自组装(EISA)在肿瘤治疗和成像中的应用
1 催化原位自组装的特异性酶
EISA 采用具有适度水溶性的小分子化合物,在到达肿瘤部位后,经肿瘤细胞高表达的酶识别,催化小分子转化为亲脂亲水两亲性分子,从而改变分子间的非共价相互作用,激发自组装过程形成纳米结构[17-18]。多肽片段易于合成,是体内酶或反应的天然底物,并且可以提供有效的分子间非共价相互作用,如Phe-Phe 的疏水作用力和π-π堆积。根据酶的特异性和底物结构特征,可以开发出具有不同靶向性和功能性的EISA 小分子,实现研究的多样性。
自从2004 年,Yang 等[19]首次报道了ALP 触发小分子化合物组装成纳米结构后,多种酶被报道在EISA 的研究中表现出较好的自组装驱动能力,实现了对肿瘤的靶向。
1.1 碱性磷酸酶
作为多肽折叠和蛋白质活性的常用调节开关,磷酸化与去磷酸化已被用来控制超分子纳米结构的转换[10]。ALP 在HeLa、HepG2、Saos-2 等肿瘤细胞上过表达,可以水解小分子结构中的磷酸基团,完成去磷酸化,具有广泛的底物谱和高效的催化能力,在EISA中得到广泛应用[17]。
磷酸化位点影响ALP 的水解活性,Chen 等[20]探讨了不同的磷酸化位点对酶促功能的影响。虽然化合物Nap-pYYYH(1,图2)、Nap-YpYYH(2)和Nap-YYpYH(3)具有相同的去磷酸化产物Nap-YYYH(4),但是去磷酸化速率有着明显差异。化合物3 位于C-端的磷酸酪氨酸是去磷酸化的优势位点,最大转化率达到了每小时54.1%,相较于化合物1(每小时18.1%)和化合物2(每小时34.2%),更易于被ALP 脱除磷酸后自组装形成纳米结构。同时,圆二色光谱(circular dichroism, CD)和透射电子显微镜(transmission electron microscopy,TEM)图像显示,去磷酸化后,化合物3形成了由β-折叠构成的6 nm 纤维结构,CD 峰强度和最小峰位移说明化合物3 纳米结构的性质要优于化合物1和化合物2,表现出更强的自组装能力。

图2 ALP酶促自组装的底物结构
除了小分子直接作为自组装的模块,ALP 也可以催化纳米结构的去磷酸化,调节其自组装形成更复杂的纳米结构。He等[21]设计合成了含有4-硝基-2,1,3-苯并■二唑(4-nitro-2,1,3-benzoxadiazole,NBD)荧光基团的化合物NBD-1p(5,图2),它在超过临界聚集浓度(critical aggregation concentration,CAC)时自组装形成纳米颗粒。激光扫描共聚焦荧光显微镜(confocal laser scanning microscopy,CLSM)和TEM 图像显示,磷酸化纳米颗粒可以引起细胞膜上红色荧光蛋白标记的组织非特异性碱性磷酸酶(red fluorescent protein-tagged tissuenonspecific alkaline phosphatase,TNAP-RFP)聚集,之后在细胞内吞的过程中持续发生去磷酸化,完成从纳米颗粒到纳米纤维的结构转换,导致内涵体膜结构被破坏,最终发生内涵体逃逸。
尽管对ALP 的底物研究主要集中在含有磷酸酪氨酸的小分子上,但是磷酸丝氨酸、磷酸苏氨酸的潜在应用也不可忽视[17]。Zhou等[22]将底物研究转向了携带磷酸丝氨酸的小分子化合物L-pS(6,图2),TEM 图像显示,其可以在ALP的催化下形成直径约为24 nm的纳米纤维。
1.2 去乙酰化酶
蛋白质中赖氨酸残基可以发生多种翻译后修饰,包括琥珀酰化、乙酰化和甲基化,而赖氨酸在蛋白质折叠过程中十分重要,所以赖氨酸的修饰会影响蛋白质的结构和功能[23]。去乙酰化酶(sirtuin)家族对多种蛋白均具有一定的去乙酰化能力,共包含7种亚型(SIRT1-SIRT7),它们在细胞内的分布、功能和酶活等方面存在一定差异。其中SIRT5是一种线粒体酶,参与调节多种细胞代谢途径,具有高效的去琥珀酰化活性[24]。SIRT5是一个潜在的靶标,有研究报道其在某些肿瘤,如非小细胞肺癌、三阴性乳腺癌、结直肠癌中过表达,并且可以改变正常酶和蛋白的功能,促进癌细胞,如骨肉瘤细胞、结直肠癌细胞的生长与增殖[25-26]。
Yang 等[23]设计了一类新型的小分子化合物NBD-FFFGKsuccG(7,携带荧光基团NBD,图3)和Fmoc-FFFGKsuccG(8,无荧光基团NBD,图3),赖氨酸的琥珀酰化增加了化合物自身的水溶性。当SIRT5 催化裂解化合物7 中的琥珀酰化基团时,分子疏水性的增加诱发体外和活细胞中自组装形成纳米纤维结构。纳米结构的生成使得分子聚集并停留在肿瘤部位,显著增强了NBD 的荧光强度。通过这种方法,首次实现了针对活细胞中SIRT5活性的荧光成像。此外,还发现SIRT5 介导的EISA可以实现线粒体膜电位的去极化并促进ROS 的形成,致使线粒体功能紊乱。将化合物8 与3 种不同的化疗药物(二氯乙酸盐、顺铂和紫杉醇)联用,可显著增强这些药物的抗癌活性。
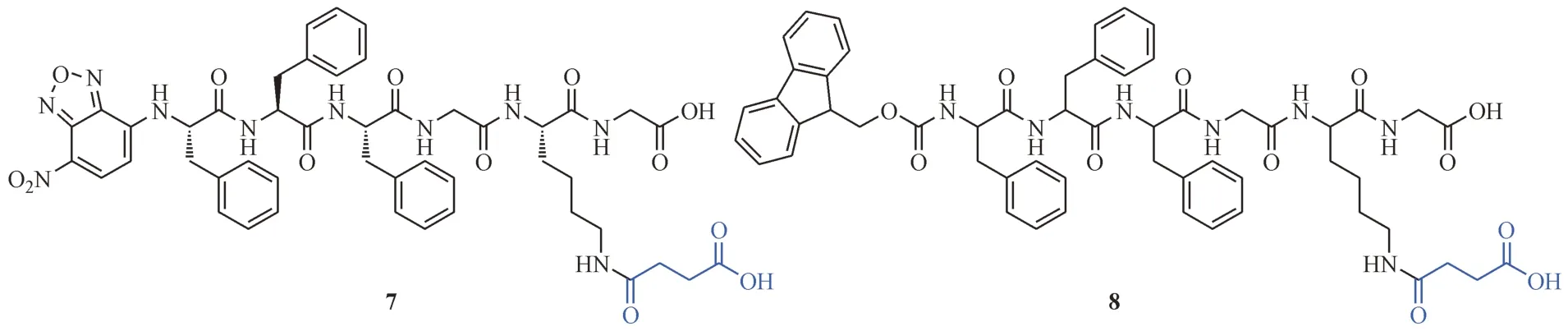
图3 SIRT5酶促自组装的底物结构
1.3 酪氨酸酶
酪氨酸酶是一种含铜氧化酶,可以使单酚(酪氨酸)氧化生成邻二酚(多巴),后者可进一步氧化生成多巴醌,这是黑色素的前体,广泛存在于动植物中[27-28]。除了催化游离的酪氨酸,酪氨酸酶也可以氧化蛋白质中的酪氨酸残基[29]。酪氨酸酶在黑色素瘤细胞中过表达,过度的催化氧化是黑色素瘤产生的重要诱因之一[28]。
依据酪氨酸酶催化的底物结构,Sun等[30]设计并合成了三肽化合物Phe-Phe-Tyr(9,图4)。在酪氨酸酶的催化下,化合物9 首先被氧化成黑色素样的二聚体,进一步自组装形成纳米颗粒。这些纳米颗粒可以抑制细胞内微管蛋白的组装,干扰细胞骨架的形成,诱发严重的G2/M 期阻滞。除此之外,随着化合物9 的作用,在黑色素瘤细胞中引起严重的线粒体功能紊乱。小鼠体内研究表明,经过化合物9 瘤周注射治疗后,耐药黑色素瘤的肿瘤体积比对照组减少了87.4%。在抗黑色素瘤药物的研发中,EISA 策略给药物研究一种新的启发。
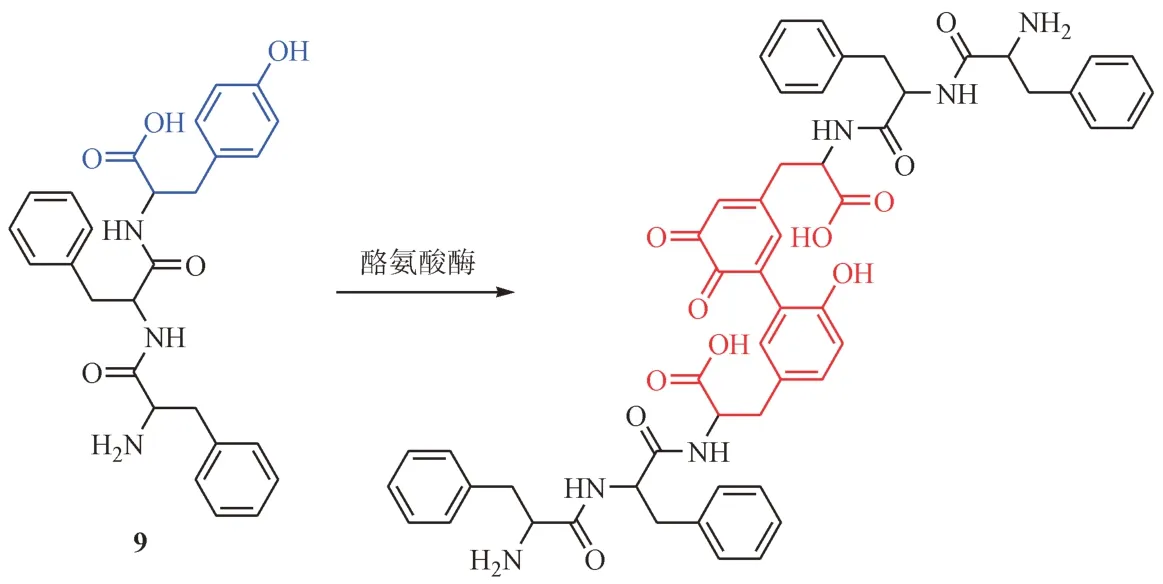
图4 酪氨酸酶催化底物氧化生成二聚体的结构和反应示意图
1.4 γ-谷氨酰转肽酶
γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,GGT)是一种细胞膜结合酶,可以催化γ-谷氨酰基的裂解[31]。GGT 在体内谷胱甘肽(glutathione,GSH)的代谢和稳态中发挥着重要作用,可以利用胞外GSH,为肿瘤细胞快速的生长分裂提供充足的半胱氨酸,从而促进肿瘤的发生、扩散和转移[32]。GGT 在多种肿瘤细胞,如肝癌、宫颈癌、乳腺癌和卵巢癌中均过表达[33-34]。
Ye 等[35]开发了一种基于GGT 响应的新型18F标记的自组装探针18F-1G(10,图5),可以用于肿瘤的正电子发射断层扫描(positron emission tomography, PET)成像。探针10 被肿瘤细胞膜上标志物GGT 特异性切割掉N-端半胱氨酸上连接的γ-谷氨酰基,实现肿瘤细胞的靶向摄取。同时胞内过量的GSH 又可以破坏N-端半胱氨酸上的二硫键,分子间的氨基硫醇基团和氰基发生高效的点击缩合反应形成二聚体,最终由于π-π堆积作用形成直径约为142 nm 的纳米颗粒滞留在肿瘤细胞中。研究发现,高表达GGT 的肿瘤细胞(HCT119)对探针10 的摄取是正常细胞(L929)的4 倍,而较高的靶向摄取和蓄积实现了PET信号的增强。
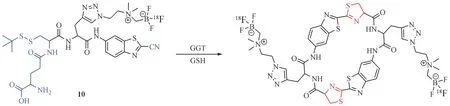
图5 GGT与谷胱甘肽参与的点击缩合反应示意图
1.5 胱天蛋白酶3
胱天蛋白酶(caspase)家族被发现与细胞凋亡进程的启动和执行密切相关,caspase-3 是细胞凋亡执行酶(executioner caspases)的一种。通过特异性地切割天冬氨酸和半胱氨酸之间的肽键,破坏不同结构和功能的蛋白质而导致不可逆转的细胞凋亡[36]。利用caspase-3 特异性水解肽键的能力,开发出靶向caspase-3 的EISA 探针实现了肿瘤细胞凋亡成像。
Wang等[37]设计合成了光声(photoacoustic,PA)成像探针1-RGD(11,图6),分子结构中包含一个2-氰基-6-羟基喹啉(2-cyano-6-hydroxyquinoline,CHQ),一个D 型半胱氨酸(D-Cys),一个可被caspase-3 识别和裂解的多肽序列(DEVD),一个可供GSH还原的二硫键,一个近红外荧光基团(ICG),以及一个靶向整合素αVβ3的配体RGD 序列。通过整合素靶向进入肿瘤细胞后,探针11 经过Caspase-3的水解和GSH 的还原产生了游离的氨基硫醇基团,再与同分子CHQ 基团的氰基发生分子内点击缩合反应最终形成环状分子。分子间疏水作用和π-π堆积作用的加强诱发自组装形成纳米颗粒,而颗粒中高密度的ICG 由于聚集荧光淬灭(aggregation-caused quenching,ACQ)效应,不得不增强非辐射弛豫过程,这样就可以检测到更加清晰的PA 信号。由此,探针11 能够实现对肿瘤中凋亡细胞的PA成像,可用于实时评估体内肿瘤的治疗效果。
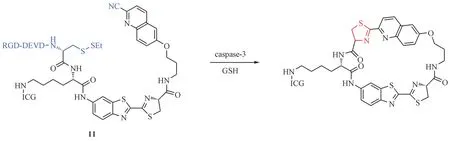
图6 Caspase-3和谷胱甘肽(GSH)参与的点击缩合反应
在EISA 中使用的酶种还包括弗林蛋白酶[38],胰蛋白酶-1[39]等,而且越来越多的课题组正尝试将更多的酶应用于EISA,未来的EISA 将迎来“百花齐放”的研究热潮。
2 细胞器靶向EISA在肿瘤治疗中的研究进展
细胞器在细胞的各项生命活动中起主导作用,靶向性破坏肿瘤细胞器的功能,可以提高对肿瘤尤其是耐药肿瘤的治疗效果[40]。将EISA 技术与细胞器靶向结合,可以实现小分子化合物在肿瘤细胞器中的定点蓄积,提高治疗的选择性。目前,研究较多的靶向肿瘤细胞器的EISA 策略主要有两种[14]:(1)给予小分子化合物以靶向细胞器的官能团;(2)选择细胞器上过表达的酶设计EISA小分子化合物。
2.1 线粒体靶向
三苯基膦(triphenylphosphinium,TPP)阳离子可以在较高的线粒体膜电位驱动下,实现线粒体积累,是一种靶向线粒体的功能基团[41]。Wang等[42]将TPP 连接在含有磷酸酪氨酸的四肽衍生物上,开发出了具有靶向Saos-2细胞线粒体功能的化合物1P(12,图7)。化合物12 在Saos-2 细胞膜上过表达的ALP 作用下去磷酸化,纳米结构发生转化,内吞进入肿瘤细胞后,借助NBD 基团,在CLSM图像中观察到线粒体处存在强绿色荧光。随后线粒体功能紊乱,向细胞质中释放出大量细胞色素c,激活caspase介导的细胞凋亡通路,最终导致Saos-2细胞的死亡。研究发现,缺乏TPP 的对照化合物由于没有线粒体靶向能力,对Saos-2细胞几乎没有任何杀伤作用。
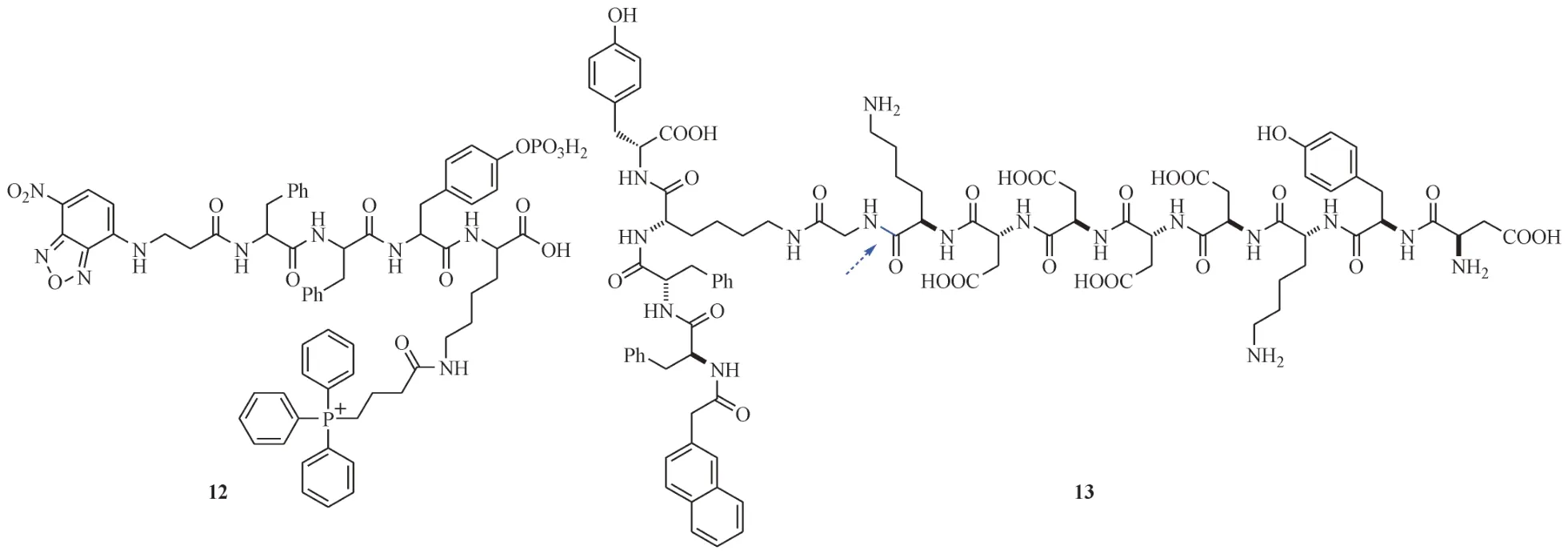
图7 线粒体靶向的化合物结构
肠激酶(enterokinase,ENTK)存在于HeLa 细胞线粒体[43],可以特异性地识别DDDDK 短肽序列,并将切下序列的羧基端。He 等[43]设计合成了化合物D-2T¯FLAG(13,图7),结构中含有脂溶性的萘环和苯丙氨酸,亲水性的DDDDK 短肽序列,并通过一个甘氨酸连接,分子的两亲性可以使其自组装形成胶束。化合物13(200 µmol/L)与HeLa细胞共孵育2 和24 h 后的TEM 图像显示,线粒体分别被纳米颗粒和纳米纤维包围。另外,形成的胶束可以包被抗肿瘤药物(如多柔比星),增强对HeLa细胞的杀伤作用。
2.2 高尔基体靶向
破坏细胞高尔基体的功能将严重影响蛋白质的合成,翻译后修饰和运输。Tan 等[44]设计了一个含有磷酸半胱胺的探针pS1(14,图8),与O-磷酸键相比,S-磷酸键是更好的ALP 底物,具有更高效的去磷酸化效率。经过EISA 与二聚体化(dimerization)形成纳米纤维,最后被高尔基体中富半胱氨酸的蛋白(cysteine rich proteins,CRPs)以二硫键捕获。将10 µmol/L 的探针14 与HeLa 细胞共孵育8 min,在高尔基体处观察到NBD 基团明显的强绿色荧光,表明该探针对HeLa 细胞具有良好的瞬时靶向性。
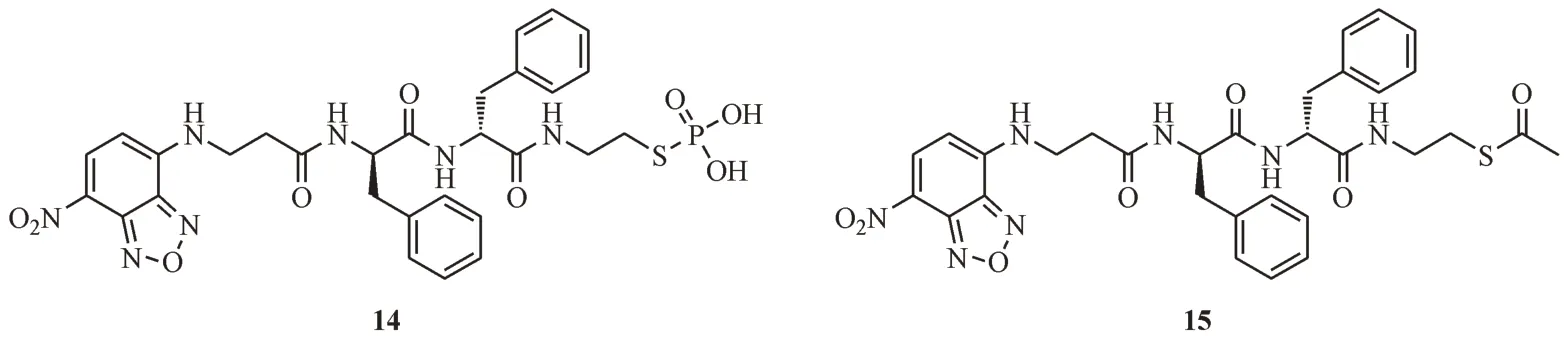
图8 高尔基体靶向的化合物结构
尽管HepG2 细胞也过表达ALP,但是胞内过量的GSH 会干扰高尔基体中CRPs 的捕获。Tan等[45]对探针14 进行了优化,用乙酰基替代磷酸基团,构成了硫代乙酸酯,得到探针15。通过高尔基体相关的硫酯酶(Golgi apparatus-associated thioesterases)对硫代乙酸酯的水解,在高尔基体原位形成与探针14 相同的半胱胺产物,可以降低胞内过量GSH 带来的干扰。相似的反应过程确保了探针15(图8)对高尔基体的瞬时靶向能力,与HeLa 细胞共孵育4 min,就可以很容易地将高尔基体区分出来。虽然两种探针都是以二硫键与CRPs 接合,但是探针15 却可以靶向更多细胞系(如HepG2,HEK293 等)的高尔基体,实现荧光成像,这可能与硫酯酶普遍存在于大多数细胞系有关。机制研究显示,探针14 和15 主要通过扰乱内质网和高尔基体的蛋白质运输而导致细胞死亡。
2.3 细胞核靶向
细胞核是重要的细胞器,许多化疗药物的作用靶点位于细胞核,如喜树碱类抗肿瘤药物的靶标拓扑异构酶Ⅰ。由于进入细胞核的药量少,削弱了其抗肿瘤活性[46]。因此,靶向细胞核增加药物的蓄积量,有着增加抗肿瘤活性的潜力[47]。
Liu 等[48-49]报道了第1 例核靶向的EISA 分子,并在随后的研究中将其应用在骨肉瘤细胞(SJSA-1,Saos-2)中。探针16(图9)包含1 个N-端的荧光基团NBD,1个C-端的磷酸酪氨酸,4个亮氨酸作为自组装片段。探针16首先由细胞膜上和细胞内的ALP 切除磷酸基团,触发自组装形成纳米带,积聚在细胞核,尤其是核仁中。纳米带扰乱肌动蛋白和微管蛋白的动力学平衡,破坏了细胞骨架,细胞核完整性丧失,核隆起和核起泡导致肿瘤细胞死亡。蛋白质组学分析表明,探针16 的核靶向机制为纳米带与组蛋白H4的共组装。
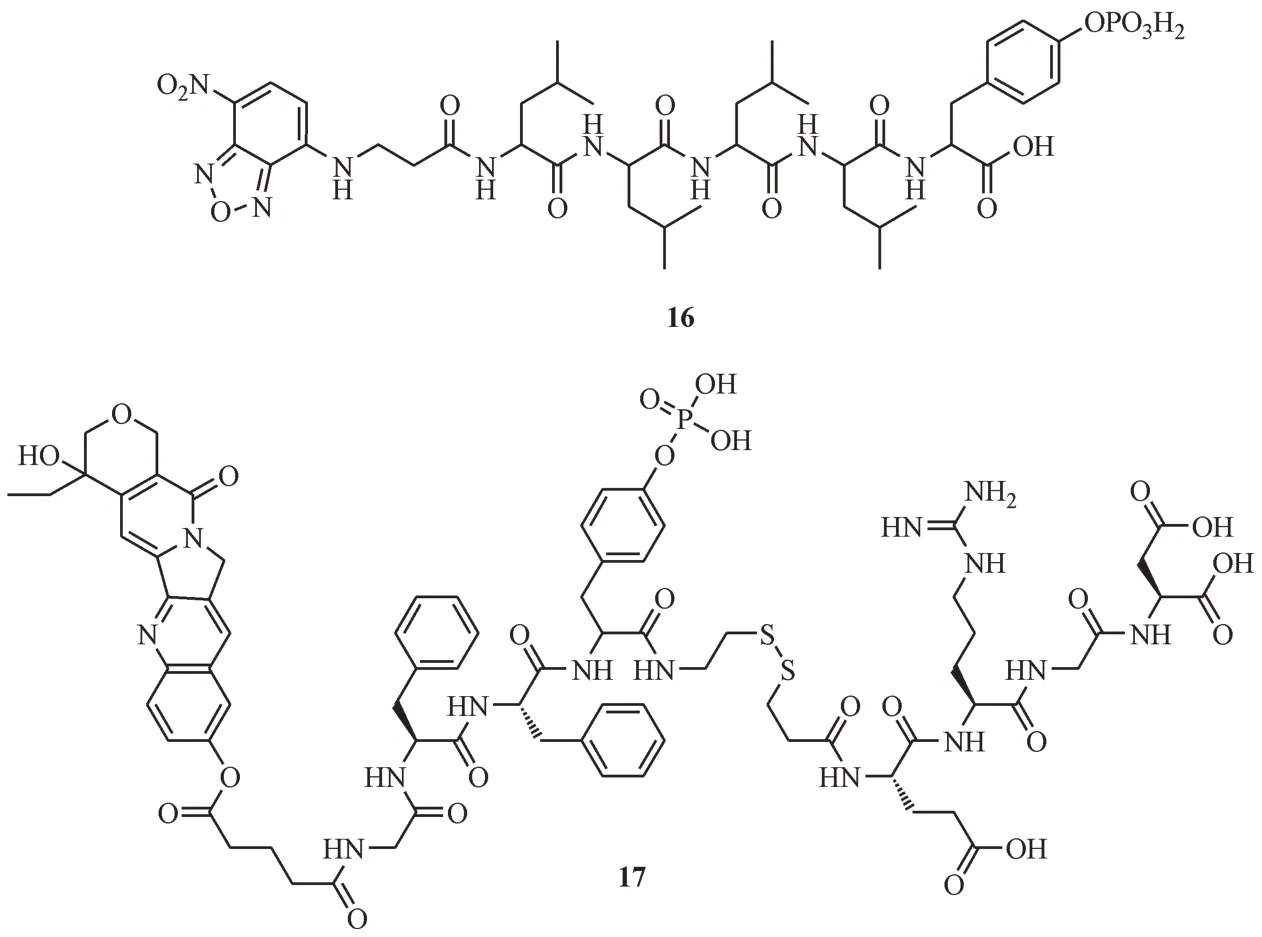
图9 细胞核靶向的化合物结构
Zhan 等[12]报道了一种含有10-羟基喜树碱(10-hydroxycamptothecin, HCPT)的化合物HpYss(17,图9),可以达到抑制肝肿瘤(HepG2 细胞)生长和转移的目的。化合物17 包含3 个片段,分别是抗癌活性片段HCPT、自组装片段以及靶向整合素αVβ3的配体RGD 序列,其中自组装片段与配体序列以二硫键连接。通过细胞膜上过表达ALP 的去磷酸化,首先自组装形成纳米颗粒,再经由αVβ3介导的内吞机制进入细胞,在胞内过量GSH 的氧化还原反应下脱去配体序列,进一步自组装形成直径小于9 nm 的纳米纤维,经由核孔进入细胞核。体内实验显示,化合物17 对实体瘤有着很强的抑制能力,并且能够抑制肿瘤的转移。不同于其他细胞器,细胞核是肿瘤生长的关键,这一研究表明,EISA 策略使得HCPT 在肿瘤细胞核内蓄积,有望成为更高效的抗肿瘤手段。
2.4 其他细胞器靶向
溶酶体是细胞内外物质降解与循环的重要细胞器,其酸性的内部环境为多种水解酶参与内吞、自噬和细胞凋亡等过程提供了支撑[50]。因此,溶酶体是抗肿瘤的重要靶点。Wu等[51]开发的化合物Py-Yp-Lyso(18,图10)可以通过ALP 介导的自组装形成纳米纤维,经HeLa细胞摄取后,分子中携带的吗啉环因易被质子化,使得化合物18 形成的纳米纤维可以靶向并破坏溶酶体的膜结构,大量溶酶体内容物泄漏,最终杀死肿瘤细胞。Yang等[51]设计的化合物Pro-1P-NMe(19,图10)在被细胞摄取后,在溶酶体的酸性条件下脱除二甲胺基,所释放出的磷酸基团又被溶酶体内酸性磷酸酶(acid phosphatase,ACP)降解,启动自组装形成纳米纤维。
内质网参与生物体脂质的合成,大多数蛋白质的折叠和修饰,干扰内质网稳态可能会引起程序性细胞死亡[53]。Kim 等[39]开发出了可以靶向卵巢癌OVSAHO细胞内质网的化合物Nap-ffky-GDKKKKDYK(20,图10),富含赖氨酸的侧链是胰蛋白酶-1(trypsin-1)的良好底物,由于胰蛋白酶-1 过表达在OVSAHO 细胞的内质网上,所以化合物20 可以在内质网上原位自组装,导致内质网应激进而抑制肿瘤细胞。
3 EISA在肿瘤成像中的研究进展
由于非侵入性和可视化的特点,分子成像技术已经成为研究生物分子变化过程的通用工具,同时也是肿瘤早期诊断的重要手段[54]。2021 年11 月,美国食品药品监督管理局批准Cytalux(pafolacianine,图11)作为一种靶向性荧光成像剂,用于术中卵巢癌病变的可视化检测。Pafolacianine是一种叶酸类似物,能够靶向叶酸受体α(folate receptor alpha,FRα)过表达的肿瘤细胞以实现近红外荧光成像(near-infrared fluorescence imaging,NIRF)[55]。Pafolacianine 的Ⅲ期研究显示,卵巢癌术中成像,33.0%(95%CI,24.3 ~ 42.7;P<0.001)的患者被发现在未计划切除或未发现异常的组织中存在额外病变,远远超出10%的阈值,表明其具有良好的术中恶性肿瘤导航切除能力[56]。2022年12月,FDA又批准了肺癌作为pafolacianine的新适应证。

图11 分子成像探针结构
近年来,EISA 技术在分子成像领域的应用引起了越来越多的关注。Wu 等[13]开发了PA 成像探针IR775-Phe-Phe-Tyr(H2PO3)-OH(21,图11),与ALP 孵育3 h,探针21 自组装形成纳米颗粒,在814 nm 处的荧光发射峰强度下降为未孵育时的1/27。小鼠瘤内注射探针21 的4 h 后,实验组的PA 信号强度为对照组(提前静脉注射ALP 抑制剂)的2.3倍。由于纳米颗粒的形成,近红外染料发生荧光猝灭,实现了对ALP 过表达的HeLa 细胞PA 成像。相较于单模态成像,多模态成像技术利用两种或两种以上成像方式,可以获取活体目标的互补信息,发挥出多种成像方式的优势[15]。
最近,Ye 课题组发表了一系列将EISA 应用在肿瘤多模态成像领域的创新性研究工作,为肿瘤的早期诊断带来了新的思路与方法[57-59]。化合物P-CyFF-Gd(22,图12)是NIRF 和磁共振成像(magnetic resonance imaging,MRI)双模态探针,分别以含卤半花菁和配体DOTA 螯合的金属Gd 作为NIRF 和MRI 信号片段,二苯丙氨酸作为自组装片段,而磷酸基团的存在可以实现NIRF 信号的猝灭[57]。当探针22 在HeLa 细胞膜上过表达ALP 的催化下去磷酸化,NIRF信号从“关”到“开”,并启动自组装形成纳米颗粒,随后内吞进入细胞,实现对肿瘤的双模态成像。EISA 既能实现对NIRF 信号“关-开”的状态控制,又增大成像探针的信噪比。将配体NODA 与放射性元素68Ga 螯合又构成了NIRF和PET双模态探针[58]。

图12 多模态成像探针结构以及逆电子需求的狄尔斯-阿尔德(IEDDA)反应示意图
随着逆电子需求的狄尔斯-阿尔德(inverse electron demand Diels-Alder,IEDDA)反应在分子成像领域的应用[60],Ye 课题组[59]对探针22 进行了优化,在自组装片段中加入赖氨酸,以结合反式环辛烯(trans-cyclooctene,TCO),得到了探针P-FFGd-TCO(23,图12)。探针23 可以发生类似的EISA 靶向肿瘤细胞,实现NIRF 和MRI 双模态成像。此时再静脉注射含PET 信号片段的化合物Tz-68Ga(24,图12),可以快速地与纳米颗粒表面的TCO 基团发生IEDDA 反应(图12),最终实现三模态成像。酶促自组装相关分子的理化性质详情见表1。
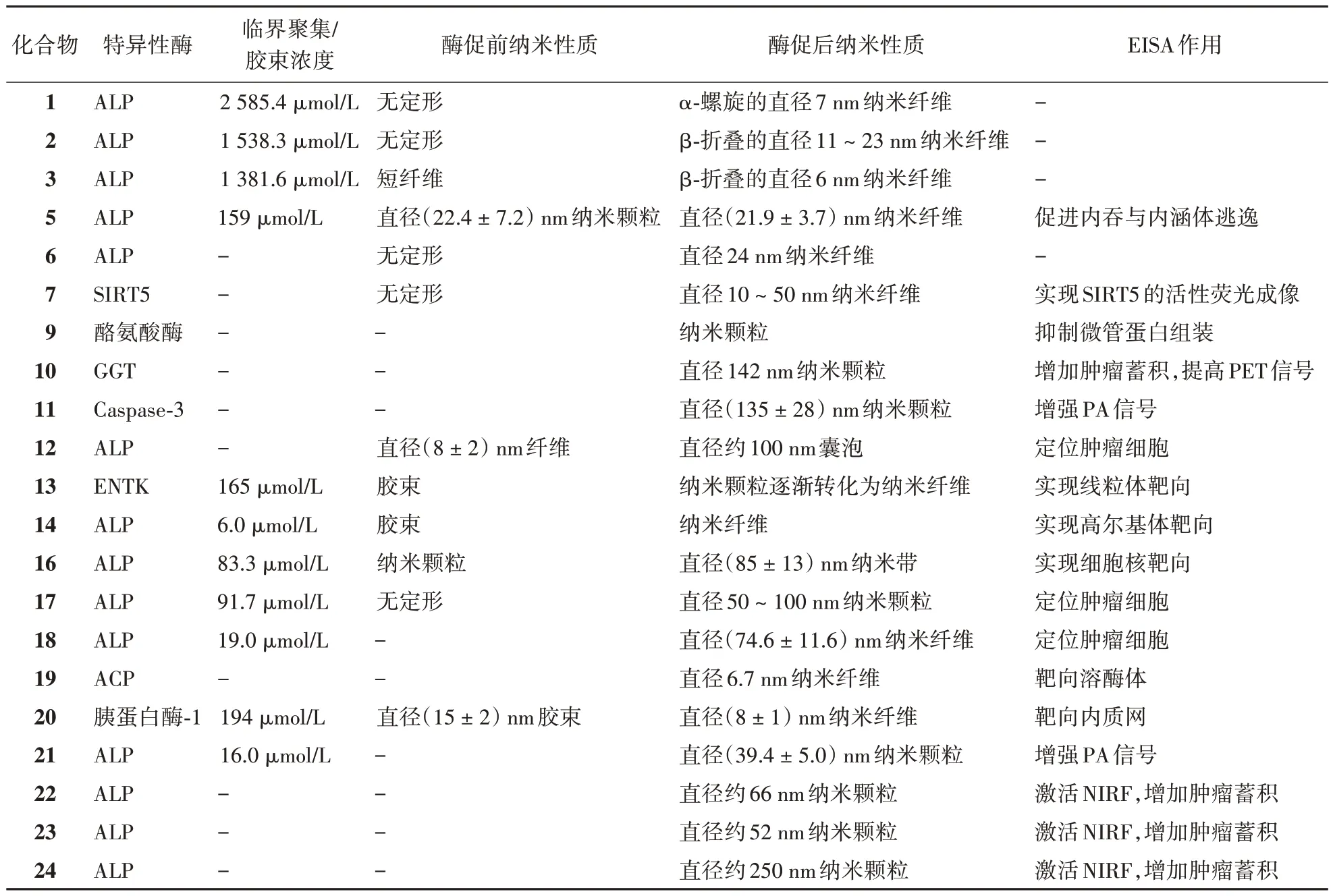
表1 酶促自组装相关分子的理化性质总结
4 总 结
虽然近几年来EISA 取得了长足的进步,但是仍然有些难题亟待解决。(1)可供选择的酶种类较少。借助肿瘤中高表达的酶,小分子化合物可以自组装形成纳米结构,增大在肿瘤中的积累,但是一种酶促策略难以适用于多种肿瘤细胞,而且正常组织中的酶活性会干扰小分子的原位自组装,因此寻找肿瘤,甚至其他疾病特异性的酶将极大促进EISA的发展。(2)给药剂量大,抗癌效率较低。多数研究中的给药剂量仍然处于微摩尔级别,抗癌效率较低,这与小分子较高的CAC 相关,未来对小分子自组装能力的优化,将会减少带给人体生命健康造成的隐患。伴随着对EISA 的深入研究,其在肿瘤治疗和成像方面的前景广阔。EISA 靶向细胞器,走进亚细胞单位,对自组装实现精确调控,引发细胞器功能障碍,减少耐药性的发生,为肿瘤的治疗带来新的策略。EISA 可以实现成像信号“关-开”的控制,延长成像时间,为肿瘤的成像提供新的思路。期待EISA技术能够为肿瘤的诊断和治疗发展带来更多可能。
——可作为磷酸盐库再利用!

