药物掩味技术及其味觉评价技术的研究进展
冯婉婷,邓耀辰,张 慧,李 蒙,王增明,郑爱萍*
(1华北理工大学药学院,河北 063210;2中国人民解放军军事科学院军事医学研究院毒物药物研究所,北京 100850;3广东医科大学药学院,广东 523822)
人体约有1万个味蕾,其对苦味的感受过程是由苦味化合物刺激味觉细胞后产生神经冲动,信号从神经元传递至孤束核并激活其感味区域,最终传达至大脑味觉皮层使人感知苦味。迄今已发现人体口腔内具有约25 种苦味受体(type 2 bitter taste receptor, TAS2Rs)[1]。TAS2Rs 分离阈低,当味蕾接触极少量苦味物质时也可感味,并且苦味感觉时间明显比甜、咸、酸味持续更久。对于口服制剂来说,药物的不良口感会使患者产生心理抵触或生理应激反应,部分药物的苦味或强烈刺激性气味致使患者发生呕吐或呛咳,为达到药效需进行补药,但多次给药会造成给药剂量不准,存在用药安全的隐患[2]。为了提高患者顺应性及给药剂量准确性,药物掩味成为制剂处方及工艺设计的重要考量部分。可通过更改剂型、变更工艺、处方内添加矫味剂等方法进行掩味。其中,解决口感问题的最佳手段为更改剂型,但部分药物变更剂型后可能限制其适用范围,如老人、儿童及虚弱患者等特殊人群,当剂型变更为吞咽片、丸剂或胶囊等剂型时不易吞咽,同时可能会改变原有剂型的特色和优势;并且制剂变更需要大量药理药效学实验验证,工作量几乎相当于研发一款新制剂[3]。关于剂型变更的内容本文不进行过多探讨,主要针对传统掩味技术、新型掩味技术以及对掩味效果的评价方法进行介绍。常规药物掩味多为处方工艺变更、改良,利用各类新型掩味技术遮蔽药物不良气味,联合味觉评价手段对制剂口感进行检测验证。
1 传统药物掩味技术
传统掩味技术如使用聚合物对药物包衣;将药物制备成微囊、微球、脂质体;制备离子交换树脂复合物;制备环糊精包合物;添加矫味剂(甜味剂、芳香剂、泡腾剂、胶浆剂等)等。表1 为传统掩味技术原理及工艺优缺点,表2列举了传统掩味技术独用或联用的相应实施案例。

表1 传统掩味技术原理及技术优缺点

表2 传统掩味技术相应实施案例
2 新型药物掩味技术
2.1 熔融制粒
与传统包衣掩味法相比,熔融制粒法不需要复杂的包衣过程即可以直接得到掩味颗粒。其掩味原理是将药物及低熔点辅料混合、搅拌、加热,辅料熔融软化覆盖于药物表面,物料粘连后形成颗粒,此时药物包封于颗粒内,因此降低了药物与味蕾的接触量,从而达到掩味[15]。Sabere 等[16]使用熔融造粒法制造扑热息痛咀嚼片,结果显示4 min内可达到50%药物释放率,药物可在30 min 内全部释放,制得的扑热息痛咀嚼片口感良好,可有效掩盖药物不良气味。Bebawy 等[17]以十六烷基醇或氢化蓖麻油作为载体,采用熔融造粒技术制备利培酮口崩片(ODMT)并对其苦度进行评价。结果表明所制ODMT 与市售利培酮液体制剂相比,ODMT制剂含量均匀性高,剂量准确灵活,适合儿童使用,具有良好口感和较高接受度。
2.2 热熔挤出技术
热熔挤出技术(hot-melt extrusion, HME)的出现可以弥补传统熔融法制备固体分散体的不足,近年来有大量关于HME 的文献报道,该技术可达到增溶、掩味和提高稳定性的目的。HME 是一种可用于工艺生产的技术,制备简单,自动化程度高,制备过程中无需溶剂,其独特的混合机制可使药物和载体达到分子水平的混合。通过HME,药物以无定形状态分散或者以分子状态溶解于载体中,通过二者间的相互分子作用使药物包埋于载体,阻止药物与味蕾接触,从而达到掩味成效[18]。Li 等[19]采用HME,将Eudragit®RL PO 作为聚合物载体,制备了阿奇霉素固体分散体,通过HME既解决了阿奇霉素的苦味也改善了其低溶解度的问题。尽管HME近年来成为制备无定形固体分散体的常用方法,但也存在局限性,例如挤出过程中可能出现离模膨胀;温度不稳定造成分层现象;热敏感药物、高熔点药物、黏性聚合物均不适宜使用HME制备。
2.3 3D打印技术
3D 打印(3D printing technology, 3DP)是一种逐层制造技术,预先使用计算机软件辅助设计制剂结构,而后将药物材料通过逐层打印的方式制成特定性状、多层结构和不同释放方式的制剂[20]。1989 年Scott Crump 发明熔融层积成型技术(fused deposition modeling, FDM),又称熔丝制造(fused filament fabrication, FFF),并以此为依托建立美国STRATASYS 公司,将该技术注册专利[21]。FFF为一种可用于药品连续生产的前沿三维建模技术,其工艺原理以HME 为基础,将药物材料注入50 ~ 100 µm 的热喷嘴,根据计算机辅助软件设定的轮廓信息和填充轨迹做平面运动,熔化的聚合物以预定义的方式一层一层地沉积,挤出的药物材料于搭建板表面快速冷却固化。通过3DP 可实现药物个体化,定制不同剂量、组合的复方制剂,提高患者顺应性的同时避免了用药错误。3DP对制剂外观、适口性等优化后可增加儿童患者顺应性,同时可避免使用特定赋形剂以减少对过敏患者的刺激[22]。Zhang 等[23]采用熔融层积成型3D打印(FDM 3DP)技术开发了一种用于控制药物输送的多功能核壳模型,以羟丙基纤维素(HPC)和羟丙基甲基纤维素(HPMC)为基质材料、Eudragit RSPO(E RSPO)为缓释剂。其结果显示所设计的核壳模型可成功通过FDM 3DP 技术生产,密封性能良好。核壳模型可包裹不同制剂,如溶液、水凝胶和固体片剂,可被开发为多功能药物输送系统。E RSPO 的组成可以控制和调整核壳模型的缓释效果和滞后时间长度。该研究制备的核壳模型对于首过效应显著或不良气味药物具有显著优势,同时还可提高热敏药物的配制和输送。Ehtezazi 等[24]以布洛芬及扑热息痛为模型药,采用FDM 3DP 制备单层或多层快速溶解口服薄膜,并将掩味层与药物层分离。其结果证明所制备的快速溶解口服膜重量及含量混匀度符合药典要求,掩味效果良好,但较低温度下掩味层可能不够稳定。
2.4 制备复合物
2.4.1 硅酸镁铝吸附 硅酸镁铝是一种具有吸附药物能力的黏土材料,可通过吸附作用将药物嵌入硅酸镁铝空隙内,阻止药物与味蕾接触从而达到掩味效果。Kharb等[25]利用动态吸附法制备昂丹司琼(ONS)与硅酸镁铝吸附体系。其红外光谱分析表明硅酸镁铝的阳离子基与ONS 的阳离子基相互作用或替换,X射线衍射表明所制备的体系结晶度较ONS 低,证明二者存在分子间相互作用。Kharb 认为ONS 吸附于硅酸镁铝表面主要是由于静电相互作用和氢键作用,从而使ONS 嵌入硅酸镁铝层间的空隙;在pH 6.8 磷酸盐缓冲液中,ONS释放速率较低,从而达到药物苦味掩蔽,即药物于唾液pH中不释放,导致药物浓度低于苦味阈值。
2.4.2 药物插层蒙脱石 Lee 等[26]通过阳离子交换反应将药物插入蒙脱石中,制得西地那非-蒙脱石纳米复合物,使用该方法将西地那非的味道掩蔽;同时于复合物表面涂覆碱性阳离子聚合物聚乙烯缩醛二乙基氨基乙酸酯(AEA),从而提高复合物在模拟胃液中的释放速率。将所得AEA 涂层的西地那非-蒙脱石纳米复合物与市售Viagra®制剂相对比,自制制剂在pH 1.2模拟胃液中2 h累积溶出度达到90%,而市售制剂达到100%,体外溶出稍慢于市售制剂,但体内实验显示自制制剂药物浓度-时间曲线下面积和最大血药浓度均高于市售制剂;复合物在模拟口腔条件中表现为抑制释放,表明该纳米复合物具有掩盖药物味道的效果。Oh等[27]制备阿立哌唑-蒙脱石纳米复合物,为了进一步提高其掩味效果及药物溶解度,使用AEA 包覆复合物。中性pH 条件下的体外溶出度试验表明,在前3 min内,AEA涂层的阿立哌唑-蒙脱石纳米复合物的药物释放量被显著抑制(< 1%),表明该复合物可成功遮蔽阿立哌唑的不良气味。在pH 1.2模拟胃液中,AEA 涂层复合物在3 min 内基本不溶出,10 min内药物溶出达到80%,前2 h内的药物溶出为95%,因此该复合物既能掩盖阿立哌唑气味,又能显著提高其溶解度。
2.4.3 介孔分子筛 介孔材料为一种孔径介于微孔与大孔之间的具有巨大表面积和三维孔道结构的新型材料,可分为硅基和非硅基两类。图1为一种有序介孔分子筛合成方法及外观模型。介孔分子筛的掩味机制是将药物吸附进内部空腔或孔道从而减少药物接触味蕾。介孔材料在生物制药领域得到良好应用是因为以下几点:(1)介孔可调节、容量大,可用来负载剂量较大的药物或生物活性物质;(2)比表面积大,利于吸附药物;(3)介孔有序分布,使药物的吸附和释放具备良好的重复性及均匀度;(4)材料表面含有大量硅羟基,因此可针对孔洞的内外表面进行化学修饰,从而达到对载药及药物释放的精准调控。
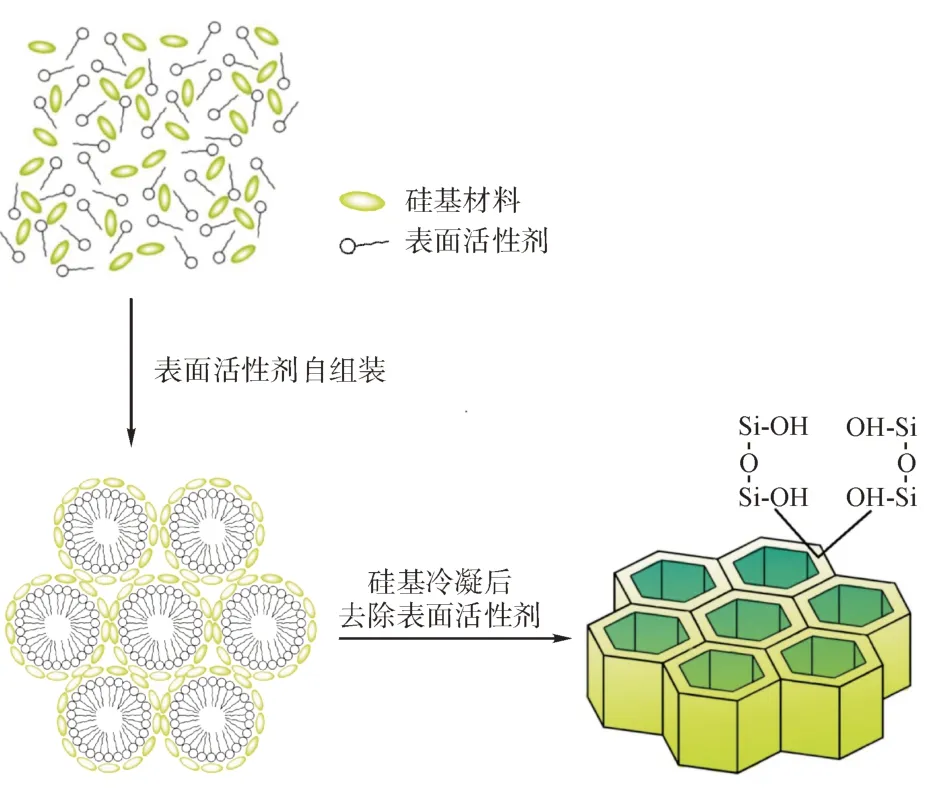
图1 一种有序介孔分子筛合成机制及外观模型
Wu 等[28]将西替利嗪作为苦味模型药,使用水热法合成3 种不同介孔分子筛材料(MCM-41、MCM-48和HMSS),采用浸渍法制备西替利嗪-介孔分子筛复合物,并通过X 射线衍射、傅里叶红外光谱、氮物理吸附和热重分析等手段对其进行表征。通过人体口尝法评测介孔分子筛的掩味性能。结果表明MCM-41、MCM-48 和HMSS 均具有较大的西替利嗪负载能力,依次为25.12%、32.91%和50.00%。通过介孔分子筛对口腔黏膜和味蕾进行阻隔,可以有效降低西替利嗪的苦味,减少刺激。
2.5 苦味抑制剂
苦味受体拮抗剂通过同苦味化合物竞争性与苦味受体结合,以达到阻止苦味传导的目的。已知的苦味掩盖剂有单磷酸腺苷(AMP)、磷脂酸、4-(2,2,3-三甲基环戊基)丁酸、氨基酸衍生物和肽类等[29]。Li 等[30]将三氯蔗糖、阿魏酸钠和β-环糊精单独、两两联用、三者联用(共7 种组合)对黄柏水煎液掩味,并考察黄柏掩味前后的化学成分变化。结果显示3 种掩味剂单独或联合应用对黄柏水煎液均具有较好的抑苦作用,联合掩味优于单独使用一种抑制剂,且掩味后对药物化学成分无显著影响。Zhang 等[31]使用6.66 µg/mL 新甲基橙皮苷二氢查耳酮(NHDC),36.66 µg/mL 乳酸锌,66.66 µg/mL γ-氨基丁酸(GABA),1 mg/mL 酪朊酸钠,3.33 µg/mL 三氯蔗糖,5.80 µg/mL 全脂乳粉,200 µg/mL AMP,83.33 µg/mL新地奥明,330 µg/mL阿魏酸,6.66 µg/mL 聚葡萄糖10 种苦味抑制剂对苦瓜粉浸泡液进行矫味,考察不同苦味抑制剂对苦瓜粉苦味、后苦味及涩味的抑制程度。其正交试验结果表明乳酸锌对苦瓜粉浸泡液感官影响最为显著,当苦瓜粉与苦味抑制剂浓度为0.60 mg/g NHDC、3.98 mg/g GABA、4.46 mg/g乳酸锌时,苦瓜粉浸泡液苦味、后苦味几乎消失,并无其他异味。其中NHDC 对苦瓜粉苦味、后苦味抑制作用最强,乳酸锌对苦瓜粉后苦味抑制效果较好,GABA 对苦瓜粉苦味抑制效果较好,酪朊酸钠对苦瓜粉涩味的抑制作用最明显,三氯蔗糖、聚葡萄糖、酪朊酸钠、全脂乳粉会增加体系的甜味及后甜味。尽管苦味抑制剂极少用量即可达到掩味,且效果强于普通矫味剂,但部分苦味抑制剂仅能抑制一种或一类药物的苦味,同时关于苦味抑制剂的毒理及安全性尚不明确,限制了其广泛应用。
3 掩味效果评价方法
口感评测是验证掩味效果的关键检测环节,药物口感是指当药物在口腔中进行溶解、释放和吸收,药物与唾液、味蕾、黏膜等相互作用产生的综合口感。可分为真实滋味、砂砾感、黏附感、刺激性等。测试药物苦度的可行性方法可分为体外评价手段和体内评价手段两种。
3.1 体外评价手段
3.1.1 功能性磁共振成像技术 功能性磁共振成像(functional magnetic resonance imaging,fMRI)是一种神经影像学技术,分为脑血流测定技术,脑代谢测定技术,神经纤维示踪技术,其中灌注加权和血氧水平依赖效应成像(BOLD)因其无辐射性,能快速反应大脑实时变化情况,应用最为广泛[32]。Zhao等[33]建立“标准物质浓度-志愿者感官等级-脑信号强度相关性”标准方法的研究思路,将标准奎宁溶液浓度数据、人体感官评价及脑成像图像相结合,通过其关联进行分析,达到对味觉评价的客观量化与标准化。Kaskan 等[34]使用3只猕猴研究味觉反应是否受偏好和水合状态调节的影响,研究者随机顺序注入蔗糖、柠檬酸或蒸馏水0.1 mL,同时使用fMRI 扫描猕猴。通过对甜、酸与蒸馏水的BOLD 反应进行组水平分析,在扫描仪外进行的选择测试显示,所有猕猴都强烈偏爱蔗糖,而不是柠檬酸或水。猕猴对蔗糖的BOLD 反应比柠檬酸更大。最后实验者通过对比猕猴口渴和饮水后对蒸馏水摄入的BOLD 反应,研究水合状态水平的影响,结果证明部分内侧额叶皮层BOLD反应在随意饮水后减少。Canna 等[35]设计了一款用于fMRI的低成本、模块化及可扩展性的设备,该设备灵活,可进行复杂多维的味觉实验。报告提供了关于该设备硬件和软件架构的完整描述,通过感知过程中对5 种味觉及强度的BOLD 反应,考察设备用于fMRI味觉评估实验的情况。结果证明当测定液体注入设备后,该设备可被激活味觉通路内的多个集群,并且显示出精确时间以分辨事件相关分析的可能性,适用于各种fMRI 味觉评测实验。尽管fMRI 技术优势明显,但仍存在操作复杂、影响因素多、经济成本高等缺点。
3.1.2 体外溶出 对于依赖胃液pH 释放或延缓、阻断药物与苦味受体接触的制剂,可通过考察模拟唾液中的药物释放量,定量检测药品在体外的溶出情况,以评价制剂掩味效果。体外溶出实验的优势在于简单易行,试验周期短,重复性好,成本低,适合制剂掩味处方开发时的快速评价。人工唾液一般为体外溶出实验的常用介质,可使用磷酸将其调节至合适pH[36],表3 为3 种人工唾液配方及详细用量。Guimarães 等[37]使用聚苯乙烯磺酸钠(SPS)和聚丙烯酸钾(PP)作为掩味材料,以质量比1∶1的药脂比制备氯喹树脂制剂,使用电子舌及体外溶出实验评估了药物掩味效果。电子舌多维投影技术结果显示由药物树脂复合物簇与原料药簇有显著区别,系数为0.91,数据相关性好;两种复合物于pH 6.8 的人工唾液内溶解,结果显示氯喹与PP 复合物在90 s 后药物释放超过10%,而氯喹与SPS 复合物300 s 后药物仅释放1%,低于药物苦味阈值,认为其掩味有效。Stagner等[38]使用离子凝胶和喷雾干燥技术制备异烟肼负载壳聚糖微球(INH-LCM),采用体外溶出实验评价所得制剂的掩味能力。结果表明INH-LCM 的溶出率远低于异烟肼原料药,证明可通过该掩味技术实现对药物的味觉掩蔽。
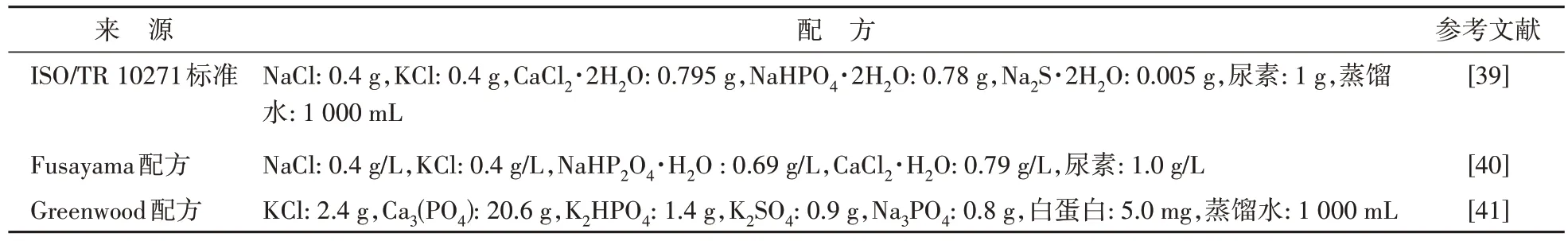
表3 3种人工唾液配方及详细用量
3.1.3 味觉指纹分析技术 味觉指纹分析技术(如:电子舌)是近年来常用的化学评价方法,可用于检测食品及药物口感,并将其客观、量化表征味觉信息的新型分析检测仪器,由味觉传感器阵列、信号采集系统和模式识别系统组成。味觉传感器阵列模拟人类感味神经,通过测定不同液体样品成分中的浓度表征其口感情况;信号处理系统将味觉信号转换成电信号,并将其储存;模式识别系统采用多元统计分析方法对信号处理系统采集的电信号进行识别、统计分析和处理[42]。目前国内常用于制剂口感评测的电子舌有日本Insent 公司电子舌和法国Alpha M.O.S 公司的α-Astree 电子舌,虽然二者均检测溶液的电位变化,但传感器工作原理不同[43]。Insent电子舌开发了人工脂膜传感器技术,通过考察膜电位的变化,评价样品味觉指标[44],其仪器组成结构如图2所示;Astree 电子舌传感器是由包裹有机层的二氧化硅晶体管组成,常用传感器一般由7 个交叉选择性液体传感器以及1 个参比电极构成,保证了传感器的灵敏度和选择性,可与人体感官评价实验和高效液相色谱分析结果相拟合[45],其仪器组成结构如图3所示。
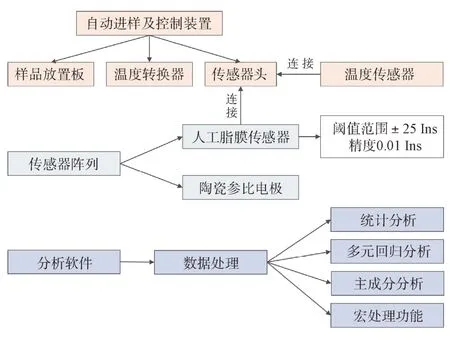
图2 日本Insent电子舌仪器组成结构
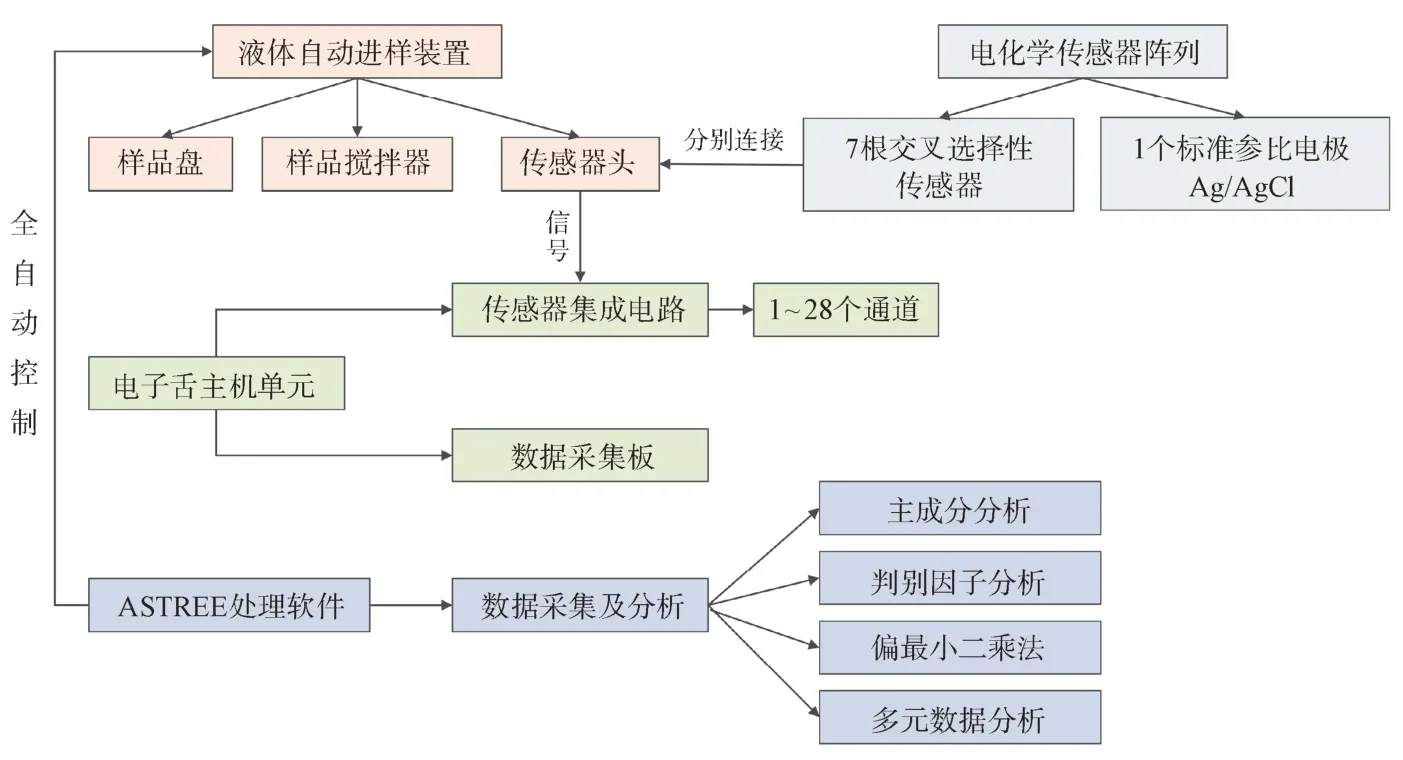
图3 法国Alpha M.O.S电子舌仪器组成结构
电子舌可以分析有毒样品,分析速度快,对液体中不同组分的高度交叉敏感性高,因此可用于人口无法直接品尝的药物风味评测,避免主观差异,不涉及复杂的伦理学问题,但所测样品必须为液体,测量条件(如药物释放过程中的温度、流体动力学参数、介质组成等)都会对结果造成很大影响,选取不当会造成与药物实际口感不一致[46],许多研究证明电子舌与人工口尝分析方法的互补性,因此绝大多数学者在研究药物口感表征时,将电子舌的测定方法与人体感官评测并行,从而得到一个更为完整、准确且不偏颇的数据结果。
电子舌可通过不同的分析方法将药物口感量化,最常用的数据分析方法是主成分分析(principal component analysis, PCA)、偏最小二乘法(partial least squares, PLS)[47]、判别因子分析(discriminant factor analysis,DFA)[48],聚类分析(CA)、人工神经网络(ANN)[49]。PCA 一般用于定性,是考察多个变量间相关性的统计方法,通过对原始数据向量进行线性变换,把多个指标降维转化为几个综合指标,从而在一定视角寻找样品间差异[50]。其横纵坐标分别表示PCA 转换得到的第一主成分PCA 1 和第二主成分PCA 2 的贡献率,贡献率越大,该主成分就可以更好反映传感器多指标的信息。PCA 算法无输出分类结果,仅可辨别某一特征,而使用BP神经网络可实现从输入到输出的映射功能,适用于组成复杂的样品,利于分类。识别指数(differentiation index , DI)为电子舌区分不同样品程度的表征,其最大值为100,大于80表示是有效的区分,DI值越大,区分效果越好,对不同样品区分越精准[50]。PLS是一种多变量统计方法,可预估一个线性回归模型对口感进行定量评价;DFA 可定性判别样品归属,利用已知样品建立模型,再对未知样品进行判别[42]。Li 等[51]使用Insent 公司TS-5000Z 型电子舌测定使用不同类型掩味剂的龙胆、苦参、穿心莲、莲子心的掩味效果,结果显示包合类掩味剂效果良好,与人工口尝评价结果基本一致;但安赛蜜做掩味剂时,电子舌却无法检测其苦味变化,与人工口尝评价得出的结果相反,不能得出准确结果,可能与电子舌的传感器类型有关。Yang 等[52]表征不同产地川芎挥发油中的辛味味觉,使用法国Alpha M.O.S 公司α-ASTREE Ⅱ型电子舌联合GC分析其辛味物质基础,并进行双变量相关性分析。结果表明电子舌能在同一类相似味觉中区分化学物质,同时证明同一电极对不同物质敏感性不同。Wang等[53]通过不同类型电子舌区分不同味道的天然药物,使用TS-5000Z 和α-ASTREE 型两种电子舌对酸、苦、甜、咸4 种味道的35 种代表性天然药物进行检测,并将数据与人体感官评价分别分析判定,结果表明总体上α-ASTREE型电子舌辨别效果更好,PCA-DA 模型算法更优于TS-5000Z。Wang 等[54]利用电子舌设计3DP 左乙拉西坦速溶片,结合实验设计和苦味掩盖模型使用ASTREE电子舌对不同配方的片剂口感进行研究。基于偏最小二乘回归分析,电子舌具有良好的味觉识别能力,而左乙拉西坦具有良好的线性感知性能。用主成分分析法对不同配方的信号强度进行分析,结果表明,2%的三氯蔗糖和0.5%的绿薄荷能很好地掩盖苦味,并与相应的安慰剂的味道相似。人体味觉测试的结果与电子舌评价的发展趋势相一致,该技术具有客观性和可重复性,适于评价3DP的左乙拉西坦速溶片。
3.2 体内评价手段
3.2.1 动物评价法 近年来有学者使用动物验证口服制剂掩味效果,其原理是基于动物对药物气味的喜好或厌恶的程度表征药物口感, 通过动物行为学、电生理试验、味觉外周感受器味蕾特征变化、基因敲除技术[32]等相关实验进行测定。最为常用的两种方法为双瓶喜好试验和短暂摄取试验。动物评价法优点是避免有毒有害物质对人体的不良影响,可降低个体差异及主观因素造成的数据偏差,但在评价过程中需结合电子舌或生物检测方法, 但需结合化学评测或生物检测等进行整体比对来验证其可行性,以更加系统全面得到药物口感数据[55]。Noorjahan 等[56]使用与人体味蕾结构及喜好最为近似的啮齿类动物,建立大鼠行为回避模型,并与人体感官评价实验相结合,评测研制的咀嚼片及口崩片的口感,其结果显示大鼠和人的平均反应相关系数大于0.5,表明大鼠和人对口感的反应之间存在高度相关性,大鼠对厌恶性味觉物质的接受度与人的接受度成正比,当不良气味掩盖后,大鼠舔舐频率明显增加,同时志愿者也能够接受。
3.2.2 人群尝味评价法 人工口尝评价的试验方法设计包括单一样品对照评价法、苦度值等级评价法、综合评分评价法、模糊综合评价法、视觉模拟评分法、多因素调查评价、量度匹配及幅度标记评价法、味觉磁共振成像评价法等[57]。在选择待测样品时在具体操作中又包括单盲法与双盲法。单盲法为实验人员知晓分组情况的具体研究方法,优势是可以及时处理意外状况,从而保障志愿者的安全;缺点是易造成实验人员所持有的主观意识,造成对照组与实验组的操作差异。双盲法为实验人员和志愿者均不知晓分组情况,由实验项目设计人安排控制整体研究,优点是避免了主观偏见,但方法复杂、出现意外也难以及时处理[58]。人体感官评测可以从多个方面表征药物的口感特性,但不足之处是容易产生个体差异和主观偏倚,也牵涉一系列医学伦理学的问题。
3.3 BP神经网络预测模型
研究者们依据能解决复杂问题的大脑神经元构造了BP神经网络,所谓BP神经网络是指按照误差逆向传播算法的多层前馈神经网络,其非线性映射能力强[59],具有高度自学、自适应及容错能力。其多层结构包括输入层、隐含层和输出层,神经元仅在前后进行衔接,三层神经元之间无衔接。BP神经网络多层结构如图4。因此BP 神经网络的输入值与输出值是无任何关联的函数,输入值可理解为自变量,预测值为因变量,信号通过多层前馈神经到达输出层,考察其输出值是否符合预测值规定,不符合则逆向反馈至神经网络隐藏层,再重新调整其权值与阈值,经一系列循环往复,直至输出结果符合预期,得到训练次数与误差最低的权值与阈值[60]。试验前要对BP 神经网络进行训练,使之拥有记忆力和预测能力,其训练过程如图5。Liu 等[61]以盐酸小檗碱为模型药物,利用电子舌来预测其苦味强度。通过人体口尝对苦味强度的味觉评价、电子舌检测数据和遗传算法-反向传播神经网(GA-BP)建模方法建立了苦味预测模型。结果表明其建立的苦味预测模型拟合度高,可用于不同浓度盐酸小檗碱的苦味预测建模,其算法能够对电子舌提供的数据进行快速、准确的定量分析。Li 等[62]使用Heracles NEO 快速气相电子鼻对生五味子、醋五味子及蜜五味子的气味指纹图谱进行分析,通过计算各成分峰双柱Kovats 相对保留指数,结合Arochembase 数据库确认各样品气味成分及潜在气味差异标志物,建立了人工神经网络快速判别模型。结果表明基于快速气相电子鼻检测结果的人工神经网络判别模型训练正确率和测试正确率均为100.0%,可成功实现对3 种五味子饮片的快速鉴别。Yang 等[63]应用GA-BP 神经网络模型,对明胶软糖的口感进行预测。经训练后的神经网络能够较好地映射输入输出关系,可对样品口感做出较为准确的预测,实验结果与预测结果RSD 均在2%以内,即二者变化一致,说明该模型具有较高拟合度,可作为后期评价口感的工具。
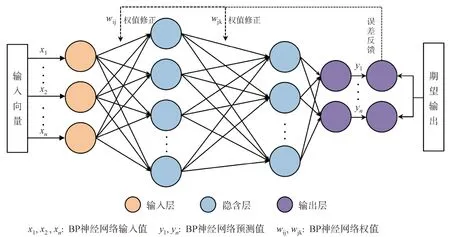
图4 BP神经网络多层结构图[63]
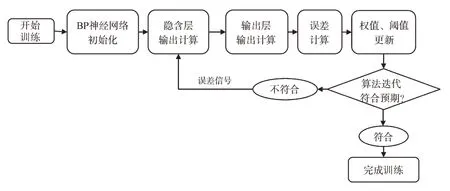
图5 BP神经网络训练过程
关于此方面于药学领域的内容较少,鲜少有研究将其利用于药品口感评价预测,相信将来BP神经网络预测模型能用于和药物制剂相关的实际应用当中,为药物掩味及口感分析测定提供更多思路和新型策略。
4 总 结
随着医药行业技术和设备水平的不断精进,在考察药物质量的同时,患者服药顺应性也逐渐成为重要指标。目前用于掩味的工艺及方法仍存在待解决问题,例如载药量小,辅料对药物分子的选择性,工艺对药物溶出、吸收及稳定性的影响,药物与辅料的蓄积毒性,设备因素局限等,均有待进一步优化。如需同食品饮料等同服以改善口感的制剂,还应对其进行安全性及有效性评价。在今后对不良口感药物的实际掩味研究中,因药物自身毒性、人体感官差异、电子舌检测器的检测限制及结果偏差,后期研究应针对药物口感评测方法进行更多尝试和研究,如通过BP 算法建立人工神经网络,用其评测药物口感及建立实验模型等,弥补该领域的短板并开发更多安全、准确、可靠的口感评测技术手段,达到精准量化药物口感的目的。

