葱白提取物对油酸诱导HepG2细胞脂代谢的影响及其机制*
胡松,刘莉,3,李璐璐,胡磊,邹冲冲,黄传奇,刘慷洁,孙安妮
(1.湖北中医药大学药学院,武汉 430065;2.武汉市中西医结合医院药学部,武汉 430022;3.长江航运总医院、武汉脑科医院药学部,武汉 430019;4.华中科技大学同济医学院附属梨园医院药剂科,武汉 430077)
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)作为目前世界范围内最常见的慢性肝病,严重危害着全球约25%成年人的健康[1-2]。NAFLD主要包括普通脂肪肝和非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)两类,前者以肝细胞的脂肪堆积为特征,而后者可进展为肝硬化甚至肝癌[3-5]。医学界至今尚未明确NAFLD的具体发病原因,但脂质代谢异常、氧化应激、炎症的影响等被认为是可能的高致病因素,且临床上至今缺乏治疗NAFLD的有效药物[6-9]。
葱白提取物(Alliumcepavar.aggregatumextract,ACAE)是本课题组对火葱Alliumcepavar.aggregatum的葱白进行二氧化碳超临界萃取的产物,由该萃取物制成的医疗机构制剂博心通软胶囊(鄂药制字Z20093124,每粒400 mg,β-谷甾醇含量不低于1.3 mg)已在临床使用多年[10]。虽然长期的临床研究和动物实验[11]均表明ACAE可调节脂质代谢,并可显著改善其动脉粥样硬化、心肌梗死等临床症状[12],但是ACAE发挥以上功效的分子机制尚未被完全揭示。因此,本研究拟建立油酸诱导的人肝癌细胞(HepG2)高脂模型,观测ACAE对肝脂质代谢关键蛋白(PPARα、SREBP-1C和PNPLA3)、氧化应激调节因子影响,并分析该作用的潜在分子机制。
1 材料与方法
1.1实验药品及试剂 ACAE由武汉市中西医结合医院制剂中心提供(批号:20201207),实验前以二甲亚砜(dimethyl sulfoxide,DMSO)配制成一定浓度的储存液并冷冻于-20 ℃备用(实验中各组DMSO浓度均<0.1%);油酸(批号:110-80-1)购于Sigma公司;达尔伯克必需基本培养液(Dulbecco's minimum essential medium,DMEM)(批号:12800017)、胎牛血清(批号:10099134)、磷酸盐缓冲液(批号:8157363)和噻唑蓝(methyl thiazolyl tetrazolium,MTT)试剂盒(批号:146500709)均购自Gibco公司;格里斯试剂(批号:193521001)购于Promega公司;活性氧(reactive oxygen species,ROS)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(批号:21023315)购于冬歌生物科技有限公司;三酰甘油(triacylglycerol,TG)(批号:1765425)、ELISA试剂盒购于eBioscience公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒(批号:PA115)、总RNA提取试剂(批号:DP502)购自天根生化科技有限公司;逆转录试剂盒(批号:RR037)、实时荧光定量试剂盒(批号:RR820A)均购自TAKARA公司;单核苷酸引物由生工生物工程股份有限公司合成;PNPLA3(ab2304)、SREBP-1C(ab3201)、PPARα(ab5076)、Nrf2(ab6244)、CYP1A1(ab5132)、gp 78(ab0846)一抗均购自Abcam公司。
1.2细胞与细胞培养 人肝癌细胞HepG2购自中国典型培养物保藏中心,以DMEM高糖培养基+10%胎牛血清+1%青链霉素双抗在5%二氧化碳、37 ℃细胞培养箱中培养至对数期用于后续实验。
1.3细胞活性测定 以适量甲醇溶解油酸(oleic acid,OA),并以适量超纯化水将其溶解配制成0.5 mmol·L-1溶液备用。接种于96孔板的细胞(每孔1×104个)以0.5 mmol·L-1OA在37 ℃下预处理24 h,再以梯度浓度(0~80 mg·L-1)ACAE在37 ℃下孵育24 h,随后加入5 mg·mL-1MTT溶液20 μL和pH 值7.4的磷酸盐缓冲液180 μL孵育4 h后弃去上清液,加DMSO溶液150 μL溶解结晶,于酶标仪中低速震荡10 min后在波长490 nm下读板。
1.4细胞给药 以HepG2细胞每孔5×103个的密度在6孔板中接种并孵育24 h。之后正常对照组细胞加培养基孵育24 h,模型对照组和各ACAE组在0.5 mmol·L-1OA溶液中孵育24 h。弃去培养液,正常对照组和模型对照组加培养基,各ACAE组加梯度浓度的ACAE(2、5、10、20 mg·L-1)孵育24 h。每组设置复孔3个,所有实验平行重复3次。
1.5细胞ROS测定 细胞给药后,每孔加入10 μmol·L-1二氯荧光素二乙酸酯孵育后,在波长485 和535 nm下测定各组荧光强度。搜集各组细胞裂解后以BCA蛋白试剂盒测定各组细胞蛋白质浓度,并计算单位蛋白质浓度下的相对荧光强度来评估各组细胞的相对ROS含量。
1.6TG的测定 细胞给药后,搜集各组细胞并裂解。根据TG和BCA试剂盒说明测定各组TG水平和各组蛋白含量,计算得到各组TG相对含量。
1.7实时定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR) 细胞给药后,搜集各组细胞并以Trizol试剂裂解并提取总RNA,测定提取总RNA的A260/A280以确保纯度。3 μg总RNA以逆转录试剂盒逆转录为cDNA,再以实时荧光定量试剂扩增。扩增方案为两步法:第一步95 ℃保持5 min预变性,第二步95 ℃保持3 s,70 ℃保持33 s,重复38个循环PCR反应。PNPLA3、PPARα引物和内参寡核苷酸序列见表1,以2-△△CT计算各组细胞相对mRNA含量。

表1 PNPLA3、PPARα引物和内参寡核苷酸序列
1.8免疫印迹分析 细胞给药后,搜集各组细胞于冰上裂解30 min,12 000×g下冷冻离心10 min,并以BCA蛋白试剂盒测定各组蛋白浓度。总蛋白经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)后转膜至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,以5%脱脂牛奶室温封闭2 h后与相应的一抗(PNPLA3、SREBP-1c、PPARα、gp78、Nrf2、CYP1A1)孵育1 h。洗膜3次后以辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗孵育1 h,洗膜3次后在ECL发光液中孵育2 min,以感光胶片压片成像后,以Bio-rad 170-8170凝胶成像系统测定各组灰度值。
1.9统计学方法 所有计量资料以SPSS 20.0版软件进行单因素方差分析(one-way ANOVA),方差齐时结合LSD检验比较组间统计学差异,方差不齐时采用Dunnett T3 检验。以P<0.05为差异有统计学意义。
2 结果
2.1葱白提取物对HepG2的细胞毒性 由MTT实验结果(图1)可知,与正常对照组比较,2、5、10、20 mg·L-1的ACAE对HepG2细胞无细胞毒性(P>0.05),40、80 mg·L-1ACAE对HepG2细胞有细胞毒性(P<0.05)。因此,后续实验中,给药组以2、5、10、20 mg·L-1ACAE进行实验。

A.正常对照组;B.模型对照组;C.0.5 mmol·L-1OA+2 mg·L-1ACAE组;D.0.5 mmol·L-1OA+5 mg·L-1ACAE组;E.0.5 mmol·L-1OA+10 mg·L-1ACAE组;F.0.5 mmol·L-1OA+20 mg·L-1ACAE组;G.0.5 mmol·L-1OA+40 mg·L-1ACAE组;H.0.5 mmol·L-1OA+80 mg·L-1ACAE组。①与正常对照组比较,t=3.39,P<0.05;②与模型对照组比较,t=3.52、14.81,P<0.05。
2.2葱白提取物对HepG2细胞TG生成的影响 由实验结果(图2)可知,与正常对照组比较,OA可显著提高HepG2细胞的TG生成量(F=216.46,P< 0.05,方差齐);与模型对照组比较,所有实验浓度的ACAE均可显著降低HepG2细胞的TG生成量(P<0.05)。

A.正常对照组;B.模型对照组;C.0.5 mmol·L-1OA+2 mg·L-1ACAE组;D.0.5 mmol·L-1OA+5 mg·L-1ACAE组;E.0.5 mmol·L-1OA+10 mg·L-1ACAE组;F.0.5 mmol·L-1OA+20 mg·L-1ACAE组。①与正常对照组比较,P<0.05;② 与模型对照组比较,P<0.05。
2.3葱白提取物对HepG2细胞ROS生成的影响 由实验结果(图3)可知,相对于正常对照组,OA可显著提高HepG2细胞ROS的生成量(F=112.00,P<0.05;方差齐);与模型对照组比较,2 mg·L-1的ACAE对ROS生成量无影响(P>0.05),5、10、20 mg·L-1的ACAE可显著提升ROS的生成量(P<0.05)。
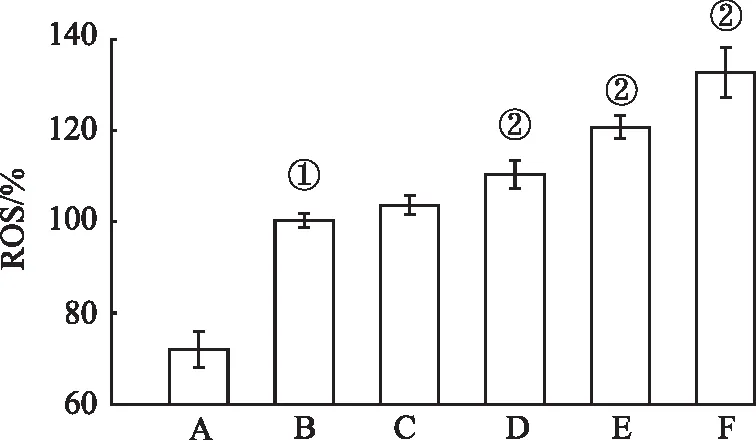
A.正常对照组;B.模型对照组;C.0.5 mmol·L-1OA+2 mg·L-1ACAE组;D.0.5 mmol·L-1OA+5 mg·L-1ACAE组;E.0.5 mmol·L-1OA+10 mg·L-1ACAE组;F.0.5 mmol·L-1OA+20 mg·L-1ACAE组。①与正常对照组比较,P<0.05;② 与模型对照组比较,P<0.05。
2.4葱白提取物对HepG2细胞NO生成的影响 由实验结果(图4)可知,与正常对照组比较,OA可显著提高HepG2细胞的NO生成量(F=216.46,P<0.05,方差齐);与模型对照组比较,所有实验浓度的ACAE均可显著降低HepG2细胞的NO生成量(P<0.05)。

A.正常对照组;B.模型对照组;C.0.5 mmol·L-1OA+2 mg·L-1ACAE组;D.0.5 mmol·L-1OA+5 mg·L-1ACAE组;E.0.5 mmol·L-1OA+10 mg·L-1ACAE组;F.0.5 mmol·L-1OA+20 mg·L-1ACAE组。①与正常对照组比较,P<0.05;② 与模型对照组比较,P<0.05。
2.5葱白提取物对HepG2细胞PNPLA3和PPARα mRNA相对含量的影响 由实验结果(图5)可知,与正常对照组比较,OA可显著提高HepG2细胞PNPLA3mRNA的相对含量(F=42.54,P<0.05,方差齐);与模型对照组比较,5~20 mg·L-1ACAE可显著降低HepG2细胞的PNPLA3 mRNA的相对含量(P<0.05)。另一方面,与正常对照组比较,OA可显著降低HepG2细胞PPARα mRNA的相对含量(F=9.59,P<0.01,方差不齐);与模型对照组比较,所有实验浓度的ACAE均可显著提升HepG2细胞PPARα mRNA的相对含量(P<0.05)。
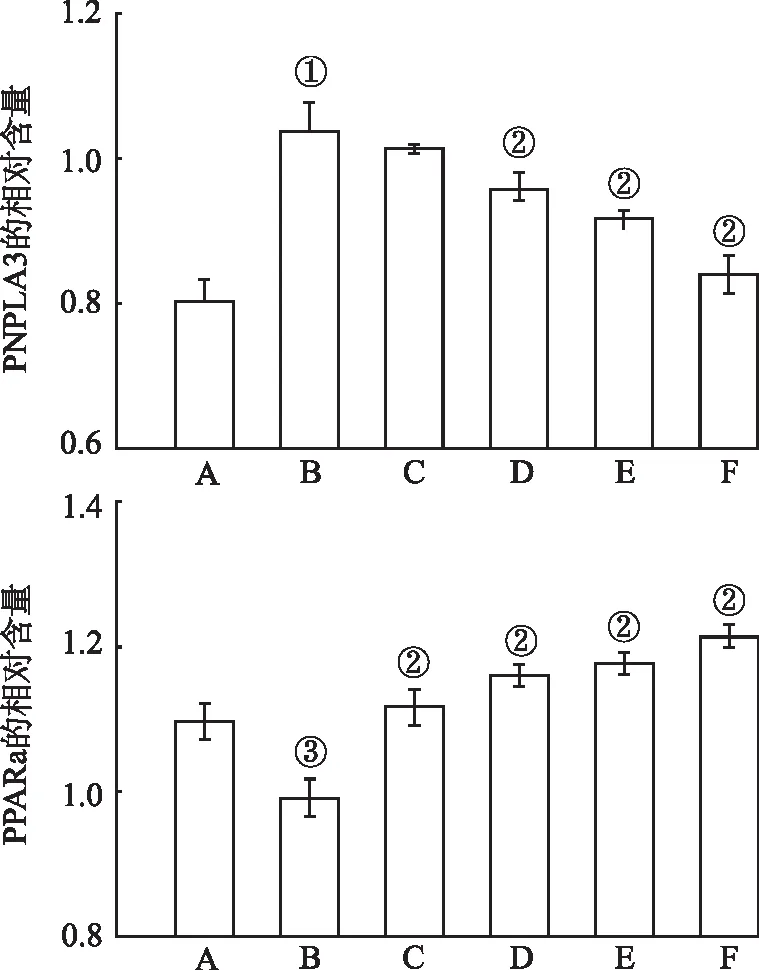
A.正常对照组;B.模型对照组;C.0.5 mmol·L-1OA+2 mg·L-1ACAE组;D.0.5 mmol·L-1OA+5 mg·L-1ACAE组;E.0.5 mmol·L-1OA+10 mg·L-1ACAE组;F.0.5 mmol·L-1OA+20 mg·L-1ACAE组。①与正常对照组比较,P<0.05;②与模型对照组比较,P<0.05;③与正常对照组比较,P<0.01。
2.6ACAE对HepG2细胞脂代谢、氧化应激相关蛋白的影响 结果见表2和图6。与正常对照组比较,模型对照组的Nrf2和PPARα的相对含量显著降低(P<0.05),而SREBP-1c、CYP1A1、PNPLA3和gp78的相对含量显著升高(P<0.05)。与模型对照组比较,2~20 mg·L-1的ACAE和5~20 mg·L-1的ACAE分别使Nrf2和PPARα相对含量显著提升(P<0.05),5~20 mg·L-1的ACAE组SREBP-1c相对含量显著高于模型对照组(P<0.05),2~20 mg·L-1的ACAE组CYP1A1、PNPLA3和gp78的相对含量显著高于模型对照组(P<0.05)。

A.正常对照组;B.模型对照组;C.0.5 mmol·L-1OA+2 mg·L-1ACAE组;D.0.5 mmol·L-1OA+5 mg·L-1ACAE组;E.0.5 mmol·L-1OA+10 mg·L-1ACAE组;F.0.5 mmol·L-1OA+20 mg·L-1ACAE组。
表2 6组HepG2细胞脂代谢、氧化应激相关蛋白比较
3 讨论
NAFLD的发生和发展主要经历2个阶段:其一是肝脏脂质的累积,是形成NASH和胰岛素抵抗的重要原因;其二是以氧化应激和炎症为特征的肝损伤。在当今全球经济迅速发展的大环境下,NAFLD的发病率在全球范围内都保持着上升趋势。因此,寻找能够安全、有效控制NAFLD的药物具有重要的社会意义和潜在的经济价值。
ACAE是我院经典医疗机构制剂博心通软胶囊的主要原料,前期临床研究中发现博心通软胶囊能显著降低患者血清TG水平,减轻患者动脉粥样硬化等临床症状。为了探究ACAE治疗NAFLD的机制,本研究以OA诱导HepG2细胞这一经典NAFLD细胞模型为基础,观察了ACAE对TG、ROS、NO生成量以及PNPLA3、PPARα等关键靶蛋白相对含量的影响。
TG是NAFLD肝脏中的主要脂质成分,同时TG的肝内堆积也是NAFLD的特征性病理表现。与此同时,TG的肝内堆积不仅仅起到损伤肝细胞的作用,同时也是机体对抗脂毒性及过量生成ROS的一种保护机制。ACAE可促进肝细胞启动自身针对ROS过量的自我保护机制,体外实验表明,大多数具有治疗特性的膳食化合物在高浓度的情况下,都可以作为有效的促氧化剂分子[13]。这种促氧化作用增加了ROS的产生。此外,NO既是NAFLD中衡量氮化应激程度的指标,也是判断肝细胞发生氧化应激损伤程度的指标。ACAE可有效抑制油酸对HepG2细胞的氧化应激和氮化应激损伤。
PNPLA3是马铃薯糖蛋白磷脂酶家族成员之一,它参与多项肝脏脂肪酸代谢活动,同时是NAFLD致病的关键蛋白之一[14-16],临床数据证实PNPLA3对纤维化、肝脂肪积累和炎症的发展有积极的直接影响[17],PNPLA3 rs738409突变可能通过2种方式促进疾病进展:通过直接激活纤维化途径或通过炎症[18]。
PNPLA3基因rs738409的多态性是糖尿病NAFLD患者肝纤维化和心血管疾病风险的标志[19]。PNPLA3基因突变与NAFLD有显著的相关性,提示可能发展NAFLD治疗的新的酶学位点药物。ACAE对PNPLA3的生成具有从mRNA到蛋白表达的全面抑制作用。此外,PNPLA3还直接调控SREBP-1c,而SREBP-1c参与调控多种肝内脂肪合成关键酶的生成[20-22]。ACAE可通过抑制PNPLA3和SREBP-1c的生成来控制肝内脂肪堆积。PPARα是细胞核上参与调控脂质氧化的关键受体[23-24],前期动物实验中也验证了ACAE通过诱导PPARGC1A治疗NAFLD的可行性,结合ACAE对ROS的上调作用,本研究提示ACAE可能通过提高肝细胞脂肪氧化来抑制肝内脂肪堆积。
Nrf2蛋白调控着肝内解毒、抗氧化等多项功能,一般认为细胞中Nrf2蛋白越丰富,其抗氧化能力越强[25-26]。然而,Nrf2在氧化应激反应中的双重对立作用应该被严格考虑,在一个复杂的层次调控网络中,在刺激其协同介导的抗氧化细胞保护反应之前,还可以在不同的细胞系中触发一定的ROS产量[27]。同时ACAE对于ROS的上调作用,说明ACAE可增强肝细胞的抗氧化能力,并对氧化应激反应起到协调作用。CYP1A1是多种异源物的单加氧酶,它参与多种有毒物质的代谢[28-29]。ACAE可显著抑制油酸对HepG2细胞的毒性作用。gp78作为一种泛素连接酶,参与人体多种脂肪酸和类固醇等脂质的合成[30-32]。ACAE也可能通过抑制gp78的生成来发挥其降低脂质生成的临床作用。
综上所述,ACAE一方面通过下调PNPLA3、SREBP-1c、gp78、CYP1A1等靶点抑制脂质的生成堆积并降低氧化应激的损伤,另一方面通过上调PPARα和Nrf2加速脂质氧化来加速脂质代谢。虽然本研究在细胞层面对ACAE调节脂质代谢的机制进行了较全面地解释,但ACAE中发挥调节脂质代谢的活性成分(群)尚不明确,ACAE调节脂质代谢的其他靶标蛋白、目的细胞尚不明确。本课题组将继续开展深入研究。

