消化道不同部位印戒细胞癌中的SATB2、CDX2表达水平及临床意义
杨娟,刘春梅,赵路
1.漯河市中心医院(漯河医学高等专科学校第一附属医院)病理科,河南 漯河 462000;2.漯河医学高等专科学校第二附属医院病理科,河南 漯河 462000
消化道印戒细胞癌(signet ring cell carcinoma,SRCC)属于临床一种常见的恶性肿瘤,其早期临床表现和胃肠镜表现均无特异性,确诊时多数患者已进展至中晚期,错失最佳治疗时机,预后欠佳。因此对于消化道SRCC 患者早诊断、早治疗至关重要。核基质结合蛋白质2(special AT-rich sequence-binding protein 2,SATB2)为近几年发现的能与核基质结合的特异性结合转录因子,报道显示,SATB2于结直肠癌、口腔癌及乳腺癌等多个肿瘤细胞中的表达水平较高[1-2]。尾型同源异型框转录因子-2(caudal type homeobox transcription factor-2,CDX2)为果蝇尾部有关同源基因的家族成员之一,为机体肠道内特异性表达的一种核转录因子,于肠黏膜上皮细胞发育和保持形态、结构中具有重要作用,在直肠肿瘤的发生过程中发挥抑癌基因的效果,与肿瘤生物学特性和预后具有紧密联系[3-4]。本研究将探讨SATB2、CDX2 在消化道SRCC 中的表达水平及其与TNM 分期和浸润深度的关系。
由Lagrange定理,当f(a)=f(b)时,有f′(ξ)=0,就是Rolle定理。这段微视频的目标明确,主要复习Rolle定理,介绍Lagrange中值定理,进而说明两个定理之间的联系,为了清晰明了地讲解这个定理,要十分明确清晰地设计活动,设计资源,设计内容,都是围绕Lagrange中值定理这一知识点而开展的,激发学生学习高等数学的兴趣,刺激学生探究问题的心理,帮助学生发现数学问题。
1 资料与方法
1.1 一般资料 经漯河市中心医院医学伦理委员会批准,收集2008 年3 月1 日至2019 年1 月31 日漯河市中心医院收治的265例消化道手术切除SRCC标本。(1)纳入标准:经过病理组织活检确诊为消化道SRCC;性别不限;年龄≥18 岁;均签署知情同意书。(2)排除标准:非消化道的SRCC;伴有认知障碍或者精神障碍者;伴有其他恶性肿瘤者;有放化疗治疗史者。根据SRCC发生部位不同分为上消化道SRCC患者178例(上消化道组)和下消化道SRCC患者87例(下消化道组),两组患者的基线资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。

表1 两组患者的基线资料比较[例(%)]Table 1 Comparison of basic data between the two groups[n(%)]
1.2 方法
1.2.1 SATB2和CDX2表达水平检测 采用免疫组化EnVision检测法检测,68℃下烤片20 min,常规进行二甲苯脱蜡、系列梯度酒精脱水,然后将切片浸泡于水中进行保存;37℃下经浓度为3%的双氧水浸泡切面约10 min,降低内源性过氧化酶的活性;采用磷酸盐缓冲液(PBS)进行清洗3 次,转移到0.01 mmol/L枸橼酸缓冲液内煮沸约15 min,自然冷却至室温,进行抗原修复;每张切片滴入50 μL 一抗,于4℃下孵育过夜,后经PBS 冲洗,每张切片滴50 μL 的EnVsision试剂,于室温下孵育0.5 h;PBS 冲洗,经DAB 显色,采用苏木精衬染,经二甲苯透明之后用中性胶予以封片。
2.2 消化道不同部位SRCC 患者的SATB2、CDX2 阳性率比较 上消化道组患者中的SATB2、CDX2 阳性率明显低于下消化道组,差异均有统计学意义(P<0.05),见表3。
1.2 纳入标准 ①因分泌性中耳炎行鼓膜穿刺抽液次数或置管≥1次;②穿刺或置管后分泌性中耳炎复发,保守及药物治疗3个月以上不缓解,半年内急性分泌性中耳炎复发超过3次;③耳镜检查见鼓膜内陷,鼓室积液呈液平或浑浊,琥珀色或橙红色;④纯音听阈提示气骨导差值≥15 dB,≤40 dB,声导抗“B”或“C”型。
将第三代MSCs消化后制成细胞悬液,取50万个细胞,重悬于0.5 ml细胞培养液中。根据商品说明书加入0.5 ml JC-1染色工作液,颠倒数次混匀,细胞培养箱中37℃孵育20 min。600 g 4℃离心5 min,沉淀细胞,弃上清。以JC-1染色缓冲液洗涤2次:加入1 ml JC-1染色缓冲液重悬细胞,600 g 4℃离心5 min,弃上清。再用300 μl JC-1染色缓冲液重悬细胞后,流式细胞仪测定相对荧光强度。
2 结果
2.1 消化道不同部位SRCC患者中SATB2、CDX2阳性率比较 食管、胃SRCC 组织中的SATB2、CDX2阳性率明显低于十二指肠、空回肠、阑尾、结肠、直肠,差异均具有统计学意义(P<0.05),见表2和图1。
1.3 观察指标 (1)比较不同部位SRCC 患者中SATB2、CDX2 阳性率;(2)比较上消化道和下消化道SRCC患者中SATB2、CDX2阳性率;(3)比较不同病理学参数SRCC组织中SATB2、CDX2阳性率。

图1 不同部位SRCC患者中SATB2、CDX2蛋白的表达Figure 1 Expression of SATB2 and CDX2 in patients with SRCC at different sites

表2 不同部位SRCC患者中SATB2、CDX2阳性率比较[例(%)]Table 2 Comparison of positive rates of SATB2 and CDX2 among patients with SRCC at different sites[n(%)]
1.2.2 结果判定 全部切片由两名高年资病理科医师予以双盲法阅片。随机选10个视野,每一视野细胞计数不低于100,于高倍镜下观察肿瘤细胞。根据阳性细胞所占百分比及着色的强度进行评分,标准如下:无阳性细胞为0分、阳性细胞≤10%为1分、阳性细胞11%~50%为2 分、阳性细胞>51%~75%为3 分、阳性细胞>75%为4 分;无染色为0 分、浅黄色为1 分、棕黄色为2 分、棕褐色为3 分。取两项得分结果相加为判定标准,即≥2 分阳性、<2 分为阴性,其中0~1 分是-、2~3分是+、4~5分是++、6~7分是+++。
1.4 统计学方法 应用SPSS22.0 统计学软件分析数据。计量资料以均数±标准差()表示,组间比较采用独立样本t检验;计数资料比较采用χ2检验。以P<0.05为差异有统计学意义。
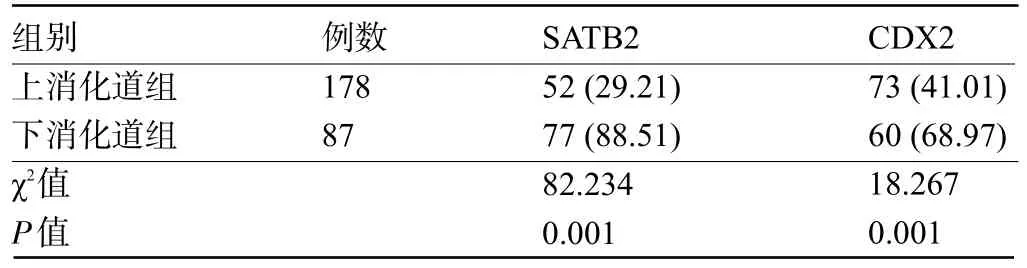
表3 两组患者中的SATB2、CDX2阳性率比较[例(%)]Table 3 Comparison of positive rates of SATB2 and CDX2 between the two groups[n(%)]
近几年,流行病学调查结果指出,胃癌的总体发病率呈逐渐下降态势,弥漫性胃癌尤其SRCC 发病率呈逐渐升高态势,主要原因为SRCC早期诊断率较低,SRCC 发病机制与癌前病变并未阐述明确[5]。报道显示,结直肠SRCC极易产生腹腔种植转移、区域淋巴结转移以及肿瘤邻近组织广泛浸润,多数患者在确诊时已处于晚期,此时可实施根治性手术者占50%~70%,且术后远期疗效欠佳,故早期诊断、早期治疗对于改善SRCC预后具有重要意义[6]。有报道显示,胃以及肠型免疫表型标志物有利于早期鉴别消化道(例如胃、消化道等)SRCC种类与评估预后,并对治疗方案起到指导作用[7]。

表4 不同病理学参数SRCC 组织中SATB2、CDX2 阳性率比较[例(%)]Table 4 Positive rate of SATB2 and CDX2 in SRCC tissues with different pathological parameters[n(%)]
3 讨论
2.3 不同病理学参数SRCC 组织中SATB2、CDX2阳性率比较 上消化道和下消化道SRCC组织中Ⅲ+Ⅳ期SATB2 和CDX2 阳性率均高于Ⅰ+Ⅱ期,T3+T4期SATB2 和CDX2 阳性率均高T1+T2期,差异均有统计学意义(P<0.05),见表4。
一般说来,一千位教师就有一千种讲课设计。宽泛地说,这些同文本的个案设计都算作是同课异构。但是我们并不能说同课异构是随心所欲地构造教学。无论怎样创造性地开展教学,也都离不开对文本内容、文本特征和教学手段最优化的考虑。
SATB2基因处在人类2 号染色体长臂33 区,编码SATB2蛋白为核基质结合蛋白质之一,和SATB1具备高度同源性,而SATB1 为潜在致癌基因,目前对于SATB2机理并未明确阐述[8]。有报道指出,SATB2能通过干扰染色质高级结果,实现调控目标基因表达的目的,进而对肿瘤细胞发生、发展发挥作用,且SATB2能直接性影响中枢神经系统的发育,对于脑桥、胼胝体等组织正常发育具有重要作用,在正常人体上皮组织内,SATB2仅于胃肠道组织下端黏膜上皮内表达[9]。有报道显示,SATB2 能参与肿瘤的发生、发展,对于肿瘤进程具有一定影响。因SATB2 呈现细胞核着色,即为“全或者无”显色方式,观察上更为清晰,而着色强度不会随着肿瘤分化程度而发生变化,因此,可以作为临床的一种诊断指标[10]。本研究结果表明,食管、胃SRCC组织中的SATB2阳性率低于十二指肠、空回肠、阑尾、结肠、直肠SRCC,差异有统计学意义(P<0.05);上消化道SRCC患者中SATB2阳性率为29.21%,低于下消化道SRCC 患者中的88.51%,差异有统计学意义(P<0.05),说明SATB2 参与消化道SRCC 的发生、进展,且其水平变化可反映病情严重程度。
另外,机体中各种上皮细胞免疫组化报道显示,自胚胎发育第8 周开始,胎儿胃肠道内便能检测出CDX2 表达,正常生物体发育中,CDX2 属于肠特异性转录因子,能调节肠上皮细胞增殖与分化以及肠表型维持,对于消化道尤其是结肠、小肠上皮发育发挥重要作用[11-12]。正常机体的上皮细胞内,CDX2在内胚层来源肠道上皮、胰腺导管与腺泡上皮内表达,但在食管、正常胃黏膜上皮内不表达,除了消化系统之外,其他系统的正常上皮无法检测到CDX2表达[13]。本研究结果中,食管、胃SRCC组织中的CDX2阳性率低于十二指肠、空回肠、阑尾、结肠、直肠SRCC,差异有统计学意义(P<0.05);上消化道SRCC患者中CDX2阳性率为41.01%,低于下消化道SRCC 患者中的68.97%,差异有统计学意义(P<0.05)。说明CDX2 表达可反映消化道SRCC 的发生、发展。CDX2 属于一种肿瘤抑制基因,可能和癌基因突变以及细胞周期的调控存在关联性[14],加上CDX2 作为肠道特异性的表达转录因子之一,对于生物发育和细胞分化具备重要调节效果[15]。由此说明CDX2 表达水平可作为临床诊断消化道SRCC的标志物之一。
此外,本研究还显示,上消化道和下消化道SRCC组织中Ⅲ+Ⅳ期SATB2 和CDX2 阳性率均高于Ⅰ+Ⅱ期,T3+T4期SATB2 和CDX2 阳性率均高T1+T2期,差异有统计学意义(P<0.05),说明SATB2 和CDX2 阳性表达不仅能反映消化道SRCC 的发生,还与SRCC 患者的TNM分期和浸润深度关系密切,可反映SRCC患者进展的严重程度。
综上所述,SATB2、CDX2 在不同部位的SRCC 组织中表达水平不同,尤其在下消化道SRCC中SATB2、CDX2阳性表达率更高,可用于早期诊断消化道SRCC,且对评估SRCC严重程度有一定临床价值。

