NLR、GFAP、CXCL16对急性脑梗死患者机械取栓90 d预后的预测价值
王新伟,刘智,王世城,李文,杜迎春
1.平顶山市第一人民医院神经外科二病区,河南 平顶山 467000;2.平顶山学院医学部,河南 平顶山 467000;3.平顶山市第一人民医院重症医学科,河南 平顶山 467000
急性脑梗死(acute cerebral infarction,ACI)发病率占临床脑血管疾病的80%,且致残率、致死率较高[1]。机械取栓可提高血管开通率,由于不同患者存在个体差异,导致治疗效果及预后不尽相同。中性粒细胞/淋巴细胞比值(NLR)属于炎性细胞因子,可能作为评估ACI病情进展的潜在指标[2]。神经胶质纤维酸性蛋白(GFAP)属于Ⅲ型丝状蛋白,广泛存在于中枢神经系统,且与脑梗死发生发展密切相关[3]。CXC型趋化因子配体16(CXCL16)属于趋化因子CXC 家族,可激活机体免疫反应,诱导血管生成,促进ACI发生发展[4]。由此认为NLR、GFAP、CXCL16可在一定程度上评估ACI病情程度。基于此,本研究主要检测机械取栓术后ACI患者血清NLR、GFAP、CXCL16水平,分析其与神经功能损伤、脑梗死体积相关性,并探讨其对预后的预测价值。
1 资料与方法
1.1 一般资料 选取2020年1月至2022年10月于平顶山市第一人民医院行机械取栓术的73例ACI患者为研究对象。(1)纳入标准:符合ACI诊断标准[7],经MRI 或CT 检查显示存在脑梗死,且证实为大血管闭塞血管;发病症状持续时间≥30 min;发病至就诊时间<12 h;生命体征平稳;初次发病;所有患者均签署知情同意书。(2)排除标准:合并血液、免疫系统疾病者;意识障碍者;既往颅内出血或脑卒中者;肝肾等重要脏器严重功能不全者;近3个月内有重大头颅外伤;颅内活动性出血;合并颅内肿瘤者。73例患者中男性48例,女性25 例;年龄54~74 岁,平均(63.83±3.06)岁。依据美国国立卫生研究院卒中量表评分(NIHSS)评估神经功能损伤程度[5],其中轻度损伤22例、中度损伤30例、重度损伤21 例;依据脑梗死体积分[6]为小梗死20 例、中梗死29 例、大梗死24 例。本研究经我院医学伦理委员会批准。
1.2 方法
1.2.1 治疗方法 采用改良Seldinger法行股动脉穿刺成功并置管,行全脑血管造影术评估脑侧支循环情况,明确闭塞血管部位,在泥鳅导丝配合下引入指引导管、中间导管,沿微导管引入Solitaire AB取栓支架,取栓后闭塞血管前向血流灌注分级(TIBI)为2 b以上视为成功开通。采用电话、门诊复查随访90 d,以患者出院后1 d开始随访,依据改良Rankin量表(mRS)评分[8]将患者分为预后良好组(≤3分)、预后不良组(>3分)。
1.2.2 收集临床资料 收集患者一般资料、实验室资料,包括年龄、性别、合并症、入院NIHSS评分、红细胞计数、TIBI分级等。
1.2.3 检测血清NLR、GFAP、CXCL16 水平 分别于术前、术后7 d、14 d 抽取研究对象空腹肘静脉血6 mL,分为2份血液样本(3 mL/份)。取1份血液样本,采用XS-800i血液分析仪(日本SYSMEX公司)检测中性粒细胞、淋巴细胞百分比,并计算NLR。取另外1份血液样本,经3 000 r/min 离心10 min,随后分离上清液,置于-80℃保存待检。采用双抗体夹心ELISA 法检测血清GFAP 水平,重庆智选生生物公司提供检测试剂盒。采用化学发光法检测血清CXCL16 水平,广州奥瑞达生物公司提供检测试剂盒。
1.3 观察指标 (1)比较不同预后患者的临床资料及术前、术后7 d、14 d血清NLR、GFAP、CXCL16水平。(2)比较术前不同神经功能损伤、不同脑梗死体积患者的血清各指标水平。(3)分析血清各指标与TIBI、神经功能损伤、脑梗死体积的相关性。(4)分析术后7 d、14 d血清各指标水平对预后的预测价值。
1.4 统计学方法 应用SPSS26.0 软件进行数据统计学分析。计量资料符合正态分布,以均数±标准差()表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用Bonferroni法;计数资料比较采用χ2检验;采用偏回归分析影响预后的因素;采用Spearman法分析血清各指标与TIBI、神经功能损伤、脑梗死体积相关性;采用受试者工作特征曲线(ROC)分析血清各指标对预后的预测价值,不同方案间的AUC比较采用DeLong检验。以P<0.05为差异有统计学意义。
2 结果
2.1 不同预后患者的临床资料比较 两组患者的性别、年龄、合并症等一般资料比较差异均无统计学意义(P>0.05)。预后不良组患者的TIBI分级0~3 级占比明显高于预后良好组,差异有统计学意义(P<0.05),见表1。
表1 不同预后患者的临床资料比较[,例(%)]Table 1 Comparison on clinical profiles between patients with different prognoses[,n(%)]
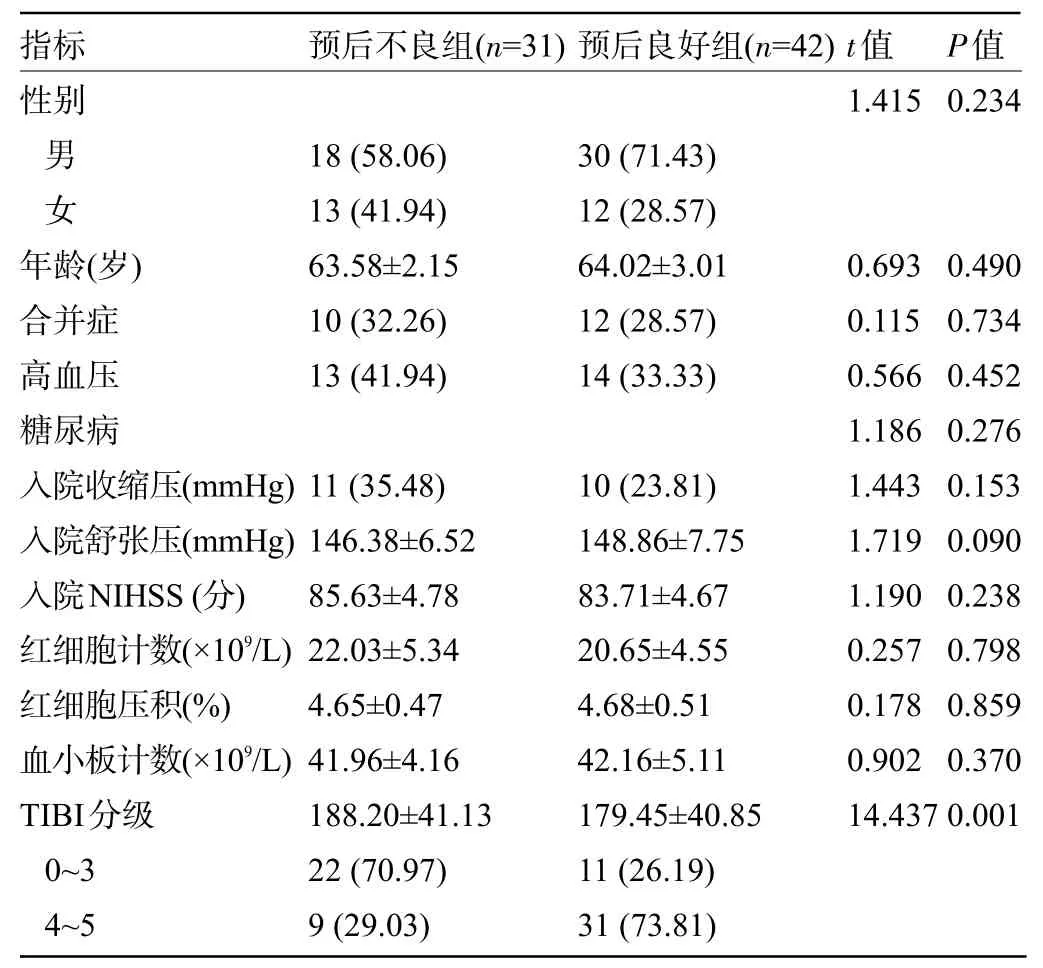
表1 不同预后患者的临床资料比较[,例(%)]Table 1 Comparison on clinical profiles between patients with different prognoses[,n(%)]
注:1 mmHg=0.133 kPa。Note:1 mmHg=0.133 kPa.
指标性别预后不良组(n=31)预后良好组(n=42)t值1.415 P值0.234男女年龄(岁)合并症高血压糖尿病入院收缩压(mmHg)入院舒张压(mmHg)入院NIHSS(分)红细胞计数(×109/L)红细胞压积(%)血小板计数(×109/L)TIBI分级0~3 4~5 18(58.06)13(41.94)63.58±2.15 10(32.26)13(41.94)30(71.43)12(28.57)64.02±3.01 12(28.57)14(33.33)11(35.48)146.38±6.52 85.63±4.78 22.03±5.34 4.65±0.47 41.96±4.16 188.20±41.13 22(70.97)9(29.03)10(23.81)148.86±7.75 83.71±4.67 20.65±4.55 4.68±0.51 42.16±5.11 179.45±40.85 11(26.19)31(73.81)0.693 0.115 0.566 1.186 1.443 1.719 1.190 0.257 0.178 0.902 14.437 0.490 0.734 0.452 0.276 0.153 0.090 0.238 0.798 0.859 0.370 0.001
2.2 不同预后患者的血清NLR、GFAP、CXCL16水平比较 术后7 d、14 d,两组患者的血清NLR、GFAP、CXCL16 水平明显低于术前,且预后良好组明显低于预后不良组,差异均有统计学意义(P<0.05),见表2。
表2 不同预后患者的血清NLR、GFAP、CXCL16水平比较()Table 2 Comparison on serum NLR, GFAP, and CXCL16 levels between patients with different prognoses()
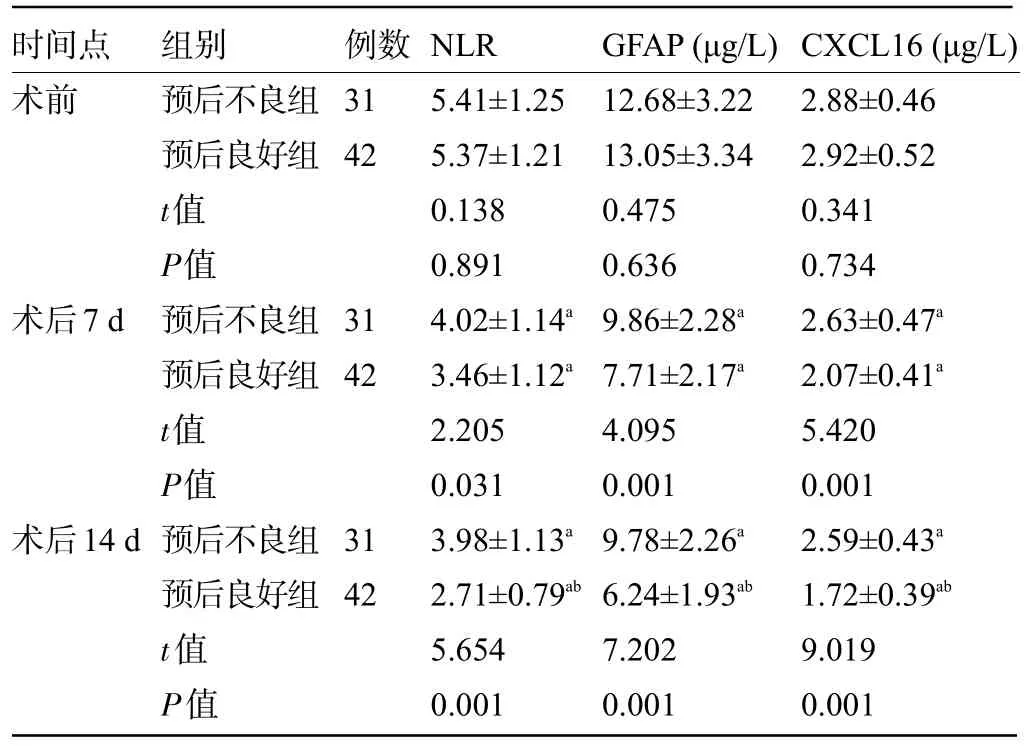
表2 不同预后患者的血清NLR、GFAP、CXCL16水平比较()Table 2 Comparison on serum NLR, GFAP, and CXCL16 levels between patients with different prognoses()
注:与本组术前比较,aP<0.05;与本组术后7 d比较,bP<0.05。Note: Compared with that in the same group before operation,aP<0.05;compared with that in the same group at 7 d postoperatively,bP<0.05.
时间点术前例数31 42术后7 d 31 42术后14 d组别预后不良组预后良好组t值P值预后不良组预后良好组t值P值预后不良组预后良好组t值P值31 42 NLR 5.41±1.25 5.37±1.21 0.138 0.891 4.02±1.14a 3.46±1.12a 2.205 0.031 3.98±1.13a 2.71±0.79ab 5.654 0.001 GFAP(μg/L)12.68±3.22 13.05±3.34 0.475 0.636 9.86±2.28a 7.71±2.17a 4.095 0.001 9.78±2.26a 6.24±1.93ab 7.202 0.001 CXCL16(μg/L)2.88±0.46 2.92±0.52 0.341 0.734 2.63±0.47a 2.07±0.41a 5.420 0.001 2.59±0.43a 1.72±0.39ab 9.019 0.001
2.3 不同神经功能损伤患者的血清NLR、GFAP、CXCL16 水平比较 重度损伤患者血清NLR、GFAP、CXCL16水平高于中度损伤、轻度损伤,且中度损伤高于轻度损伤,差异均有统计学意义(P<0.05),见表3。
表3 不同神经功能损伤患者的血清NLR、GFAP、CXCL16水平比较()Table 3 Comparison on serum levels of NLR, GFAP, and CXCL16 among patients with different neurological impairments()
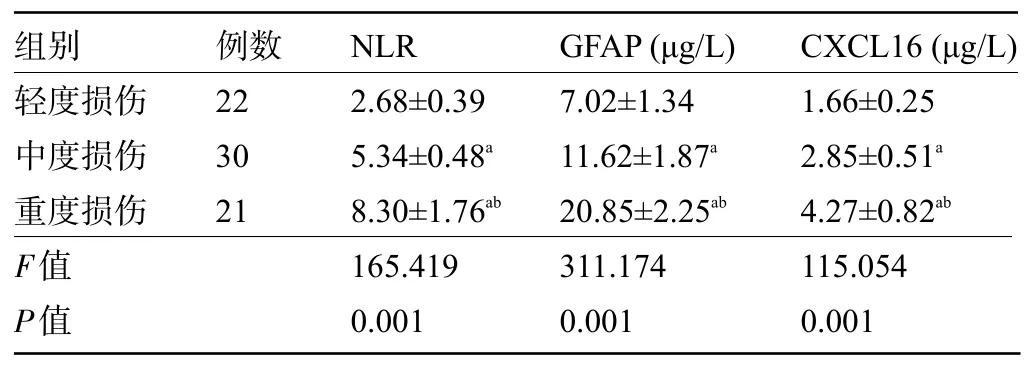
表3 不同神经功能损伤患者的血清NLR、GFAP、CXCL16水平比较()Table 3 Comparison on serum levels of NLR, GFAP, and CXCL16 among patients with different neurological impairments()
注:与轻度损伤比较,aP<0.05;与中度损伤比较,bP<0.05。Note: Compared with mild injury,aP<0.05; Compared with moderate injury,bP<0.05.
?
2.4 不同梗死体积患者的血清NLR、GFAP、CXCL16 水平比较 不同梗死体积患者血清NLR、GFAP、CXCL16水平比较,小梗死<中梗死<大梗死,差异均有统计学意义(P<0.05),见表4。
表4 不同梗死体积患者的血清NLR、GFAP、CXCL16水平比较()Table 4 Comparison of serum NLR, GFAP, and CXCL16 levels among patients with different infarction volumes()
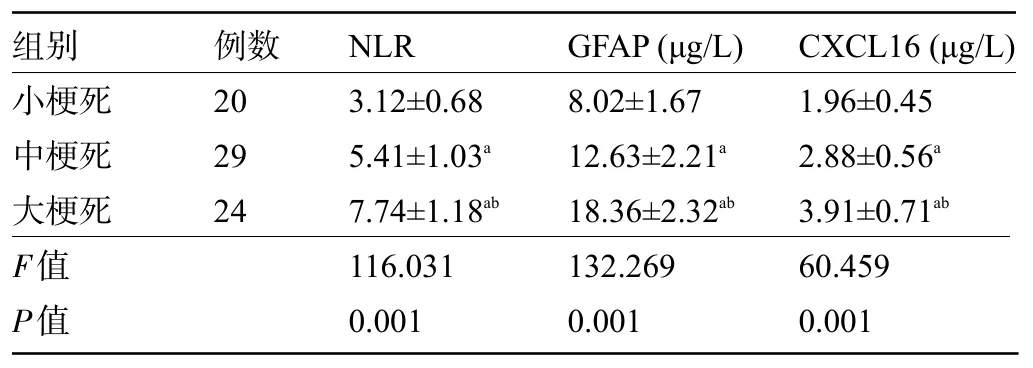
表4 不同梗死体积患者的血清NLR、GFAP、CXCL16水平比较()Table 4 Comparison of serum NLR, GFAP, and CXCL16 levels among patients with different infarction volumes()
注:与小梗死比较,aP<0.05;与中梗死比较,bP<0.05。Note: Compared with small infarction,aP<0.05; Compared with medium infarction,bP<0.05.
组别小梗死中梗死大梗死例数20 29 24 NLR 3.12±0.68 5.41±1.03a 7.74±1.18ab GFAP(μg/L)8.02±1.67 12.63±2.21a 18.36±2.32ab CXCL16(μg/L)1.96±0.45 2.88±0.56a 3.91±0.71ab F值P值116.031 0.001 132.269 0.001 60.459 0.001
2.5 血清各指标与TIBI分级、神经功能损伤、脑梗死体积的相关性 经Spearman 相关性分析结果显示,血清NLR、GFAP、CXCL16 水平与TIBI 分级呈负相关,而与神经功能损伤、脑梗死体积呈正相关,差异有统计学意义(P<0.05),见表5。
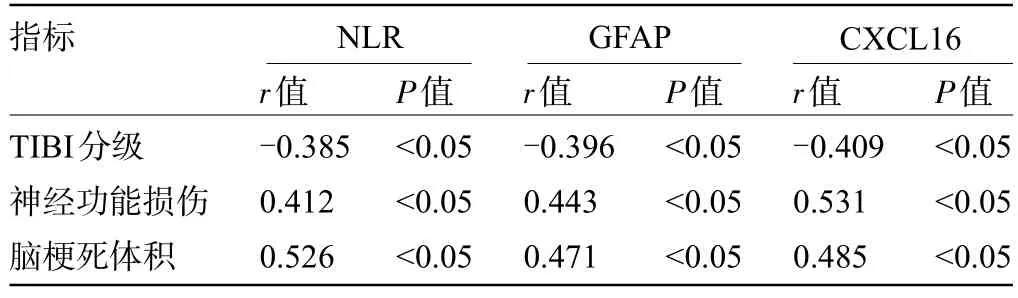
表5 血清各指标与TIBI分级、神经功能损伤、脑梗死体积的相关性Table 5 Correlation between various serum indicators and TIBI grading, neurological impairment, and cerebral infarction volume
2.6 影响ACI 患者预后的因素 经偏回归分析结果显示,将TIBI分级、神经功能损伤、脑梗死体积等其他混杂因素控制后,血清NLR、GFAP、CXCL16水平为ACI患者预后影响因素(P<0.05),见表6。
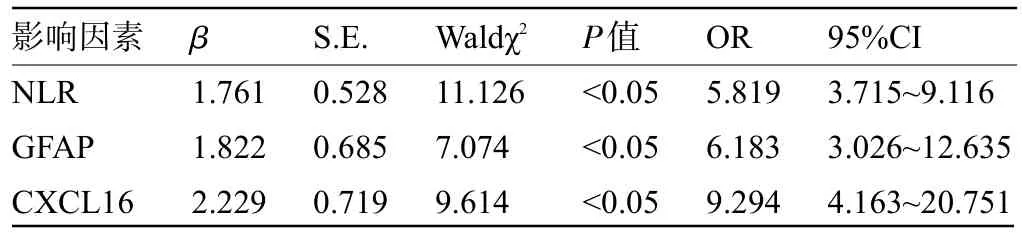
表6 影响ACI患者预后因素的偏回归分析Table 6Logistic regression analysis of factors affecting the prognosis of ACI patients
2.7 血清各指标对预后的预测价值 以预后不良组31 例为阳性样本,以预后良好组42 例为阴性样本绘制ROC曲线,结果显示,术后7 d、14 d血清NLR、GFAP、CXCL16 水平联合预测预后的AUC 大于单独指标预测,且术后14 d 血清各指标联合预测预后的AUC 大于术后7 d 血清各指标联合预测,差异均有统计学意义(P<0.05),见表7。
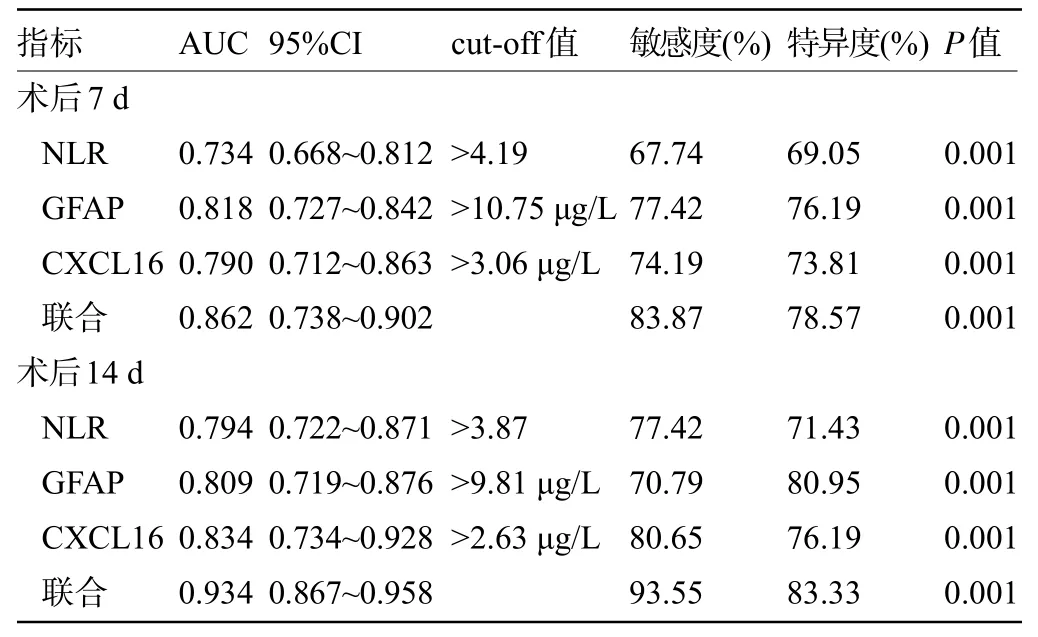
表7 血清各指标对预后的预测价值Table 7 Prediction value of various serum indicators for prognosis
3 讨论
ACI 病理基础为脑部动脉粥样硬化,其发生发展与血栓形成、炎性反应有关,血黏度增加、老化细胞增多、血流循环系统下降,可诱发神经功能缺损[9]。准确预测ACI预后有助于临床选择治疗方案,但目前尚缺乏ACI预后预测的高特异度指标。
NLR 升高表明机体炎性反应程度加重,且与神经功能恶化有关,并可参与动脉粥样硬化斑块破裂过程[10-11]。本研究结果显示,预后良好组术后NLR低于预后不良组,且与TIBI 分级呈负相关,而与神经功能损伤、脑梗死体积呈正相关,提示NLR 升高与ACI病情进展、预后不良有关。这是由于NLR是机体内重要炎性介质,促进动脉粥样硬化形成,可在脑缺血后炎性损伤过程中发挥作用。GFAP 可与多种细胞因子、血管黏附因子、促炎细胞趋化因子等相互作用,参与神经系统损伤、修复过程[12-13]。本研究结果显示,术后预后良好组血清GFAP 水平低于预后不良组,随着神经功能损伤、梗死体积增加,血清GFAP水平呈上升趋势,提示GFAP水平升高可能促进ACI疾病进展,促进预后不良发生。脑组织缺血、缺氧损伤发生后星形胶质细胞数量减少,细胞凋亡数量增加,致使GFAP分泌量增加,而GFAP 与基底神经节、脑白质损伤有关,并可穿透血脑屏障释放入血液循环中,加重脑组织损伤程度,诱发预后不良[14]。
随着脑梗死斑块扩大,CXCL16 水平逐渐升高,研究表明CXCL16 与神经功能损伤有关,可评估脑梗死患者病情严重程度,并可促进炎性信号释放,在一定程度上推动局部炎性反应发生,参与血管生成、动脉粥样硬化等病理发生过程[15-16]。本研究结果显示,预后良好组术后血清CXCL16 水平低于预后不良组,其与TIBI 分级呈负相关,而与神经功能损伤、脑梗死体积呈正相关,提示CXCL16 水平随着病情进展而逐渐升高,其水平升高预示预后不良。CXCL16可诱导血管生成,促进动脉粥样硬化发生发展,并可趋化体内T细胞、NK细胞,促进血管内平滑肌细胞增殖、巨噬细胞吞噬脂质,促使炎性细胞聚集于病灶组织,加重炎性反应,促使斑块出血、破裂,进而导致预后不良[17]。本研究结果显示血清NLR、GFAP、CXCL16水平与ACI 患者预后显著相关,进一步分析发现术后7 d、14 d血清NLR、GFAP、CXCL16水平联合预测预后的AUC 大于单独指标预测,提示NLR、GFAP、CXCL16对于ACI患者机械取栓后90 d预后具有一定预测价值。
综上所述,ACI患者血清NLR、GFAP、CXCL16水平升高,且与神经功能损伤、脑梗死体积呈正相关,联合检测其水平对机械取栓后90 d 内预后预测具有临床应用价值。

