miR-214-5p靶向FGFRL1对甲状腺癌细胞TPC-1增殖、侵袭和迁移影响
高建华,杜甲录,李今
1.榆林市第一医院普通外科二病区,陕西 榆林 719000;2.西北妇女儿童医院乳腺甲状腺外科,陕西 西安 710061
甲状腺癌是一种常见恶性肿瘤,严重影响患者生存质量[1-3]。微小RNA(microRNA,miRNA)在多种恶性肿瘤中异常表达,并可参与肿瘤发生及发展过程[4]。例如,miR-139-5p[5]、miR-335-5p[6]、miR-4319[7]在甲状腺癌中表达上调或下调,并可调节细胞增殖及转移等生物学过程从而参与甲状腺癌发生发展过程。微小RNA-214-5p (microRNA-214-5p,miR-214-5p)在胰腺癌[8]、骨肉瘤[9]中表达降低并可参与肿瘤发生及发展过程。但miR-214-5p 在甲状腺癌中的研究尚未见报道。成纤维细胞生长因子受体样1 (fibroblast growth factor receptor-like 1,FGFRL1)在膀胱癌[10]、喉癌[11]、食道鳞状细胞癌[12]等肿瘤中表达升高,沉默FGFRL1 可阻碍细胞增殖、转移。靶基因预测发现FGFRL1 与miR-214-5p 存在结合位点。本研究通过对比甲状腺癌细胞中miR-214-5p 与FGFRL1 表达水平,探究miR-214-5p对甲状腺癌细胞增殖、迁移及侵袭的影响及调控机制。
1 材料与方法
1.1 材料 于2019 年1 月至2019 年5 月收集榆林市第一医院收治的47 例甲状腺癌患者的癌组织及其相应癌旁组织标本置于-80℃冰箱内保存,均经病理诊断确诊为甲状腺癌,其中男性27 例,女性20 例,年龄50~67岁,平均(55.36±3.29)岁。
1.2 试剂 正常甲状腺HT-ori3 细胞与甲状腺癌BCPAP、TPC-1、SW1736 细胞均购自中国典型培养物保藏中心。Lipofectamine2000 购自上海阳光生物;miR-214-5p 抑制剂/模拟物(anti-miR-214-5p/miR-214-5p mimics) 及其阴性对照(anti-miR-con/miR-con)、FGFRL1 小干扰RNA(si-FGFRL1)及其阴性对照(si-con)均购自上海吉玛制药;FGFRL1 过表达载体(pcDNA-FGFRL1)及其对照(pcDNA-con)购自美国Invitrogen;Matrigel基质胶购自美国BD公司;Transwell小室购自美国Corning 公司;MTT检测试剂盒、PBS 缓冲液购自上海碧云天生物技术有限公司;Trizol试剂购自美国Thermo Fisher公司;反转录试剂盒购于大连宝生物;实时荧光定量PCR试剂盒购于上海欣百诺生物工程有限公司;兔抗人FGFRL1、CyclinD1、MMP-2、MMP-9抗体均购自北京博尔迈生物技术有限公司;山羊抗兔IgG二抗(HRP)购于武汉艾美捷。
1.3 方法
1.3.1 免疫组化检测甲状腺癌组织中FGFRL1 阳性率 使用乙醇对制备的甲状腺癌组织石蜡切片进行梯度脱水,加入柠檬酸盐溶液反应20 min,添加3%过氧化氢,25 min 后加山羊血清,15 min 后加入FGFRL1一抗,4℃过夜孵育加入二抗,室温下反应2 h,使用DAB 显色,苏木素复染,经蒸馏水冲洗后置于1%盐酸中5 s 后清洗,二甲苯透明,中性树脂封片,显微镜下选10个较清晰的视野统计阳性染色细胞数量,并计算其百分比。根据染色程度进行计数:未显色,0 分;浅黄色,1 分;棕黄色,2 分;棕褐色,3 分。阳性细胞数目<25%为0 分;阳性细胞数目在25%~50%为1分;数目在50~75%记为2分;阳性数目≥75%记为3分。取两组计分乘积:≤1分记为阴性,>1分记为阳性。
1.3.2 细胞转染及实验分组 甲状腺癌TPC-1细胞以2×105个/mL的密度接种于6孔板,分别将miR-con(miR-con 组)、miR-214-5p mimics (miR-214-5p 组)、anti-miR-con (anti-miR-con 组)、anti-miR-214-5p (anti-miR-214-5p组)、si-con(si-con组)、si-FGFRL1(si-FGFRL1组)、miR-214-5p mimics与pcDNA-con(miR-214-5p+pcDNA-con组)、miR-214-5p mimics与pcDNA-FGFRL1(miR-214-5p+pcDNA-FGFRL1组)转染至TPC-1细胞。未进行任何处理的细胞为NC组。
1.3.3 qRT-PCR检测miR-214-5p、FGFRL1 mRNA表达 参照厂家说明书,使用Trizol 从组织或细胞中分离总RNA。使用反转录试剂盒合成cDNA。然后,将稀释后的cDNA用实时荧光定量PCR试剂盒在ABI StepOnePlus 实时荧光定量PCR 仪上进行qRT-PCR。以U6 和β-actin 为内参,分析miR-214-5p、FGFRL1 mRNA的表达量。
1.3.4 MTT 检测甲状腺癌TPC-1 细胞存活率 TPC-1细胞(5×103/孔)接种于96孔板。转染后,用移液枪向每孔中加入MTT溶液(50 μL),37℃孵育4 h。接下来,用移液枪小心地去除培养基,加入DMSO(150 μL/孔)溶解甲瓒。最后,通过在490 nm处用酶标仪检测吸光度(OD)来计算细胞存活率(以实验组与对照组OD值的百分比表示)。
1.3.5 Transwell 实验检测TPC-1 细胞迁移 将经过1.3.2 处理的各组TPC-1 细胞加入Transwell小室的上室,同时将含有10%FBS的DMEM培养基加入下室,孵育24 h 后,过滤细胞的下室用4%的多聚甲醛固定15 min,用0.2%结晶紫染色,25 min,然后用显微镜成像,计数迁移细胞数。Transwell 上室预先涂上Matrigel,每孔30 μL,其他步骤与迁移实验相同。
1.3.6 双荧光素酶报告基因检测miR-214-5p靶基因 miR-214-5p 和FGFRL1 的结合序列由TargetScan 提供。将含有miR-214-5p 结合位点的FGFRL1 3'UTR的野生型(WT)或突变型(MUT)序列分别插入pmirGLO 荧光素酶报告载体,以创建WT 和MUT 质粒(WT-FGFRL1 和MUT-FGFRL1)。将上述报告质粒与miR-214-5p mimics或其对照(miR-NC)共转染TPC-1细胞。共转染24 h后,测定荧光素酶活性。
1.3.7 Western blot 检测FGFRL1、CyclinD1、MMP-2、MMP-9蛋白表达 提取组织或细胞总蛋白,用BCA 法定量蛋白后,将蛋白煮沸变性。10%~12%SDS-PAGE 分离蛋白,将蛋白转移到PVDF 膜上。然后,将膜封闭2 h,与FGFRL1、CyclinD1、MMP-2、MMP-9一抗(1∶1 000)的条件与时间分别为4℃孵育,24 h,TBST 洗膜后孵育二抗(1∶5 000)1 h,用ECL 检测结合信号。用Image J软件评估蛋白表达水平。
1.4 统计学方法 应用SPSS21.0 统计软件分析数据。计数资料比较采用χ2检验,计量资料符合正态分布,以均数±标准差()表示,两组间比较采用t 检验,多个组间比较采用单因素方差分析,进一步两两比较行LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 甲状腺癌组织与癌旁组织的miR-214-5p和FGFRL1 表达水平比较 与癌旁组织比较,甲状腺癌组织的miR-214-5p 表达下降,FGFRL1 的表达量升高,差异均有统计学意义(P<0.05),见图1和表1。同时免疫组化检测结果显示,甲状腺癌组织中的FGFRL1阳性率为68.09%(32/47),明显高于癌旁组织的6.38%(3/47),差异有统计学意义(χ2=453.729,P<0.05)。
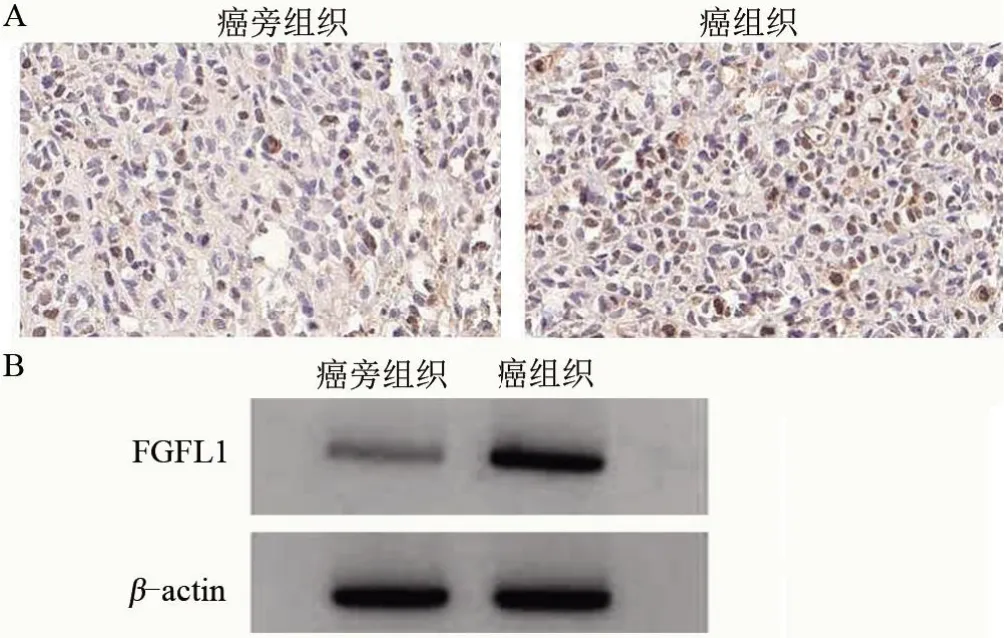
图1 FGFRL1在甲状腺癌患者中的表达情况Figure 1 Expression of FGFRL1 in patients with thyroid cancer
表1 甲状腺癌组织与癌旁组织的miR-214-5p和FGFRL1表达水平比较(,n=47)Table 1 Comparison on the expression levels of miR-214-5p and FGFRL1 in thyroid cancer tissues and adjacent tissues (,n=47)
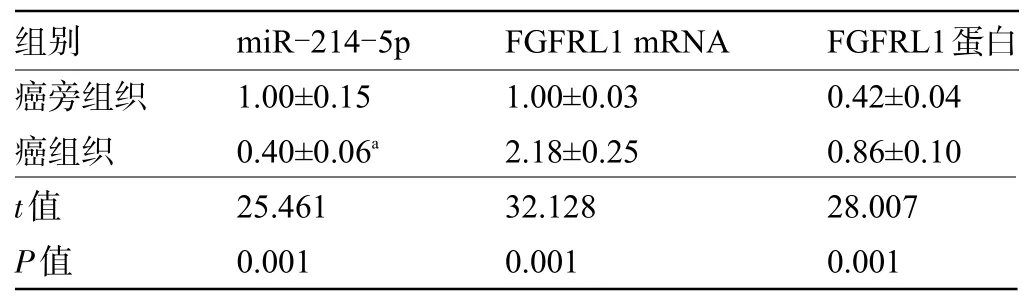
表1 甲状腺癌组织与癌旁组织的miR-214-5p和FGFRL1表达水平比较(,n=47)Table 1 Comparison on the expression levels of miR-214-5p and FGFRL1 in thyroid cancer tissues and adjacent tissues (,n=47)
组别癌旁组织癌组织miR-214-5p 1.00±0.15 0.40±0.06a FGFRL1 mRNA 1.00±0.03 2.18±0.25 FGFRL1蛋白0.42±0.04 0.86±0.10 t值P值25.461 0.001 32.128 0.001 28.007 0.001
2.2 甲状腺癌细胞系的miR-214-5p 和FGFRL1表达水平比较 miR-214-5p 在甲状腺癌BCPAP、TPC-1、SW1736 细胞中表达低于HT-ori3,FGFRL1 mRNA及蛋白表达高于HT-ori3,差异均有统计学意义(P<0.05)。TPC-1 细胞中miR-214-5p 表达最低,表明miR-214-5p 可能通过负向调控FGFRL1 的表达而参与甲状腺癌发生过程。故选择TPC-1 细胞进行下一步研究,见图2和表2。
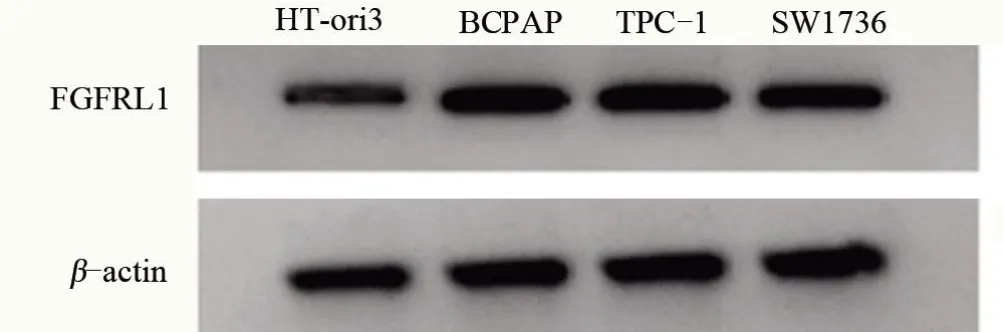
图2 Western Blot检测FGFRL1蛋白表达情况Figure 2 Detection of FGFRL1 protein expression by Western blot
表2 甲状腺癌细胞系和正常甲状腺细胞中miR-214-5p、FGFRL1 mRNA和FGFRL1 protein表达量比较(,n=9)Table 2Comparison of miR-214-5p, FGFRL1 mRNA, and FGFRL1 protein expression levels in thyroid cancer cell lines and normal thyroid cells(,n=9)
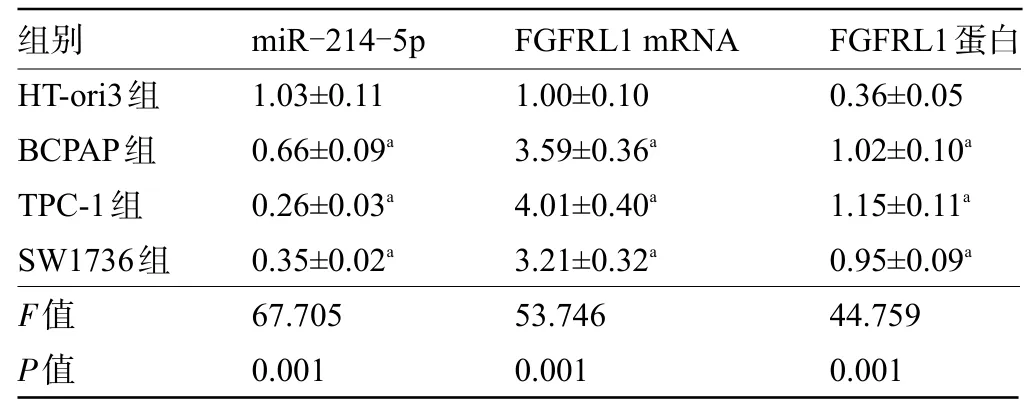
表2 甲状腺癌细胞系和正常甲状腺细胞中miR-214-5p、FGFRL1 mRNA和FGFRL1 protein表达量比较(,n=9)Table 2Comparison of miR-214-5p, FGFRL1 mRNA, and FGFRL1 protein expression levels in thyroid cancer cell lines and normal thyroid cells(,n=9)
注:与HT-ori3细胞组比较,aP<0.05.Note:Compared with HT-ori3 cell group,aP<0.05.
组别HT-ori3组BCPAP组TPC-1组SW1736组F值P值miR-214-5p 1.03±0.11 0.66±0.09a 0.26±0.03a 0.35±0.02a 67.705 0.001 FGFRL1 mRNA 1.00±0.10 3.59±0.36a 4.01±0.40a 3.21±0.32a 53.746 0.001 FGFRL1蛋白0.36±0.05 1.02±0.10a 1.15±0.11a 0.95±0.09a 44.759 0.001
2.3 miR-214-5p 对TPC-1 甲状腺癌细胞增殖、迁移和侵袭的影响 与miR-con组比较,miR-214-5p组甲状腺癌TPC-1细胞存活率、迁移、侵袭细胞数及蛋白CyclinD1、MMP-2、MMP-9表达降低,差异均有统计学意义(P<0.05);与anti-miR-con组比较,anti-miR-214-5p组甲状腺癌TPC-1细胞存活率、迁移、侵袭细胞数及蛋白CyclinD1、MMP-9、MMP-2表达升高,差异均有统计学意义(P<0.05),表明miR-214-5p 可阻碍甲状腺癌细胞增殖、迁移及侵袭,而抑制miR-214-5p 表达可促进甲状腺癌细胞增殖、迁移及侵袭,见图3和表3。
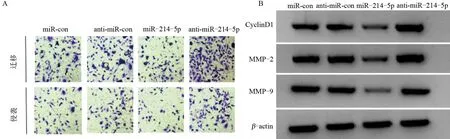
图3 miR-214-5p对TPC-1甲状腺癌细胞增殖、迁移和侵袭的影响Figure 3 Effect of miR-214-5p on proliferation,migration,and invasion of TPC-1 thyroid cancer cells
表3 miR-214-5p对TPC-1甲状腺癌细胞增殖、迁移和侵袭的影响(,n=3)Table 3 Effect of miR-214-5p on the proliferation,migration,and invasion of TPC-1 thyroid cancer cells(,n=3)
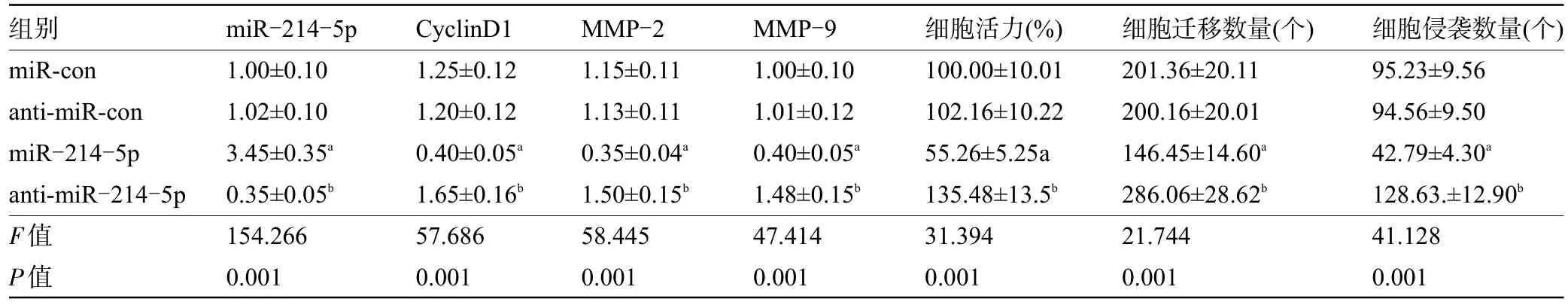
表3 miR-214-5p对TPC-1甲状腺癌细胞增殖、迁移和侵袭的影响(,n=3)Table 3 Effect of miR-214-5p on the proliferation,migration,and invasion of TPC-1 thyroid cancer cells(,n=3)
注:与miR-con组比较,aP<0.05;与anti-miR-con组比较,bP<0.05。Note:Compared with miR-con group,aP<0.05;compared with anti-miR-con group,bP<0.05.
组别miR-con anti-miR-con miR-214-5p anti-miR-214-5p F值P值细胞侵袭数量(个)95.23±9.56 94.56±9.50 42.79±4.30a 128.63.±12.90b 41.128 0.001 miR-214-5p 1.00±0.10 1.02±0.10 3.45±0.35a 0.35±0.05b 154.266 0.001 CyclinD1 1.25±0.12 1.20±0.12 0.40±0.05a 1.65±0.16b 57.686 0.001 MMP-2 1.15±0.11 1.13±0.11 0.35±0.04a 1.50±0.15b 58.445 0.001 MMP-9 1.00±0.10 1.01±0.12 0.40±0.05a 1.48±0.15b 47.414 0.001细胞活力(%)100.00±10.01 102.16±10.22 55.26±5.25a 135.48±13.5b 31.394 0.001细胞迁移数量(个)201.36±20.11 200.16±20.01 146.45±14.60a 286.06±28.62b 21.744 0.001
2.4 敲减FGFRL1 抑制TPC-1 甲状腺癌细胞增殖、迁移和侵袭 与si-con 组比较,si-FGFRL1 组甲状腺癌TPC-1细胞存活率、迁移及侵袭细胞数降低,蛋白FGFRL1、CyclinD1、MMP-9、MMP-2表达降低,差异均有统计学意义(P<0.05),表明敲减FGFRL1可明显降低甲状腺癌细胞增殖、迁移及侵袭能力,见图4、表4。

图4 敲减FGFRL1,Western Blot 检测FGFRL1、CyclinD1、MMP2、MMP9的蛋白表达Figure 4 Knockdown of FGFRL1 and detection of the expression of FGFRL1, CyclinD1, MMP2, and MMP9 protein by Western blot
表4 敲减FGFRL1抑制甲状腺癌细胞系TPC-1增殖、迁移和侵袭(,n=3)Table 4 Knockdown of FGFRL1 inhibits the proliferation,migration,and invasion of thyroid cancer cell line TPC-1(,n=3)

表4 敲减FGFRL1抑制甲状腺癌细胞系TPC-1增殖、迁移和侵袭(,n=3)Table 4 Knockdown of FGFRL1 inhibits the proliferation,migration,and invasion of thyroid cancer cell line TPC-1(,n=3)
注:与si-con组比较,aP<0.05。Note:Compared with si-con group,aP<0.05.
组别NC si-con si-FGFRL1 F值P值FGFRL1 1.18±0.12 1.15±0.11 0.41±0.05a 58.352 0.001 CyclinD1 1.21±0.12 1.18±0.11 0.36±0.05a 71.410 0.001 MMP2 1.15±0.11 1.12±0.11a 0.43±0.05a 55.713 0.001 MMP9 1.01±0.12 1.00±0.10a 0.35±0.05a 48.224 0.001细胞活力(%)100.00±10.03 101.05±10.11 48.35±4.84a 36.146 0.001细胞迁移数量(个)205.12±20.06 202.46±20.24 135.16±13.64a 14.173 0.001细胞侵袭数量(个)96.08±9.65 95.14±9.52 50.28±5.19a 29.268 0.001
2.5 miR-214-5p 靶向FGFRL1 靶基因预测显示FGFRL1 的3’UTR 区域存在miR-214-5p 的结合位点。miR-214-5p过表达抑制了WT-FGFRL1的荧光素酶活性,差异有统计学意义(P<0.05)。miR-214-5p 组甲状腺癌TPC-1 细胞中FGFRL1 蛋白表达水平明显低于miR-con 组,差异具有统计学意义(P<0.05);anti-miR-214-5p组甲状腺癌TPC-1细胞中FGFRL1蛋白表达水平明显高于anti-miR-con组,差异有统计学意义(P<0.05),表明miR-214-5p 可靶向结合FGFRL1,并可负向调控FGFRL1的表达及活性,见图5。

图5 miR-214-5p靶向调控FGFRL1表达Figure 5 MiR-214-5p targeted regulation of FGFRL1 expression
2.6 FGFRL1高表达可部分逆转miR-214-5p高表达对TPC-1增殖、迁移和侵袭的抑制作用 miR-214-5p+pcDNA-FGFRL1组甲状腺癌TPC-1细胞存活率、迁移及侵袭细胞数、蛋白CyclinD1、MMP-2、MMP-9 表达较miR-214-5p+pcDNA-con 组增高,差异有统计学意义(P<0.05),表明高表达FGFRL1 可以部分逆转miR-214-5p高表达对TPC-1增殖、迁移和侵袭的抑制作用,见图6和表5。
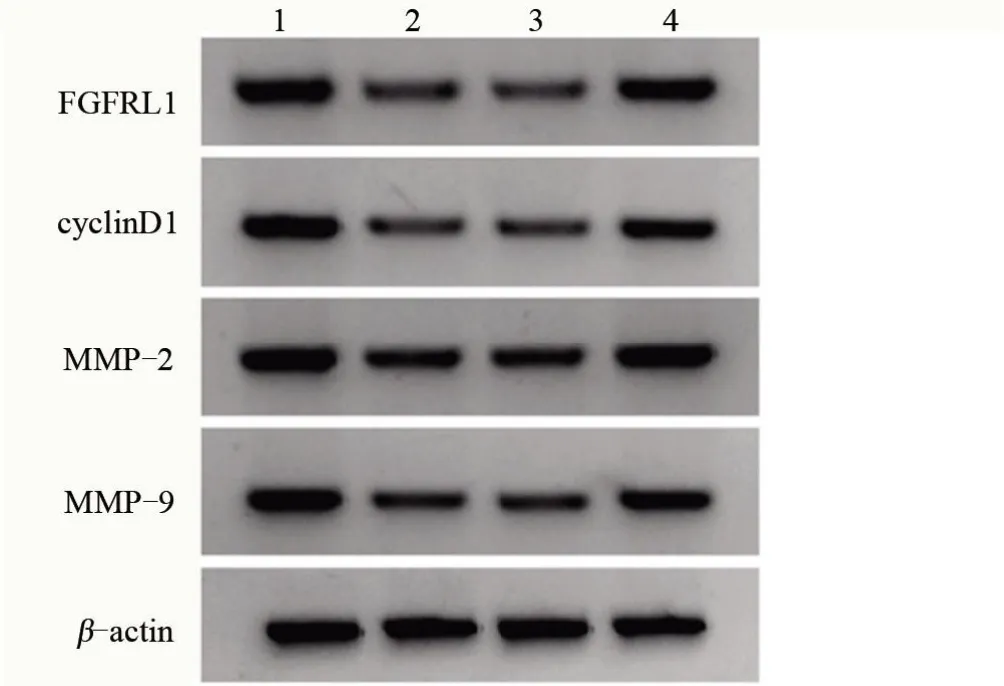
图6 Western blot检测FGFRL1、CyclinD1、MMP2、MMP9蛋白表达Figure 6 Detection of FGFRL1, CyclinD1, MMP2, MMP9 protein expression by Western blot
表5 FGFRL1高表达可部分逆转miR-214-5p高表达对TPC-1增殖、迁移和侵袭的影响(,n=3)Table 5 FGFRL1 overexpression can partially reverse the effects of miR-214-5p overexpression on TPC-1 proliferation, migration, and invasion(,n=3)
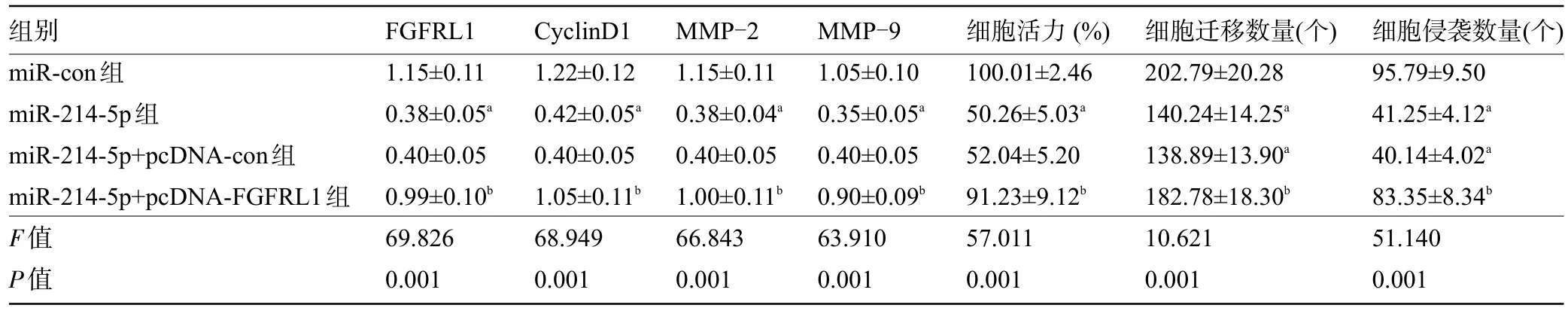
表5 FGFRL1高表达可部分逆转miR-214-5p高表达对TPC-1增殖、迁移和侵袭的影响(,n=3)Table 5 FGFRL1 overexpression can partially reverse the effects of miR-214-5p overexpression on TPC-1 proliferation, migration, and invasion(,n=3)
注:与miR-con组比较,aP<0.05;与miR-214-5p+pcDNA-con组比较,bP<0.05。Note:Compared with miR-con group,aP<0.05;compared with miR-214-5p+pcDNA-con group,bP<0.05.
组别miR-con组miR-214-5p组miR-214-5p+pcDNA-con组miR-214-5p+pcDNA-FGFRL1组F值P值FGFRL1 1.15±0.11 0.38±0.05a 0.40±0.05 0.99±0.10b 69.826 0.001 CyclinD1 1.22±0.12 0.42±0.05a 0.40±0.05 1.05±0.11b 68.949 0.001 MMP-2 1.15±0.11 0.38±0.04a 0.40±0.05 1.00±0.11b 66.843 0.001 MMP-9 1.05±0.10 0.35±0.05a 0.40±0.05 0.90±0.09b 63.910 0.001细胞活力(%)100.01±2.46 50.26±5.03a 52.04±5.20 91.23±9.12b 57.011 0.001细胞迁移数量(个)202.79±20.28 140.24±14.25a 138.89±13.90a 182.78±18.30b 10.621 0.001细胞侵袭数量(个)95.79±9.50 41.25±4.12a 40.14±4.02a 83.35±8.34b 51.140 0.001
3 讨论
miR-214在卵巢癌、舌鳞癌等肿瘤中呈高表达,并可影响肿瘤发生及发展进程[13-14]。Yao 等[15]研究表明miR-214-5p 在胰腺癌细胞中下调表达,LncRNA DANCR 可通过竞争性吸附miR-214-5p 而上调E2F2表达进而加速胰腺癌恶性进展。有报道显示miR-214-5p 可抑制肝癌细胞转移[16]。本研究结果显示,甲状腺癌组织及细胞中miR-214-5p 表达下降,上调miR-214-5p 表达后甲状腺癌细胞增殖、迁移及侵袭能力均明显降低;下调miR-214-5p 表达后可促进甲状腺癌细胞增殖、迁移及侵袭,提示miR-214-5p 在甲状腺癌细胞中发挥抑癌作用。进一步研究发现CyclinD1、MMP-2、MMP-9 表达水平与甲状腺癌细胞增殖、迁移及侵袭能力的强弱呈正相关,提示上调miR-214-5p 表达可通过降低CyclinD1、MMP-2、MMP-9 表达水平抑制甲状腺癌细胞增殖、迁移及侵袭。
FGFRL1 通过调控Hedgehog 信号进而促进卵巢癌进展[17]。miR-210 通过靶向FGFRL1 进而促进肝细胞癌、肺腺癌细胞增殖[18-19]。本研究结果表明FGFRL1在甲状腺癌组织及细胞中表达升高,抑制FGFRL1 表达可明显抑制甲状腺癌细胞增殖、迁移及侵袭,提示FGFRL1的高表达可能是促进甲状腺癌发生及发展的重要原因之一。靶基因预测显示FGFRL1与miR-210存在结合位点,本研究采用双荧光素酶报告基因实验证实miR-210 可靶向结合FGFRL1,进一步研究证实miR-210可负向调控FGFRL1表达;通过上调FGFRL1表达发现,FGFRL1可明显逆转miR-214-5p的抗甲状腺癌细胞增殖、迁移、侵袭功能。表明miR-214-5p 可通过下调FGFRL1 表达抑制甲状腺癌细胞增殖、迁移及侵袭。提示miR-214-5p 可能作为甲状腺癌靶向治疗的潜在靶点。
综上所述,miR-214-5p在甲状腺癌中发挥抑癌作用,其通过负向调控靶基因FGFRL1 表达抑制甲状腺癌细胞增殖、迁移及侵袭,为甲状腺癌早期诊断及治疗靶点提供新方向。但本研究仅采用一种甲状腺癌细胞进行研究,miR-214-5p/FGFRL1对其他甲状腺癌细胞生物学行为的影响尚需进一步探究。

