基于CT增强的灰度直方图纹理特征预测胰腺导管腺癌的生存预后
李梅 胡苗苗 黄菊
胰腺癌是消化系统难治性恶性肿瘤之一,早期诊断和治疗及其困难。而胰腺导管腺癌(Pancreatic ductal adenocarcinoma,PDAC)又是最常见的胰腺癌类型,起源于胰腺导管上皮,约占胰腺全部恶性肿瘤的90%左右[1]。PDAC 预后极差,进展迅速,1 年生存率在18%~24%,而5 年生存率<10%[2]。纹理分析是近年来一种能够提取、分析和预处理病变或组织微量特征的方法,通过高通量提取大量肉眼不可见的影像学特征达到术前诊断、鉴别诊断、定性、疗效评估等方法[3]。因此本研究旨在通过提取PDAC 患者门脉期CT 灰度直方图纹理特征,并结合临床和影像学特征,用单因素和多因素COX 回归模型得到影响PDAC 预后的独立危险因素,为临床决策提供参考。
1 资料与方法
1.1 临床资料 收集2012 年1 月至2021 年2 月本院经穿刺或手术病理证实的PDAC 患者104 例,男70 例,女34 例;年龄27~90 岁。纳入标准:①有完整的临床、影像及病理学资料;②术前或穿刺前2 个月内行增强CT 检查;排除标准:①随访中患者不配合;②检查前已接受放化疗或免疫治疗等;③胰腺实质萎缩无法准确测量CT 值或病灶区域伴伪影而无法准确勾画靶区。
1.2 方法 所有患者检查前需空腹6~8 h。采用64排螺旋CT(Siemens SOMATOM Definition AS)进行扫描。扫描参数:管电压120 kV;管电流400 mAs 或250 mAs;层厚3~5 mm;层距3~5 mm;矩阵380×380。增强对比剂采用碘海醇(300 mgI/mL)经肘静脉快速注射,速率为3.0 mL/s,分别于动脉期25~28 s、门静脉期45~60 s 处扫描。
1.3 图像分析 由2 位放射科医师在不知病理诊断的情况下共同阅片,分析并记录一般资料(包括性别、年龄、主诉、肿瘤标志物等)和影像学资料,肿瘤标志物包含癌胚抗原(CEA)、糖类抗原19-9(CA19-9)和CA125。影像学资料包括部位(头颈部、体尾部),大小(肿瘤最大径),形态(类圆形和不规则形),边界(清楚、不清),成分(实性、囊实性),胰管、胆管扩张(管径≥3 mm、≥8 mm),继发胰腺炎、继发远端实质萎缩,侵犯周围组织或器官,淋巴转移(短径>10 mm 或出现坏死),远处转移(肝、肺、骨、非区域性淋巴结等);计算相对密度指数(相对密度指数=病灶CT 值/周围正常胰腺实质CT 值),分别得出平扫比值、动脉期比值和门脉期比值;在放置感兴趣区时,要避开囊变、出血、坏死区域。
1.4 纹理特征提取 应用开源软件MaZda 进行门脉期纹理特征提取。由2 位医师协商后确定肿瘤最大层面,然后将门脉期图像以BMP 的格式导入到软件中,在特征提取前,对图像进行标准化灰阶处理使得亮度和对比度达到一致水平,随后勾画感兴趣区域,每个病灶提取9 个灰度直方图纹理特征,包括平均值(Mean)、方差(Variance)、偏度(Skewness)、峰度(Kurtosis)、第1百分位数(Perc01)、第10 百分位数(Perc10)、第50百分位数(Perc50)、第90 百分位数(Perc90)和第99百分位数(Perc99)。
1.5 随访 总体生存率(OS):自穿刺或手术日起至患者死亡的时间;删失数据:在最后随访截止时间(2021年10 月)患者存活或因不明原因失访;记录患者生存时间和状态。
1.6 统计学分析 采用Stata 14.0 统计学软件。计数资料用%表示,计量资料用(±s)表示;用单因素COX回归分析确定各因素对PDAC 的预后风险比,将P<0.05的因素纳入多因素COX 回归分析模型中,记录95%置信区间。将纳入多因素分析的连续变量通过受试者操作特征曲线(ROC)转化成二分类变量,并确定最佳截断值,并将多因素COX 回归结果进行列线图模型的绘制。应用Kaplan-Meier 法绘制生存曲线。以P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料 86.5%的PDAC 患者伴有症状,常见的临床表现为上腹痛、腹部不适,其次包括腹泻、黄疸、乏力、纳差等;78.8%的患者伴有肿瘤标志物升高。PDAC 常为不规则、边界不清的肿块,周围组织侵犯较淋巴结和远处转移更常见,增强强化程度低于胰腺实质。见表1。
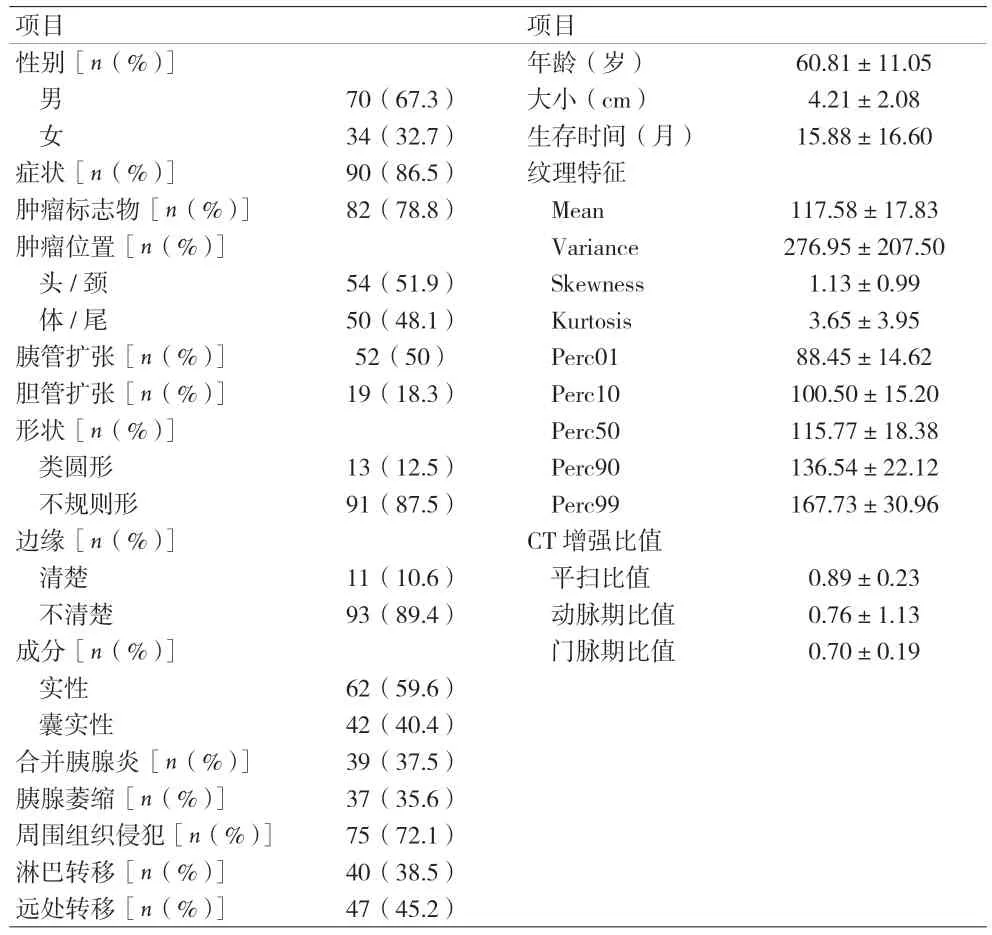
表1 临床、影像学和纹理特征基线数据
2.2 单因素COX 回归分析 肿瘤标志物、纹理特征Skewness、形状、肿瘤最大径和门脉期比值为PDAC 预后的预测因素。将P<0.05 的连续变量进行二分类的转换,得出截断值年龄为64 岁,Skewness 为1.15、Kurtosis 为3.90、肿瘤最大径为5.3 cm 和门脉期比值为0.62。见表2。
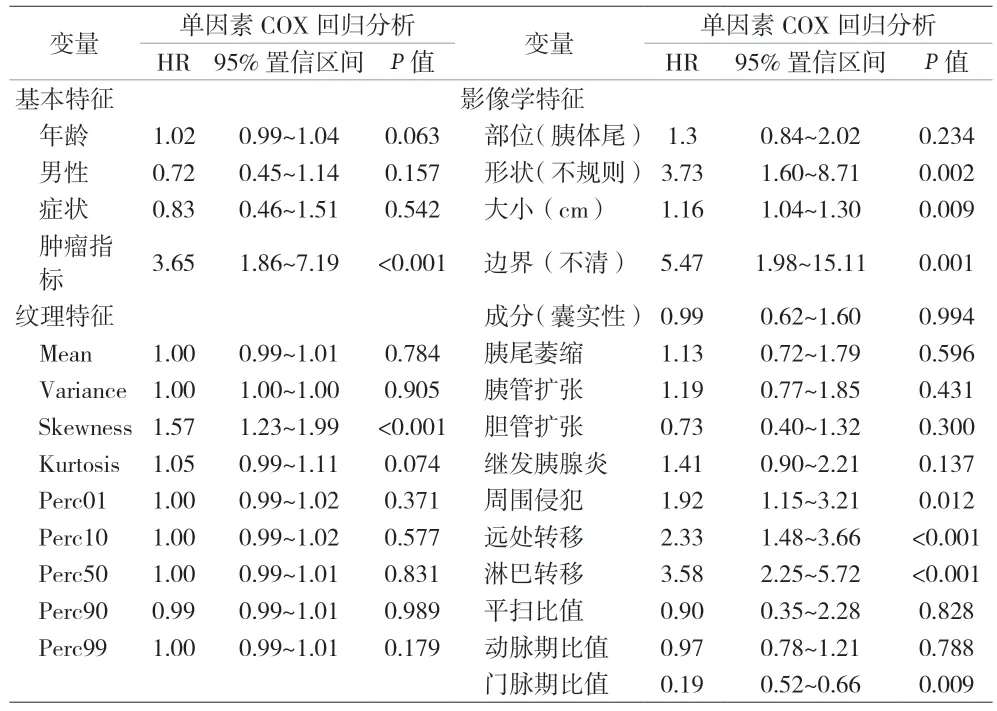
表2 单因素COX回归分析
2.3 多因素COX 回归分析 纳入的因素包括:肿瘤指标、纹理特征Skewness、Kurtosis、年龄、形状、大小、边界、周围侵犯、远处转移、淋巴转移和门脉期比值。经多因素COX 回归分析得出,Skewness>1.15(HR=1.71)、肿瘤指标升高(HR=2.52)、肿瘤最大径>5.3 cm(HR=1.17)、边界不清(HR=10.56)、远处转移(HR=2.26)和淋巴转移(HR=4.98)是PDAC 预后的危险因素。而Kurtosis>3.9(HR=0.92)和门脉期比值≤0.62(HR=0.2)是PDAC 预后的保护因素(P<0.05)。见表3。
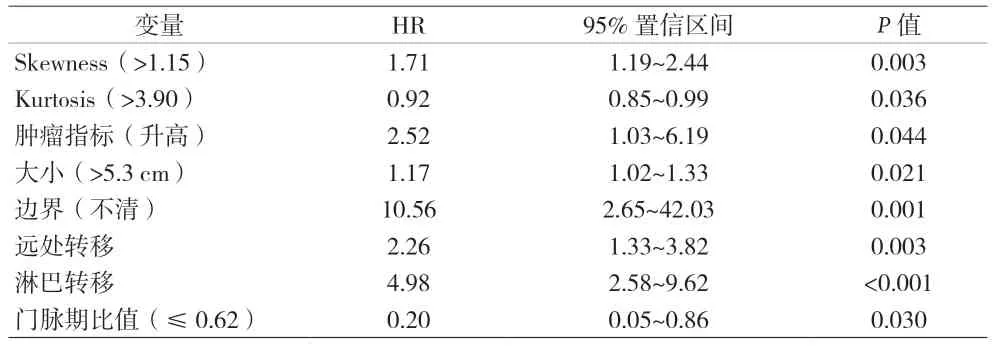
表3 多因素COX回归分析
2.4 总体生存曲线PDAC的平均生存时间为15.9个月,中位生存时间9 个月,范围1~70 个月,1 年生存率为41.3%,5 年生存率为12.6%。列线图模型纳入多因素COX 回归有意义的特征进行第1 年和第3 年胰腺癌患者生存率的预测,单个特征所得的分数相加得到的总分对应的生存率即可预测胰腺癌患者的生存。见图1-2。
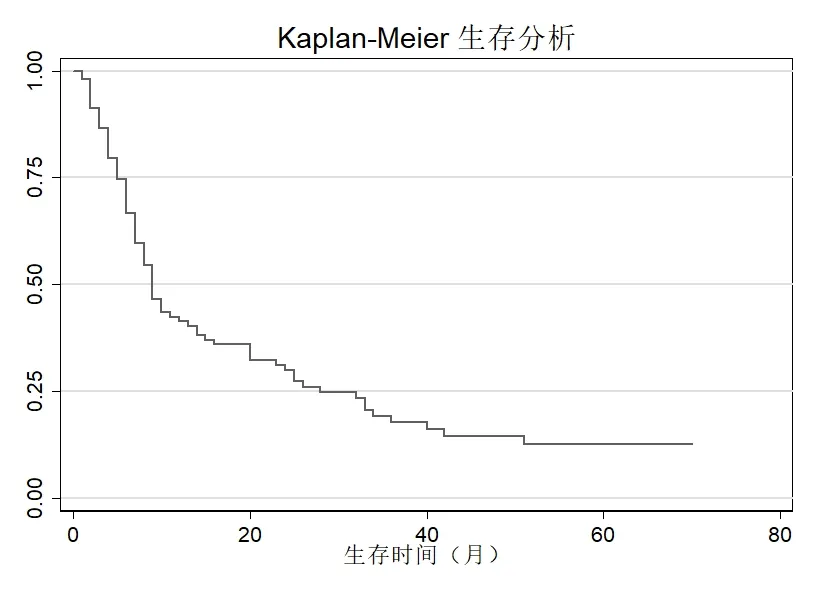
图1 总体PDAC Kaplan-Meier生存分析图
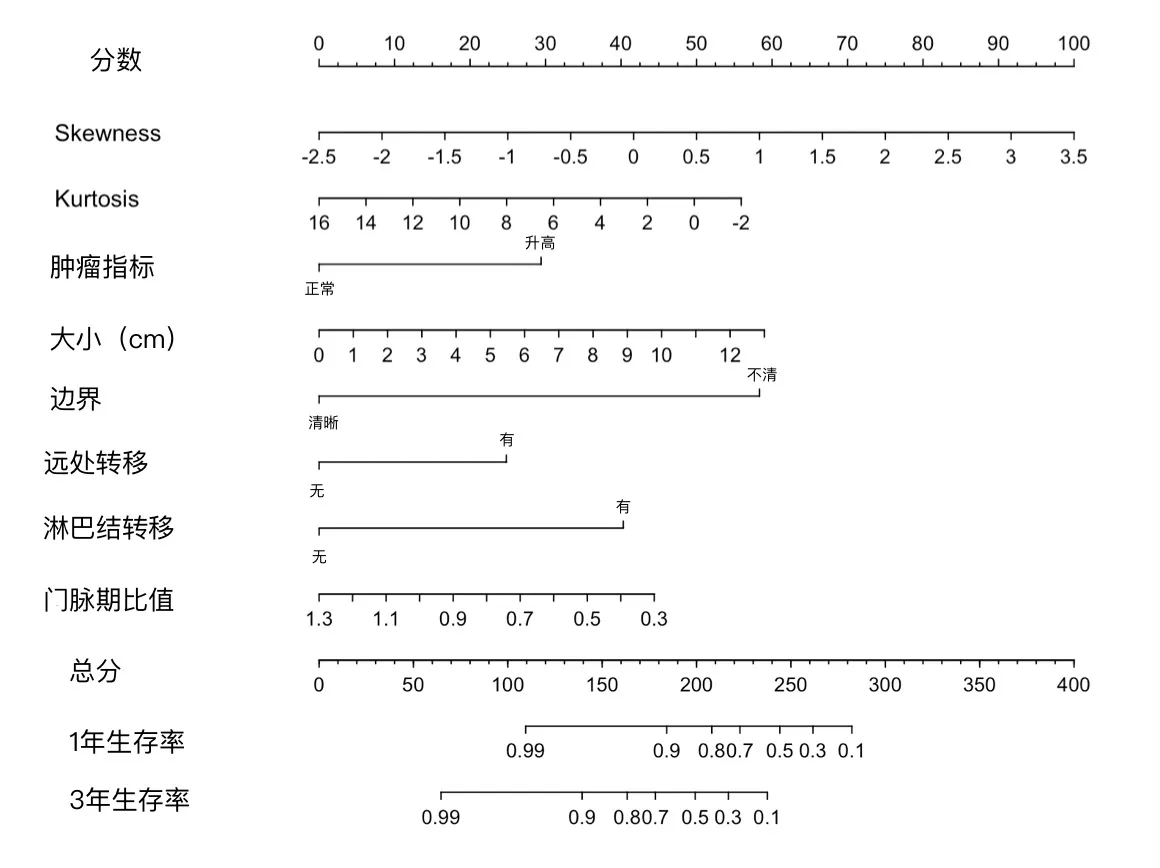
图2 基于影像组学特征和影像学特征预测胰腺癌生存率的列线图模型
3 讨论
影响PDAC 预后的因素因研究侧重点不同而有所差异。一些研究表明影响PDAC 总体生存率的原因不仅有年龄、性别、血清白蛋白水平、大小等[4]。本研究结合CT 门脉期纹理特征和影像学表现去探讨影响PDAC预后的因素,采用单因素和多因素COX 比例风险回归模型得出:肿瘤标志物、纹理特征Skewness、Kurtosis、大小、边界、淋巴转移、远处转移和门脉期比值是PDAC生存预后的预测因素。
纹理特征能表现出肿瘤的微观异质性,反映肿瘤内部侵袭性等特征,进而可以预测肿瘤预后特征。灰度直方图反映图像亮度在各个灰度级上出现的概率、灰度对比度量度和灰度峰值。本研究发现偏度Skewness、峰度Kurtosis 与PDAC 预后相关。偏度数值越高,提示预后越差,而峰度数值越低,预后越差。而这些特征反映的数据分布差异间接反映出肿瘤内部异质性,可能跟胰腺癌内部大量的纤维化和黏液基质相关。研究表明CT纹理分析可以预测局部晚期胰腺癌的化疗疗效[5]。而沈力等[6]研究同样采用MaZda 软件提取胰腺癌静脉期9 个灰度直方图特征预测胰腺癌分化程度,发现均值、第1、10、50 百分位数在高分化和中低分化组内差异有统计学意义。
除了纹理特征能影响PDAC 预后外,本研究显示肿瘤标志物也是预后指标,虽然其一直以来是检测PDAC病情变化的指标[7]。魏玮等[8]研究证实CA19-9 和CEA水平升高是晚期胰腺癌预后不良的危险因素,与本研究结果一致,提示当有肿瘤标志物升高时,患者的生存预后也较差。
在影像学表现上,本研究显示肿瘤最大径>5.3 cm、边缘不清、伴有远处转移和淋巴转移的患者预后差。边缘不清提示肿瘤组织的浸润性生长方式,而较大的肿瘤常预示已经出现周围组织侵犯、淋巴转移和远处转移。CONTRERAS 等[9]研究发现接受胰十二指肠切除手术的PDAC 患者中,伴有淋巴转移的患者中位生存时间低于无淋巴转移的患者(P<0.0001)。OWEIRA 等[10]分析晚期胰腺癌患者发现转移患者的生存率低于无转移患者。另外,胰腺癌是乏血供肿瘤,本研究中发现门脉期比值≤0.62 是预后的保护因素,与沈力等[6]研究结果有差异。可能与本研究样本量较少有关,还需大样本进行验证。
综上所述,CT 纹理特征和影像学特征结合可以预测PDAC 的生存预后,两者结合的列线图模型可以进行生存率的直观预测。

