CEACAM1在肺腺癌中表达及免疫浸润分析
陈海欣 陈平 陈婷婷
肺癌是发病率和死亡率较高的恶性肿瘤之一,其主要病理类型包括非小细胞肺癌(NSCLC)及小细胞肺癌(SCLC),其中NSCLC 约占85%[1]。肺腺癌(LUAD)是原发性肺癌中最常见的组织学亚型,50%的LUAD患者被发现时已经处于晚期并存在远处转移,转移性肺癌5 年生存率为4%~18%[2-3]。癌胚抗原(CEA)作为恶性肿瘤诊断的重要指标,在结肠癌、胃癌、肺癌等肿瘤中表达均存在增高[4]。CEA 作为一种细胞膜结构蛋白,参与细胞黏附,异常升高可以促进肿瘤细胞转移[5]。癌胚抗原相关细胞黏附分子1(CEACAM1)是CEA 家族中唯一在T 细胞和NK 细胞等免疫细胞上表达的成员,抑制免疫细胞抗肿瘤功能[6]。本研究拟通过TCGA-LUAD 和HPA 数据库,分析CEACAM1 在LUAD 肿瘤组织中表达情况,CEACAM1 与肿瘤浸润免疫细胞的相关性,探索CEACAM1 与多种免疫检查点共表达关系,分析CEACAM1 在LUAD 免疫细胞中调节作用以及CEACAM1 在LUAD 参与的信号通路,为CEACAM1 是否可以作为治疗靶点提供理论依据。
1 资料与方法
1.1 资料收集 从TCGA(https://portal.gdc.cancer.gov/)下载LUAD 项目中HTSeq-FPKM 格式的RNAseq 数据和患者临床资料用于CEACAM1 差异表达、免疫浸润、免疫检查点共表达及通路富集分析。
1.2 方法 (1)差异表达分析:对TCGA-LUAD 数据库中肿瘤组织和癌旁组织CEACAM1 表达进行差异分析,R 软件包“ggplot2”用于可视化分析。通过HPA 数据库(https://www.proteinatlas.org)分析LUAD 肿瘤组织中免疫组化结果,分析肿瘤组织和癌旁组织中CEACAM1 表达差异。(2)KM 生存曲线分析:应用KM 数据库(http://kmplot.com/analysis/)分析不同病理分期CEACAM1 高低表达组总生存率(overall survival rate,OS)差异。(3)免疫浸润分析:应用R 软件包“GSVA”进行免疫浸润分析,免疫浸润算法为ssGSEA。分析CEACAM1 与肿瘤浸润的免疫细胞的相关性,免疫细胞选择活化的树突状细胞(aDC)、B 细胞、CD8T 细胞、细胞毒性细胞、DC细胞、嗜酸性粒细胞、幼稚的树突状细胞(iDC)、巨噬细胞、肥大细胞、中性粒细胞,CD56+NK 细胞,CD56-NK 细胞、NK 细胞、浆细胞样树突状细胞(pDC)、T细胞、T 辅助细胞、中央记忆型T 细胞(Tcm)、效应记忆T 细胞(Tem)、滤泡辅助性T 细胞(TFH)、γδ T细胞、Th1 细胞、Th17 细胞、Th2 细胞和调节性T 细胞(Treg)。(4)CEACAM1 与其他免疫检查点共表达情况分析:应用R 软件包“ggplot2”用于可视化分析,分析CEACAM1 与其余8 个免疫检查点(SIGLEC15、TIGIT、CD274、HAVCR2、PDCD1、CTLA4、LAG3 和PDCD1LG2)共表达情况。(5)通路富集分析:根据CEACAM1 表达情况分为低表达组和高表达组,分析两组中存在表达差异显著的基因,并通过GSEA 基因富集分析。使用P值和归一化富集分数(normalized enrichment fraction,NES)对每个表型中富集的途径进行分类。若错误发现率(false discovery rate,FDR)<0.25 且校准P<0.05 表明在高表达表型中显著富集。
1.3 统计学分析 采用SPSS 18.0 统计软件。符合正态分布计量资料以(±s)表示,两组比较用t检验;偏态分布计量资料以M(Q1,Q3)表示,两组比较用秩和检验;计数资料以n(%)表示,用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 患者临床资料比较 TCGA-LUAD 数据库中,排除缺少RNAseq 数据或临床信息的患者,相同患者保留原位癌数据,最后共筛选出535 例LUAD 患者纳入本次分析,以肺肿瘤组织中CEACAM1 表达量的中位值作为界限,将患者分成高表达组(268 例)和低表达组(267例)。见表1。
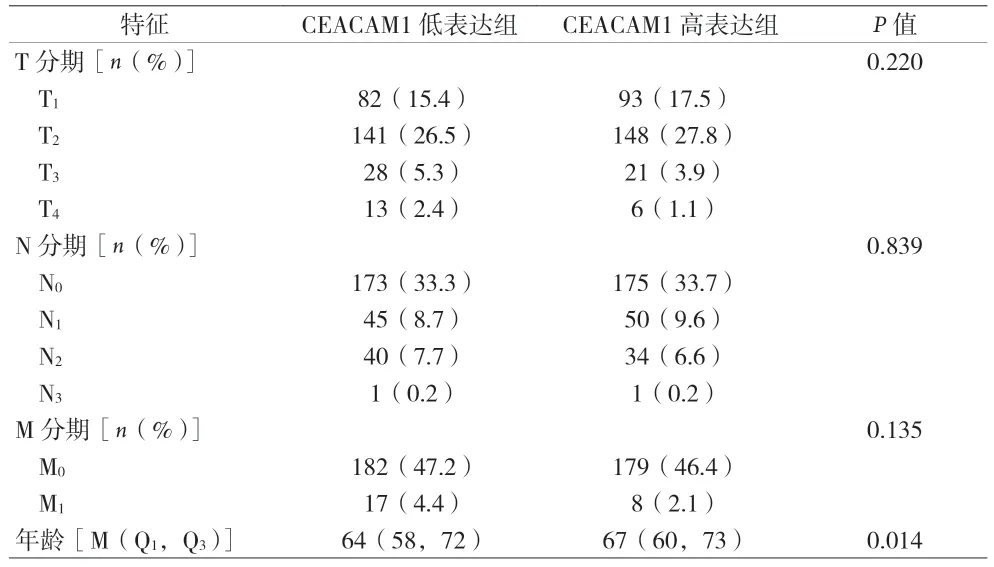
表1 LUAD患者临床资料
2.2 CEACAM1 在肿瘤组织和癌旁组织表达差异 通过非配对样本检验,LUAD 患者肿瘤组织中CEACAM1的含量高于癌旁组织的平均水平,两组差值为1.502(1.38~1.625),差异有统计学意义(t=24.151,P<0.001);通过配对样本检验,肿瘤组织中CEACAM1 的含量也高于癌旁组织的平均水平,两组差值为1.423(1.134~1.712),差异有统计学意义(t=9.857,P<0.001)。见图1。

图1 CEACAM1在肿瘤组织和癌旁组织表达
2.3 CEACAM1 免疫组化结果分析 CEACAM1 在肿瘤组织中高表达,在正常肺组织中几乎不表达,见图2。

图2 CEACAM1在肿瘤组织和癌旁组织免疫组化结果(HPA数据库)
2.4 KM 生存曲线分析 在LUAD 中,CEACAM1 高表达患者OS 偏低(P<0.05)。由于IV 期患者数不足,因此只单独列出I、II、III 期和总LUAD 患者KM 生存曲线,结果显示I 和II 期高表达CEACAM1 的LUAD 患者OS 偏低(P<0.05)。而在III 期LUAD 患者中OS 差异无统计学意义(P>0.05)。见图3。
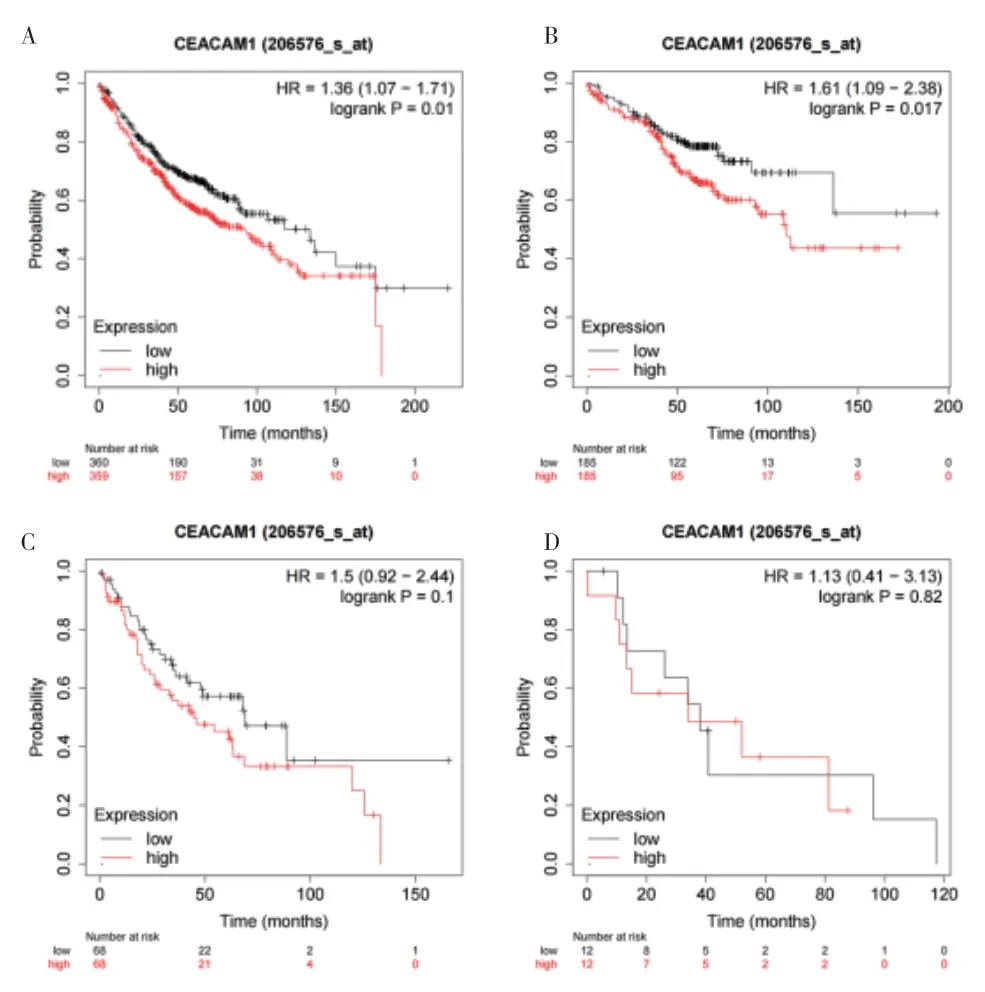
图3 LUAD中CEACAM1高低表达组KM生存曲线分析
2.5 免疫浸润相关性分析 CEACAM1 与aDC、B 细胞、嗜酸性粒细胞、iDC、T 细胞、TFH、Th1 细胞和Treg 细胞存在正相关(P<0.05),相关系数分别为0.192、0.109、0.124、0.087、0.146、0.288、0.089 和0.156,见图4。

图4 CEACAM1与肿瘤浸润免疫细胞相关性分析
2.6 CEACAM1 与免疫检查点共表达分析 CEACAM1与SIGLEC15、TIGIT、CD274、HAVCR2、PDCD1、CTLA4和LAG3 共表达情况存在正相关(P<0.05),Spearman相关系数分别为0.141、0.166、0.092、0.108、0.149、0.163 和0.147,见图5。
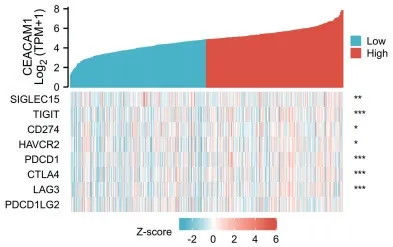
图5 CEACAM1与免疫检查点分子共表达情况
2.7 通路富集分析 通过GSEA 通路富集分析,发现CEACAM1 与Rho GTP 酶信号传导、M 期有丝分裂、NABA 分泌因子、DNA 修复以及氨基酸及其衍生物的代谢通路相关。见图6。
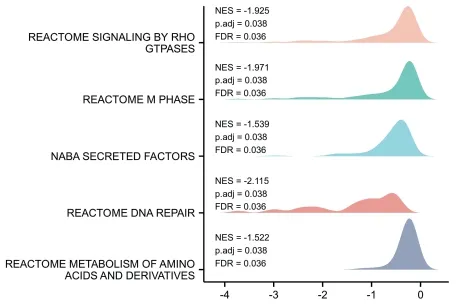
图6 GSEA通路富集分析
3 讨论
LUAD 作为肺癌的主要病理类型,虽然恶性程度不高,发展进程比较缓慢,但存在微转移灶,即使肺部病灶较小时也会发生血道转移以及淋巴转移,大多数患者被诊断时,病情已经发展至中晚期,并且可能已经扩散到全身各处[7]。随着CEACAM 家族研究的深入,CEACAM1 在各种癌症中的研究也日益增多,比如结肠癌、乳腺癌、前列腺癌、膀胱癌、胰腺癌、甲状腺癌以及黑色素瘤等[8-9]。在NSCLC 中,与健康者比较,CEACAM1 基因表达上调[10]。CEACAM1 可以通过改变细胞间的黏附能力,细胞间空隙增大使得肿瘤细胞侵袭进入组织器官,导致肿瘤侵袭和转移;通过促进VEGF的表达,使机体生成新生血管及淋巴管从而促进肿瘤转移[11]。有研究表明,在NSCLC 患者血清中,存在CEACAM1 水平升高,且表达水平和TGF-β、VEGF-A、IL-8 密切相关,提示CEACAM1 可以预测肺癌发生、进展以及预后,并有可能为肺癌治疗提供靶点[12]。另外,CEACAM1 免疫抑制剂(MG1124)在NSCLC PDX人源化小鼠模型中,MG1124 作为单一疗法可以抑制肺癌的生长,在NSCLC huPDX 模型中显示出与派姆单抗的协同抗癌活性。CEACAM1 作为近年新发现的免疫检查点,可以与TIM-3 相互作用抑制T 细胞抗肿瘤作用,使肿瘤细胞逃避免疫监视[13]。
本研究结果显示,与癌旁组织比较,LUAD 患者肿瘤组织中CEACAM1 mRNA 高表达。在一项CEACAM1和NSCLC 研究中,肿瘤组织中CEACAM1 高表达,表明CEACAM1 与NSCLC 存在关联[14]。通过KM 生存曲线分析,发现CEACAM1 高表达的早期LUAD 患者中OS偏低,推测CEACAM1 有可能是早期LUAD 不良预后指标。CEACAM1 作为免疫检查点,能够在免疫细胞上表达,从而调节免疫细胞激活程度,而免疫细胞的状态和患者的预后也密切相关,分析LUAD 患者CEACAM1与肿瘤浸润的免疫细胞相关性,结果显示CEACAM1 与多种免疫细胞呈正相关(P<0.05),其中与TFH 细胞相关性最显著。有研究表明,NSCLC 患者TFH 细胞上不仅存在PD1 高表达,也存在TFH 功能异常,功能异常可以进一步抑制免疫功能,抢救TFH 的功能可以作为NSCLC 患者潜在的治疗策略[15]。研究证实LUAD 中CEACAM1 与TFH 浸润呈正相关,高表达的CEACAM1也同样会抑制TFH 细胞功能,通过靶向抑制CEACAM1也有可能帮助恢复TFH 功能,从而也能对LUAD 患者起到治疗作用。CEACAM1 作为免疫检查点,可以与其他免疫检查点互相作用,如与TIM-3 结合对免疫细胞进行调控[15]。分析CEACAM1 与其他八种免疫检查点分子共表达情况,结果显示CEACAM1 与SIGLEC15、TIGIT、CD274、HAVCR2、PDCD1、CTLA4 和LAG3 共表达情况存在正相关(P<0.05),提示可以联合多个免疫检查点抑制剂作为LUAD 治疗的新策略。根据肿瘤组织中CEACAM1 表达水平分为高低表达组,两组中存在显著差异的基因,通过GSEA 通路富集分析,发现CEACAM1 与Rho GTP 酶信号传导、M 期有丝分裂、NABA 分泌因子、DNA 修复以及氨基酸及其衍生物的代谢通路相关。Rho GTP 酶属于Ras 超家族,参与细胞迁移、吞噬、收缩和黏附,Rho/ROCK 信号通路可以诱导细胞骨架重建、导致内皮细胞通透性改变,与肿瘤的发生密切相关[16]。细胞分裂周期M 期通路,也有研究表明CDC 25C 可以预测LUAD 的不良预后,并可能在细胞周期调节和FAS 介导的细胞凋亡中发挥作用,其中CDC25C 参与G2/M 期转变的调节[17]。DNA 修复也与肿瘤密切相关,当修复系统存在延长,可能导致肿瘤发生。尚斌通过实验发现过表达Ku80 基因可以增加LUAD 细胞增殖、运动、迁移以及侵袭能力,其中Ku80基因是DNA 修复基因[18]。在多种肿瘤,如乳腺癌患者血清中存在氨基酸代谢图谱的改变[19]。根据基因富集分析,发现CEACAM1 参与的信号通路与肿瘤的发生密切相关,因此靶向CEACAM1 有可能阻止肿瘤的发生。综上所述,LUAD 的肿瘤组织中CEACAM1 高表达,且与肿瘤组织浸润的多种免疫细胞呈正相关。CEACAM1作为免疫检查点,在免疫细胞上高表达,可以抑制免疫细胞抗肿瘤功能,导致肿瘤细胞逃避免疫监视。另外,在LUAD 中,CEACAM1 可以和多种免疫检查点共表达,可能对免疫抑制起到协同作用。

