人参皂苷Rg1介导HSPA8自噬途径改善帕金森小鼠黑质神经元损伤
陈金友 高越
帕金森病(PD)是一种临床常见的神经系统退行性疾病,由脑部黑质致密部纹状体多巴胺(DA)能神经元发生进行性变性引起,主要的症状表现为静止性震颤、运动迟缓、姿势步态异常等,临床上较常用左旋多巴以外源性方式补充脑内DA 以缓解症状[1]。目前,自噬缺陷被认为是引起PD 中α-Synuclein 等异常蛋白质积累,加剧神经元损伤的重要因素[2]。热休克蛋白A8(HSPA8)组成性表达于细胞胞质内,具有介导细胞自噬作用[3]。人参皂苷Rg1 是人参的活性成分,可调节神经递质的释放和脑内蛋白质合成,具有神经保护作用[4]。研究证实,人参皂苷Rg1 对PD 小鼠黑质内聚集的α-Synuclein 具有降解作用[5]。因此,本研究通过建立PD 小鼠模型,探讨人参皂苷Rg1 介导HSPA8 自噬途径对DA 小鼠的神经元保护作用,以明确人参皂苷Rg1 治疗PD 的可能作用机制。
1 材料与方法
1.1 材料 (1)动物:48 只健康雄性C57BL/6J 小鼠,8~10 周龄,体质量(25±5)g,购于北京维通利华公司[许可证号:SCXK(京)2016-0006)]。正常饲养环境下饲养于浙江鹰旸生物科技有限公司[许可证号:SYXK(浙)2021-0033)]。所用动物实验方法与处理措施均由浙江鹰旸医药研发有限公司实验动物伦理委员会批准并执行。(2)主要实验试剂:人参皂苷Rg1、VER-155008F(HSPA8 抑制剂)购于麦克林(货号:G909436、C872629);1-甲基-4 苯基-1,2,3,6-四氢吡啶(MPTP)购于上海源叶生物科技有限公司(货号:S31504);HSPA8、α-Synuclein、络氨酸氢化酶(TH)、p62 抗体购于美国Proteintech 公司(货号:10654-1-AP、10842-1-AP、25859-1-AP、18420-1-AP);α-Synuclein、HSPA8、TH、LC3-I/II、p62、B淋巴细胞瘤2(Bcl-2)、半胱氨酸肽酶3(Caspase 3)、Bcl-2 关联X(Bax)蛋白抗体购于美国Affinity 公司(货号:AF0402、AF5187、AF6113、AF5402、AF5384、AF6139、AF6311、AF0120);Tunel 试剂盒购于北京索莱宝公司(货号:G1501);Nissl 染色试剂盒购于武汉谷歌生物公司(货号:G1036)。(3)主要实验设备:小鼠转棒实验仪购于SANS 公司;小鼠旷场实验轨迹分析仪购于上海欣软公司;化学发光仪购于上海勤翔公司;荧光显微镜购于日本尼康公司。
1.2 方法 (1)PD 小鼠模型建立:按照文献报道的方法对小鼠进行造模[6]。30 mg MPTP 溶于10 mL 0.9%氯化钠溶液中,腹腔注射30 mg/kg MPTP 对小鼠进行PD造模,连续注射7 d,NC 组小鼠腹腔注射10 mL/kg 0.9%氯化钠溶液代替。(2)分组及给药:小鼠随机分为对照组(NC 组)、PD 组、Rg1-1 组(1 mg/kg Rg1)、Rg1-5组(5 mg/kg Rg1)、Rg1-10 组(10 mg/kg Rg1)、Rg1-20组(20 mg/kg Rg1)、Rg1-40 组(40 mg/kg Rg1)、Rg1-40+VER-155008 组(40 mg/kg Rg1+89.9 µmol/kg VER-155008),每组各6 只。NC 和PD 组灌胃等量0.9%氯化钠溶液,各药物组小鼠每天灌胃相应剂量Rg1,Rg1-40+VER-155008 组另需腹腔注射VER-155008,1 次/d,连续10 d。(3)小鼠行为学观察实验:准备小鼠转棒实验仪、爬杆和实验箱子。测定小鼠在转棒上的停留时间和完成爬杆的所需时间,小鼠旷场实验轨迹分析仪安装于实验箱内记录小鼠在箱子的行动轨迹,记录小鼠实验内穿越中间区域次数和运动路程数,评价小鼠整体运动行为能力。实验前3 d 让小鼠熟悉实验流程和箱子环境,不同小鼠测试前需用75%乙醇消除气味以免造成实验干扰。(4)小鼠脑黑质Nissl 染色:制备石蜡切片。常规脱蜡至水。Nissl 染色液均匀覆盖切片,放入预热后烤箱内染色孵育20 min,清洗,烤箱烘干,二甲苯透明,中性树胶封固。(5)小鼠脑黑质免疫组化染色:石蜡切片常规脱蜡至水,修复。封闭后加入HSPA8、α-Synuclein 抗体孵育过夜。标记的二抗孵育50 min。清洗,显色5 min,复染细胞核,常规脱水封片,镜检。阳性表达呈棕黄色。(6)小鼠脑黑质免疫荧光检测:石蜡切片常规脱蜡至水,修复。P62、TH、LC3 抗体孵育,封闭30 min,吸弃多余液体,加入标记的二抗,避光孵育50 min。摇床脱色清洗3 次,DAPI染液避光染10 min,PBS 清洗3 遍。封片,荧光显微镜下观察。(7)小鼠脑黑质Tunel 染色:石蜡切片常规脱蜡至水,修复。Tunel 染液均匀覆盖切片,37℃水浴孵育。清洗,DAPI 室温下复染10 min,摇床清洗,封片,镜检拍照发荧光的Tnnel 阳性细胞。(8)Western blot 检测小鼠脑黑质相应蛋白表达:小鼠黑质组织制备为匀浆,离心提取蛋白,测定蛋白浓度。聚丙烯酰胺凝胶电泳蛋白,转膜。5%脱脂奶粉封闭1.5 h,清洗,孵育α-Synuclein、HSPA8、TH、caspase-3、Bax、Bcl-2、LC3-II、LC3-I、P62 稀释的一抗抗体,4℃摇床振荡过夜。清洗,封闭后二抗孵育。ECL 化学发光仪显影,测定蛋白相对表达量。
1.3 统计学分析 采用SPSS 统计软件。符合正态分布计量资料以(±s)表示,多组间比较采用单因素方差分析,进一步组间两两比较采用Tukey 检验。偏态分布则采用Kruskal-Wallis H 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠行为表现 与NC 组比较,PD 组小鼠转棒停留时间显著缩短、完成爬杆所需时间显著延长、穿越箱子中间区域次数及总路程显著减少,整体运动行为能力降低(P<0.01)。与PD 组比较,不同剂量Rg1 组的小鼠的整体运动行为能力增强,以Rg1-40 组小鼠的整体运动能力改善最为显著(P<0.05)。而与Rg1-40 组比较,Rg1-40+VER155008 组小鼠的整体行为运动能力显著下降(P<0.01)。见表1。
表1 小鼠行为学变化情况[(±s),n=6]
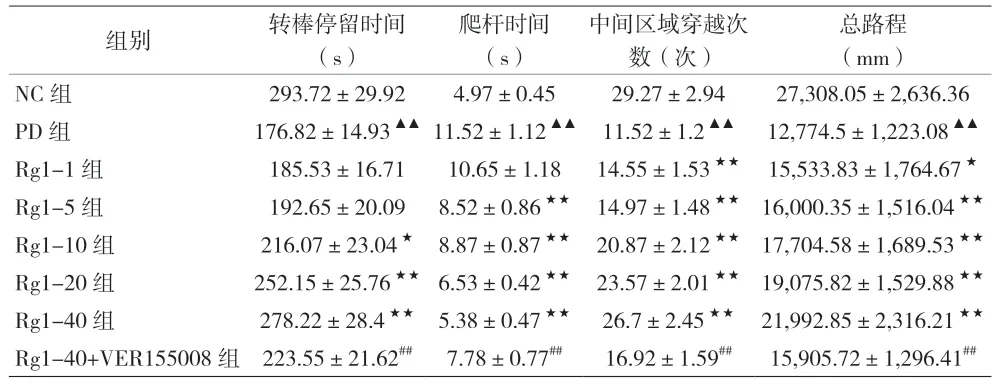
表1 小鼠行为学变化情况[(±s),n=6]
注:与NC 组比较,▲▲P<0.01;与PD 组比较,★P<0.05,★★P<0.01;与Rg1-40 组比较,##P<0.01
组别 转棒停留时间(s)爬杆时间(s)中间区域穿越次数(次)总路程(mm)NC 组 293.72±29.92 4.97±0.45 29.27±2.94 27,308.05±2,636.36 PD 组 176.82±14.93▲▲11.52±1.12▲▲ 11.52±1.2▲▲ 12,774.5±1,223.08▲▲Rg1-1 组 185.53±16.71 10.65±1.18 14.55±1.53★★ 15,533.83±1,764.67★Rg1-5 组 192.65±20.09 8.52±0.86★★ 14.97±1.48★★ 16,000.35±1,516.04★★Rg1-10 组 216.07±23.04★ 8.87±0.87★★ 20.87±2.12★★ 17,704.58±1,689.53★★Rg1-20 组 252.15±25.76★★ 6.53±0.42★★ 23.57±2.01★★ 19,075.82±1,529.88★★Rg1-40 组 278.22±28.4★★ 5.38±0.47★★ 26.7±2.45★★ 21,992.85±2,316.21★★Rg1-40+VER155008 组 223.55±21.62## 7.78±0.77## 16.92±1.59## 15,905.72±1,296.41##
2.2 各组小鼠脑组织Nissl 染色结果 NC 组小鼠黑质神经元细胞核仁明显,可见淡蓝色的尼氏小体出现于胞浆。与NC 组比较,PD 组小鼠神经元细胞皱缩,尼氏小体数量减少,核仁小时。与PD 组比较,不同剂量Rg1 组的神经元细胞形态改善,尼氏小体数量增加;与Rg1-40 组相比,Rg1-40+VER155008 组小鼠经元细胞胞浆加深,尼氏小体减少,见图1。
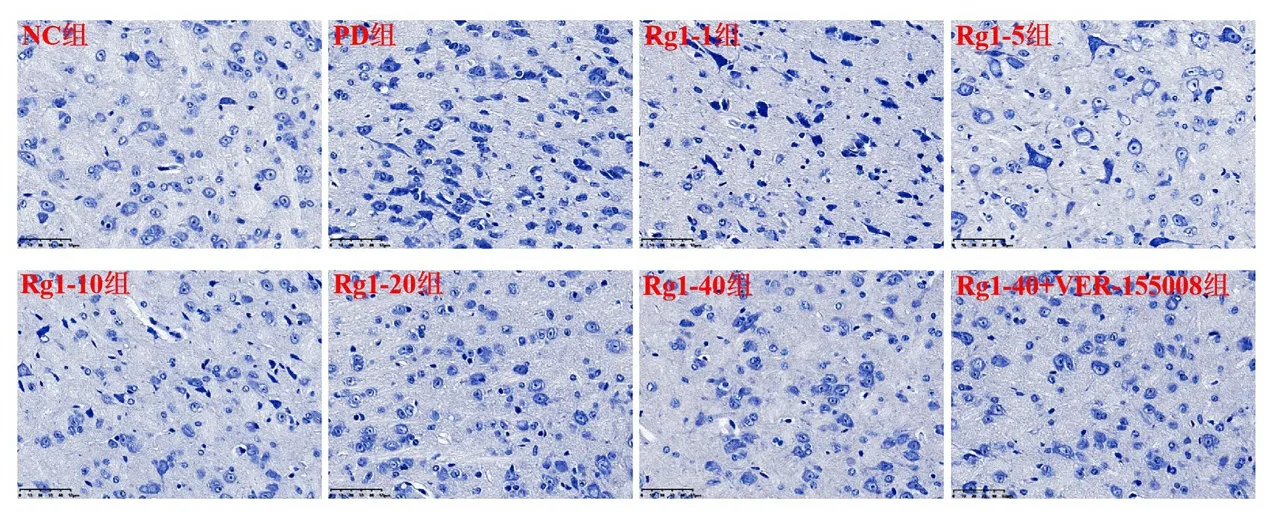
图1 各组小鼠神经元细胞病理改变(Nissl染色×400)
2.3 各组小鼠脑组织α-Synuclein、HSPA8 含量 与NC 组比较,PD 组小鼠脑组织中α-Synuclein 含量增加,HSPA8 含量降低(P<0.01)。与PD 组比较,Rg1-10、Rg1-20、Rg1-40 组小鼠黑质内α-Synuclein 含量降低,HSPA8 含量增加(P<0.01)。与Rg1-40 组相比,Rg1-40+VER155008 组小鼠黑质组织α-Synuclein 含量增加,HSPA8 含量降低(P<0.05),见图2、表2。
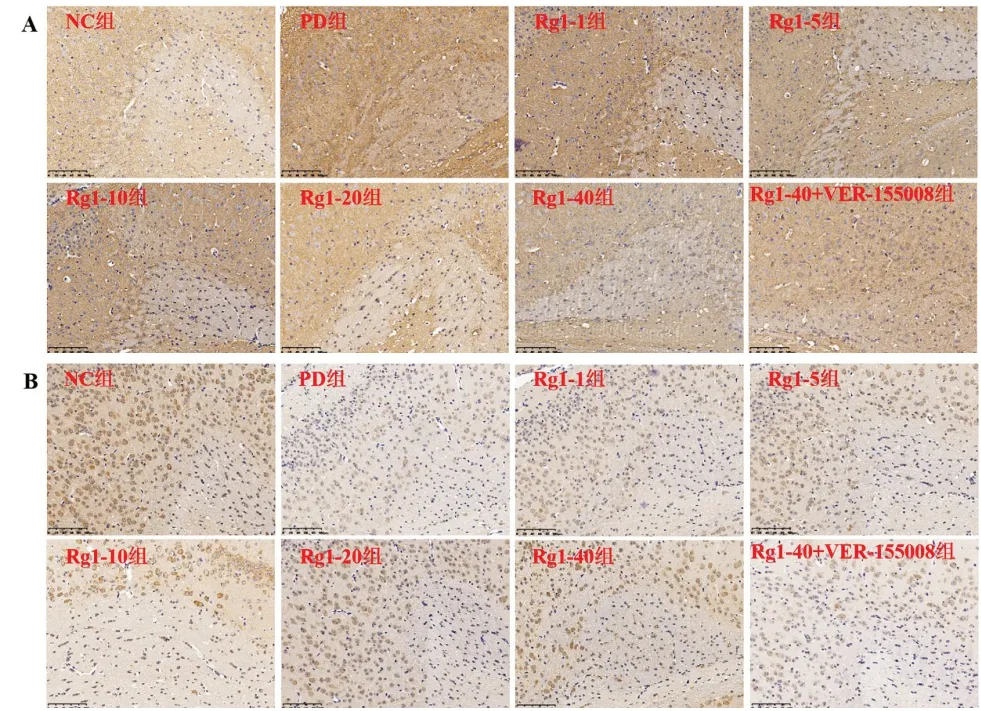
图2 小鼠脑组织α-Synuclein、HSPA8表达(免疫组化×200)
表2 各组小鼠脑组织α-Synuclein、HSPA8表达比较[(±s),n=6]

表2 各组小鼠脑组织α-Synuclein、HSPA8表达比较[(±s),n=6]
注:与NC 组比较,▲▲P<0.01;与PD 组比较,★P<0.05,★★P<0.01;与Rg1-40 组比较,#P<0.05,##P<0.01
指标 NC 组 PD 组 Rg1-1 组 Rg1-5 组 Rg1-10 组 Rg1-20 组 Rg1-40 组 Rg1-40+VER155008 组α-Synuclein 0.13±0.01 0.25±0.02▲▲ 0.23±0.02 0.22±0.02 0.19±0.02★★ 0.18±0.02★★ 0.16±0.02★★ 0.19±0.02#HSPA8 0.25±0.03 0.13±0.01▲▲ 0.14±0.01 0.14±0.02 0.17±0.02★★ 0.19±0.02★★ 0.21±0.03★★ 0.18±0.02#
2.4 各组小鼠脑组织p62、TH、LC3 含量 与NC 组比较,PD 组小鼠黑质内p62 含量增加,TH、LC3 含量降低(P<0.01)。与PD 组比较,不同剂量Rg1 组小鼠黑质内p62 含量降低、LC3、TH 含量增加(P<0.05)。与Rg1-40 组比较,Rg1-40+VER155008 组小鼠黑质内p62 含量增加,TH、LC3 含量降低(P<0.05),见表3、图3。
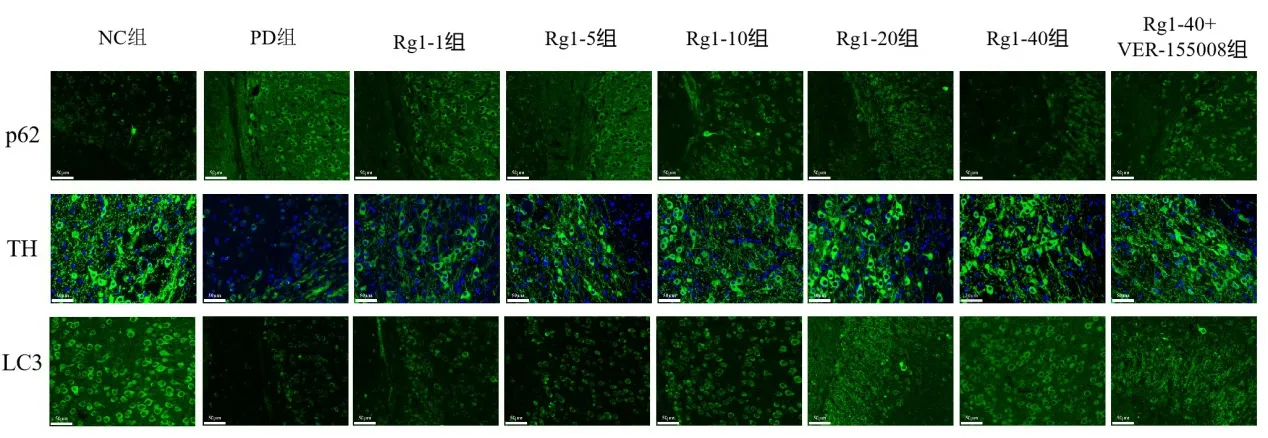
图3 各组小鼠脑组织p62、TH、LC3荧光表达(免疫荧光×400)
表3 各组小鼠脑组织p62、TH、LC3表达比较[(±s),n=6]

表3 各组小鼠脑组织p62、TH、LC3表达比较[(±s),n=6]
注:与NC 组比较,▲▲P<0.01;与PD 组比较,★P<0.05,★★P<0.01;与Rg1-40 组比较,#P<0.05,##P<0.01
指标 NC 组 PD 组 Rg1-1 组 Rg1-5 组 Rg1-10 组 Rg1-20 组 Rg1-40 组 Rg1-40+VER155008 组p62 20.34±2.16 35.6±2.91▲▲ 32.42±3.42 29.46±1.34 5.27 37.86±3.91▲▲ 39.57±2.22 41.77±3.6★★ 25.09±1.85★★ 24.1±1.79★★ 21.75±1.83★★ 24.49±1.73#TH 56.99±1 43.92±4.29★ 48.53±5.08★★ 53.56±3.23★★ 46.93±4.26#LC3 43.61±3.25 20.91±2.32▲▲ 22.26±2.00 27.28±1.58★★ 30.54±2.39★★ 31.44±4.00★★ 32.65±2.06★★ 27.62±1.86##
2.5 各组小鼠脑组织细胞凋亡情况 与NC组比较,PD组小鼠黑质神经元细胞凋亡显著增加(P<0.01)。与PD组比较,Rg1-5、Rg1-10、Rg1-20、Rg1-40 组小鼠黑质神经元细胞凋亡减少(P<0.01)。与Rg1-40 组比较,Rg1-40+VER155008 组小鼠黑质神经元细胞凋亡增加(P<0.01),见表4、图4。
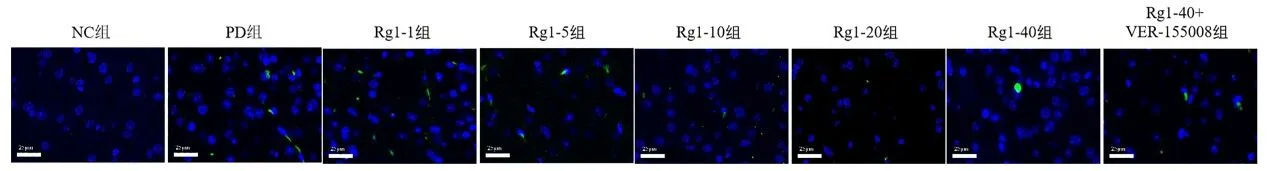
图4 各组小鼠脑组织凋亡小体染色结果(Tunel染色×400)
表4 各组小鼠黑质神经元细胞凋亡比较[(±s),n=6]

表4 各组小鼠黑质神经元细胞凋亡比较[(±s),n=6]
注:与NC 组比较,▲▲P<0.01;与PD 组比较,★★P<0.01;与Rg1-40 组比较,##P<0.01
组别 Tunel 阳性(%)NC 组 2.58±0.23 PD 组 26.83±2.40▲▲24.13±2.41 17.58±2.49★★组 15.74±1.32★★Rg1-1 组Rg1-5 组Rg1-10 Rg1-20 组 13.86±3.43★★Rg1-40 组 12.25±1.18★★Rg1-40+VER155008 组 15.83±2.01##
2.6 各组小鼠脑组织测定蛋白表达情况 与NC 组比较,PD 组小鼠黑质内α-Synuclein、Caspase-3、Bax、p62 蛋白表达显著增加,HSPA8、TH、Bcl-2、LC3-II/LC3-I 蛋白表达显著降低(P<0.01)。与PD 组比较,不同剂量Rg1 组小鼠黑质内α-Synuclein、Bax、p62、caspase-3 蛋白表达降低,HSPA8、TH、Bcl-2、LC3-II/LC3-I 蛋白表达增加(P<0.05)。与Rg1-40 组比较,Rg1-40+VER155008 组小鼠黑质内α-Synuclein、Caspase-3、Bax、p62 蛋白表达显著增加,HSPA8、TH、Bcl-2、LC3-II/LC3-I 蛋白表达显著降低(P<0.05)。见图5。
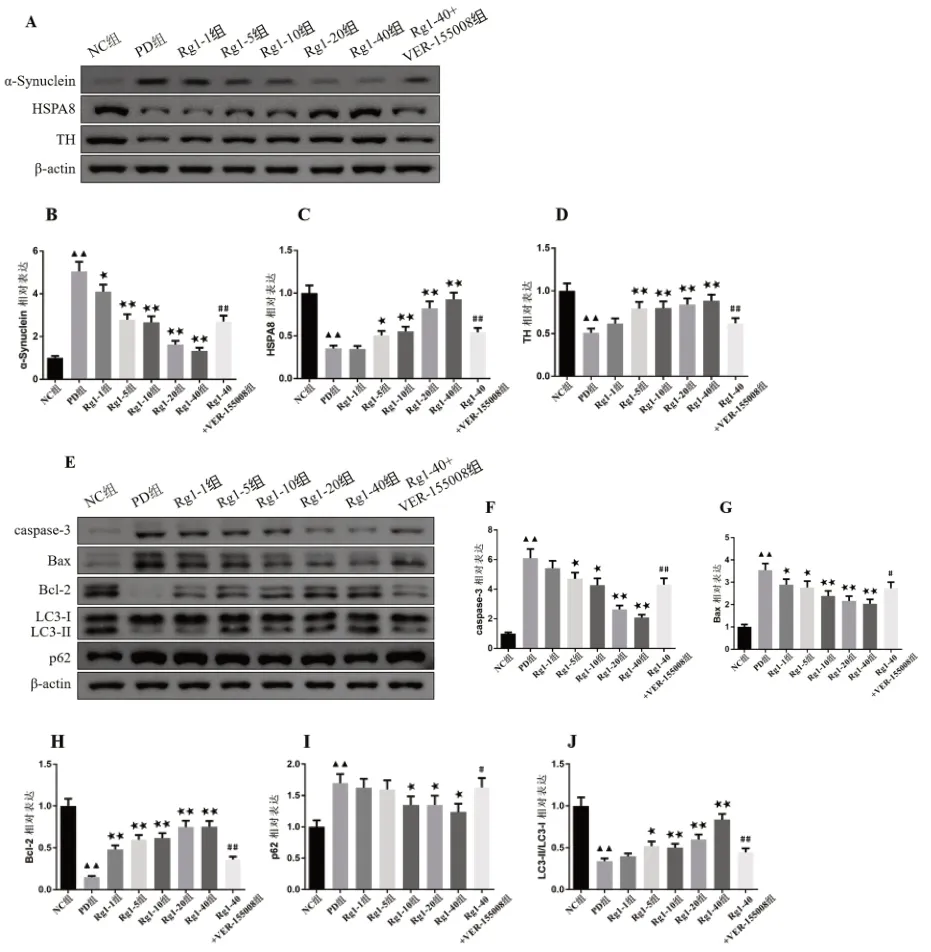
图5 各组小鼠黑质组织内检测蛋白表达比较
3 讨论
PD 的主要病理改变为α-Synuclein 错误折叠形成聚集体,并在神经元细胞间不断传播加重神经元损伤,导致PD 的发生与进展[7]。自噬为细胞清除过多异常蛋白以维持细胞正常功能所必需,自噬阻滞与激活能够相应增加和减少致病性α-Synuclein 的聚集[2]。研究表明,携带自噬基因变异的PD 患者的神经元细胞内的自噬活性降低,对α-Synuclein 蛋白的清除应答也相应降低[8]。LC3-I 通过脂化为LC3-II 作为选择性自噬受体为细胞启动自噬程序的关键,LC3-II/LC3-I、p62 蛋白可作为细胞自噬活性的生物标志[8-9]。周鸿雁等[10]消除线粒体复合物I 抑制剂鱼藤酮对线粒体的抑制作用后,DA 模型细胞LC3-II 表达增加、p62 表达降低,同时促凋亡Bax 蛋白表达下降、抑凋亡Bcl-2 蛋白表达增加,提示自噬活性增强对DA 细胞模型具有保护作用。李和梅等[11]发现人参皂苷Rg1 干预Aβ 损伤的神经细胞后,细胞的LC3-II/LC3-I 蛋白表达上调,线粒体膜电位水平上升,细胞活力增加,提示人参皂苷Rg1 可介导自噬途径减少神经细胞的毒性损伤。
自噬的调控机制复杂,而HSPA8 是介导细胞线粒体自噬途径的主要载体[3]。研究显示,鱼藤酮暴露可下调PD 细胞模型中HSPA8 表达,导致α-Synuclein 蛋白异常聚集,增加神经元细胞毒性[12]。LH 为DA 的合成限速酶,脑组织内其低表达与PD 发生和发展相关[13]。本研究结果显示,PD 小鼠整体行为运动能力下降,脑组织内HSPA8、TH 蛋白含量表达下调,自噬相关蛋白LC3-II/LC3-I 蛋白表达降低、p62 蛋白表达增加,而α-Synuclein 蛋白含量表达增加,神经元细胞尼氏小体数量下降、凋亡增加,相应促凋亡Caspase-3、Bax 蛋白表达显著增强、抑凋亡Bcl-2 蛋白表达降低,表明PD小鼠DA 神经元自噬活性降低、神经元细胞损伤严重。而不同剂量人参皂苷Rg1 单独干预后,PD 小鼠整体行为运动能力明显改善,神经元尼氏小体数量增加、凋亡减少,黑质组织内HSPA8、TH、Bcl-2、LC3-II/LC3-I蛋白表达上调,α-Synuclein、Caspase-3、Bax 蛋白表达下降,表明人参皂苷Rg1 对可上调PD 小鼠黑质神经元自噬活性,具有神经保护作用。而当HSPA8 被抑制后,40 mg/kg 人参皂苷Rg1 对PD 小鼠的行为运动能力的改善作用下降,脑组织内α-Synuclein 蛋白表达增加,神经元细胞尼氏小体数量减少、凋亡增加,LC3-II/LC3-I、TH、Bcl-2 蛋白表达下降,p62、Caspase-3、和Bax 蛋白表达增加,推测人参皂苷Rg1 可能介导HSPA8 自噬途径增强DA 神经元细胞自噬活性,发挥对PD 小鼠的神经保护作用。
综上所述,本研究表明HSPA8 在PD 小鼠黑质神经元细胞内低表达与神经损伤有关,而人参皂苷Rg1 可介导HSPA8 的自噬途径减少神经元细胞损伤,从而起到PD 小鼠的神经保护作用。

