miRNA-126调控自噬减轻高糖诱导血管内皮细胞损伤的作用机制
郑伟英 刘心雨 刘俊汝 李萌 包慧兰 楼时先 金启辉
糖尿病最大死因来源于高糖(HG)导致血管病变继发的心脑肾等主要并发症,多数糖尿病患者死于糖尿病血管并发症,且随病程延长和血糖控制的不理想,糖尿病患者重大血管病变的发生率逐年提高[1]。MicroRNA(miRNA)是一类小分子、非编码RNA,通过诱导特异性RNA 表达或抑制调控细胞分化、增殖等细胞生物学变化,参与多种疾病的发生和发展[2]。研究显示miRNA-126 是一种血管内皮特异性miRNA,被认为与心血管疾病密切相关,参与调控血管病变的多种病理生理过程,是调控血管病变的重要因子,是维持血管正常结构的重要因素[3-4]。这些研究结果提示,miRNA-126 在诸多血管病变中发挥保护作用,但其作用机制复杂,每种疾病状态下的病理机制并不明确。本研究探讨miRNA-126 的表达对HG 诱导内皮细胞损伤的保护作用及其可能机制,为进一步研究糖尿病血管病变发生机制提供实验依据和可能的治疗方案。
1 材料与方法
1.1 细胞株和主要试剂 原代HUVECs 细胞株购自美国Clonetics 公司。胎牛血清(FBS)和低糖DMEM 培养基(杭州吉诺生物医药);葡萄糖粉(Sigma);Beclin 1 抗体(Abacm);Bax、Bcl-2(CST),Cleaved-caspase 3;Western blot 相关试剂(Sigma);ERK 通路抑制剂U-0126、3-甲基腺嘌呤(3-methyladenine,3-MA),AKT、pAKT、ERK、pERK、微管相关蛋白1 轻链3(microtubule-associated protein 1 light chain 3,LC3)II/I(CST);CCK-8 试剂盒、RT-qPCR 试剂盒(碧云天)。
1.2 HUVECs 培养及处理 HUVECs 用含5%的胎牛血清的DMEM 培养基在37.0℃、饱和适度、5%CO2的培养箱中常规培养。以无菌PBS 洗涤细胞后,加入0.25%的胰酶(含EDTA)消化传代,用ECM 培养基重悬,调整细胞密度至5×104/mL,接种于培养板中,充分贴壁后,去血清预处理12 h 后,用于实验。
1.3 细胞分组 (1)HG 模型组的建立:对数生长期的HUVECs,将终浓度为33.3 mmol/L 的葡萄糖(加入培养基后的浓度为33.3 mmol/L)加入培养基中培养24 h。构建miRNA-126 过表达腺病毒,然后转染HUVECs使miRNA-126 在内皮细胞中的表达明显升高。进一步RT-qPCR证实miRNA-126腺病毒成功转染内皮细胞并提高HUVECs 中miRNA-126 的水平。采用miRNA-126 inhibitor 转染HUVECs 使内源性miRNA-126 表达下调。(2)细胞分组:细胞分为4 组,即5.5 mmol/L 正常对照组(CR 组),33.3 mmol/L 高糖模型组(HG 组),miRNA-126-5p mimics 组(转染miRNA-126 Mimics 组)(MM 组),miRNA-126-5p inhibitor 组(转染miRNA-126 Inhibitor 组)(MI 组)。CR 组,培养24 h 后,再将浓度为5.5 mmol/L(终浓度)的葡萄糖加入培养基中培养24 h;HG 组,培养24 h 后,再将浓度为33.3 mmol/L(终浓度)的HG 加入培养基中培养24 h;MM 组是miRNA-126-5p mimics 转染至HUVECs 细胞,成功后48 h 在培养基中加入33.3 mmol/L(终浓度)的葡萄糖,培养24 h;MI 组是miRNA-126-5p inhibitor 转染至HUVECs细胞,成功后48 h 在培养基中加入33.3 mmol/L(终浓度)的葡萄糖,培养24 h。采用miRNA-126-5p mimics组模型,分别予自噬抑制剂3-甲基腺嘌呤(3-methyl adenine,3-MA)5 mmol/L、ERK 通路抑制剂(U-0126)10 mmol/L 干预24 h。观察凋亡和自噬情况。
1.4 RT-qPCR 对细胞中miRNA-126 水平的检测 分别提取4 组细胞的总RNA,Trizol Reagent 裂解细胞后,将裂解后的细胞吸1.5 mL Ep 管中,先后加入三氯甲烷,异丙醇及75%乙醇提取RNA,弃上清液,室温干燥5~10 min 后,采用无RNA 酶水溶解RNA;将提取的RNA 逆转录为cDNA,以cDNA 为模板,应用qRT-PCR检测试剂盒进行PCR 扩增反应,PCR 反应按照说明书采用两步法进行,最后对获取的相应数据实施定量分析。
1.5 CCK-8 检测细胞增殖能力 将HUVECs 细胞按照每孔1×104的密度接种于96 孔板,按照细胞分组进行干预后,每孔加入10 µL 的CCK-8 试剂,培养箱继续孵育2 h,酶标仪检测450 nm 波长处各孔的吸光度(A)值,按公式换算为细胞相对活力。
1.6 细胞划痕实验 对数生长期的HUVECs 细胞,接种培养板,细胞生长至汇合度达到>95%时准备划痕。用10 µL 枪头垂直沿着无菌直尺划痕。按规范操作,用PBS 洗涤处理孔3 次,洗去划下来的细胞,并拍照记录(0 h)。各组置于CO2体积分数为5%、温度为37 ℃的恒温培养箱中培养24 h 后拍照。应用ImageJ 软件计算细胞愈合率=[1-(S24 h/S0 h)]×100%。(S 表示划痕面积)。
1.7 Western blot 检测蛋白表达 收集各组细胞,分别加入120 µL 细胞裂解液,置于冰上裂解10 min,收集细胞悬液于4 ℃、12,000 r/min 离心30 min,取上清液。BCA 工作法进行蛋白定量,以40 µg 总蛋白上样然后进行SDS-PAGE,后将蛋白转移至PVDF 膜上,以含5%脱脂奶粉的TBST 封闭90 min。分别将各种不同抗体用I 抗稀释液,按照说明书上的比例稀释后与PVDF 膜置于4 ℃摇床孵育过夜,次日用TBST 洗膜3 遍后再与II抗(1 ∶4,000)室温孵育60 min,TBST 洗膜3 遍,ECL发光成像,β-actin 作为内参照,用Image Lab 图像分析软件对样本每一个条带的灰度值进行半定量分析。
1.8 统计学方法 采用Graphpad Prism 8 软件。符合正态分布计量资料以(±s)表示,各组间比较采用单因素方差分析(one-way ANOVA),并行Bonferroni 事后检验对检验水平进行调整,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 不同条件下HUVECs 表达对miRNA-126 的影响 RT-qPcR 检测结果显示,与CR 组比较,HG 组miRNA-126 表达下降(P<0.05);与HG 组比较,MM组miRNA-126 表达升高(P<0.01),MI 组miRNA-126表达下降(P<0.05),见图1。
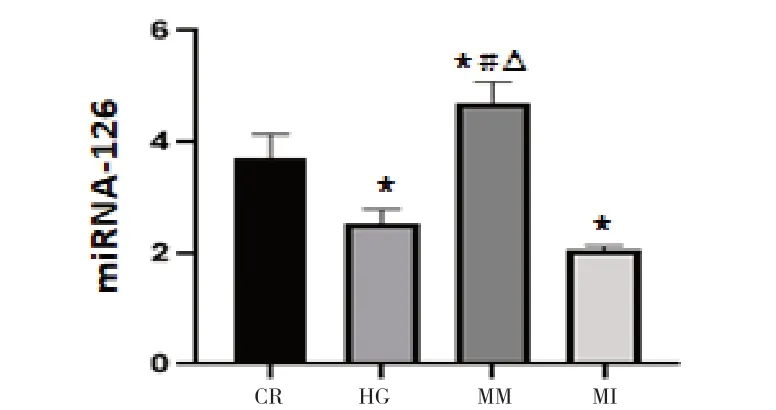
图1 miRNA-126在不同组HUVECs表达水平
2.2 miRNA-126 促进高糖诱导下HUVECs 细胞增殖作用 CCK-8 实验结果提示,HG 组与CR 组比较,细胞存活率分别是0.51±0.07 和0.71±0.08,MM 组是0.81±0.09,MI 组是0.52±0.06,与CR 组比较,HG 组和MI 组细胞存活率明显下降(P<0.05),与HG 组比较,MM 组细胞存活率明显提高(P<0.01)。见图2。
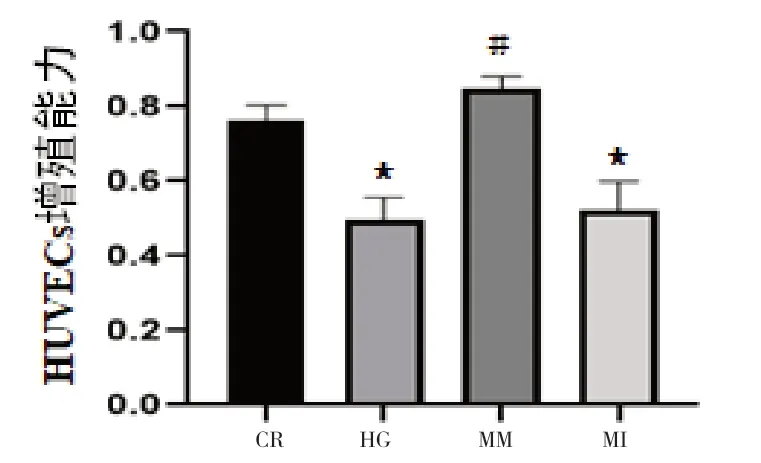
图2 miRNA-126促进高糖诱导下HUVECs细胞增殖的作用
2.3 miRNA-126 对高糖诱导下HUVECs 自噬、凋亡蛋白的影响 WB 实验结果表明,与CR 组比较,HG 组自噬相关蛋白Beclin-1,LC3 Ⅱ/Ⅰ明显下降(P<0.05),凋亡相关蛋白caspase-3、Bax/Bcl-2 明显升高(P<0.05);与HG 组比较,自噬相关蛋白Beclin-1、LC3 Ⅱ/Ⅰ明显升高(P<0.01),促凋亡相关蛋白caspase-3、Bax/Bcl-2明显下降(P<0.01)。表明miRNA-126 有促进自噬,抑制凋亡的作用,见图3。在MM 组中加入自噬抑制剂3-MA(MM+3-MA 组),发现自噬被抑制后促凋亡相关蛋白caspase-3、Bax/Bcl-2 明显升高(P<0.01)。见图4。
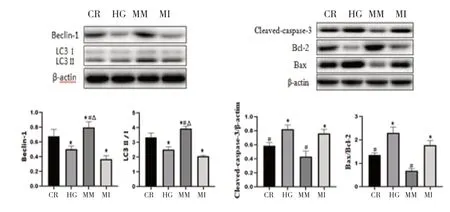
图3 miRNA-126对高糖诱导下HUVECs自噬、凋亡的影响
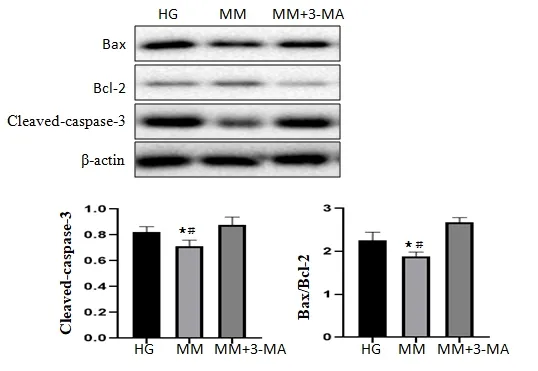
图4 抑制自噬后miRNA-126对高糖诱导下HUVECs凋亡的影响
2.4 miRNA-126 对内皮细胞迁移及VEGF、HGF 的影响 与CR 组比较,HG 组细胞愈合能力明显下降(P<0.05),与HG 组比较,MM 组细胞愈合能力明显提高(P<0.01)。表明miRNA-126 有促进细胞迁移,愈合能力提高,见图5。WB 实验测定细胞生长因子VEGF、HGF,与HG 组比较,MM 组VEGF 明显提高(P<0.05),而HGF 无明显改变,见图6。
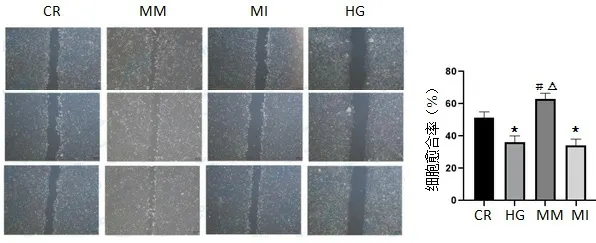
图5 miRNA-126对内皮细胞迁移的影响
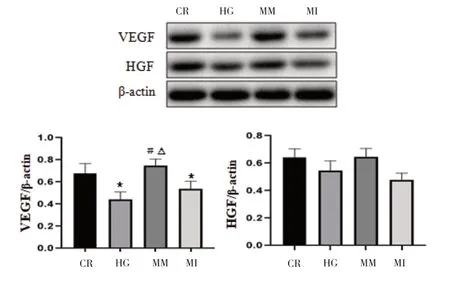
图6 miRNA-126对内皮细胞VEGF、HGF的影响
2.5 miRNA-126 对高糖诱导下HUVECs 的ERK、AKT信号通路蛋白影响 与CR 组比较,HG 组p-ERK/ERK活性明显下降(P<0.05),而p-AKT/AKT 活性无明显改变(P>0.05),与HG 组比较,MM 组p-ERK/ERK活性明显提高(P<0.05),而p-AKT/AKT 无明显改变(P>0.05)。表明miRNA-126 具有促进ERK 磷酸化作用。见图7。在MM 组中加入ERK 抑制剂U-0126,自噬蛋白Beclin-1、LC3 Ⅱ/Ⅰ表达明显下降(P<0.05),见图8。
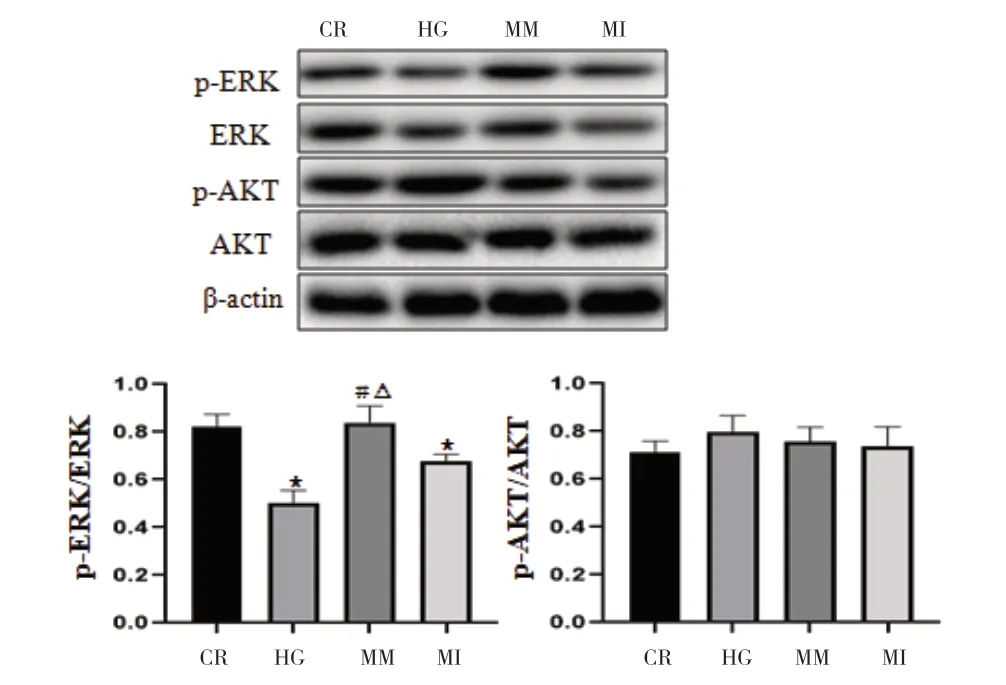
图7 miRNA-126对高糖诱导下HUVECs的ERK、AKT信号通路蛋白的影响
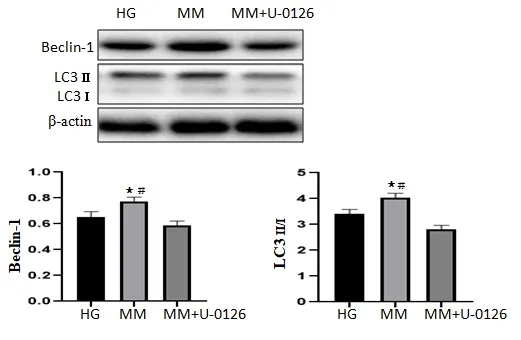
图8 抑制ERK后miRNA-126对高糖诱导下HUVECs自噬的影响
3 讨论
近年来,大量研究发现,miRNA 在糖尿病的发生发展中起重要作用[5]。多种miRNA 稳定存在血液中,其对细胞病变和组织器官疾病的发生和发展有重要作用。血管病变最重要的病理机制是血管内皮损伤,在糖尿病患者中,高糖、氧化应激、高脂血症等多种因素可直接或间接引起血管内皮细胞功能障碍。miR-126 是内皮细胞中miRNA 之一,在调节内皮细胞增殖、黏附、管腔形成等功能方面起着至关重要的作用[6]。
本研究发现,高糖环境下,HUVECs 活力下降,增殖能力减弱,促凋亡蛋白Bax/Bcl-2 水平明显升高,并最终导致Caspase-3 升高,表明高糖诱导促进内皮细胞凋亡。自噬作为细胞的保护性机制,调节内皮细胞的增殖和凋亡,在动脉硬化病变中具有重要作用[7]。本研究发现HG 组血糖高,HUVECs 自噬蛋白Beclin-1 和LC3 Ⅱ/Ⅰ下降明显,表明高糖抑制内皮细胞自噬。与以往研究结果相似[8]。
miRNA-126 作为一种内皮特异性miRNA,具有调控动脉粥样硬化的重要作用,是维持血管稳态的重要组成部分[9]。相关研究表明,miRNA-126 能通过调节各种血管生成相关的细胞因子表达,保护局部微环境的稳定,促进血管的生成,在保持血管的完整性中发挥重要作用[10]。miRNA-126 还可通过促进内皮细胞释放内皮型一氧化氮合酶(eNOS),和抑制D1k1 的表达,减轻内皮细胞的损伤,从而抑制动脉粥样硬化的发生[11-12]。表明miRNA-126在血管病变的发展进程中起重要的调控作用。本研究显示,MM 组与HG 组比较,有明显促进内皮细胞增殖的作用,可以降低Bax/Bcl-2/,抑制caspase-3 表达,减少凋亡。进一步发现miRNA-126 具有促进LC3 Ⅱ/Ⅰ、Beclin-1 蛋白表达的作用。予3-MA抑制剂后,miRNA-126 促进自噬蛋白表达作用明显被削弱,凋亡相关蛋白Bax/Bcl-2/、caspase-3 表达升高,表明miRNA-126 具有促进自噬抑制凋亡的作用机制。
AKT 和ERK 信号通路参与内皮细胞的多种生物功能,被认为是内皮细胞受损相关的关键信号通路之一[13]。本研究显示,HG 组p-ERK/ERK 抑制明显,而p-AKT/AKT 活性改变差异无统计学意义,表明高糖抑制ERK 的磷酸化,功能活性明显下降。miRNA-126 过表达的MM 组,其p-ERK/ERK 活性与HG 组比较,升高明显(P>0.05)。在MI 组,miRNA-126 被抑制后p-ERK/ERK 活性明显下降,其与HG 组比较,差异无统计学意义,表明高糖组miRNA-126 抑制明显,也证实转染细胞抑制miRNA-126 表达成功。比较AKT 的活性,发现其在四组间差异均无统计学意义,表明miRNA-126与AKT 的活性无关,与其具有促ERK 磷酸化的作用相关。进一步验证发现miRNA-126 过表达是否是通过激活ERK 通路促进自噬,予ERK 抑制剂U-0126 后,ERK活性被抑制后自噬蛋白LC3 Ⅱ/Ⅰ、Beclin-1 表达明显下降,表明miRNA-126 促进自噬是通过激活与ERK 相关的信号通路发生起作用。
综上所述,高糖可以抑制miRNA-126 的表达。miRNA-126 可以保护高糖条件下的内皮细胞存活,促进内皮细胞增殖和迁移,其机制可能与ERK 信号通路活性提高,促进自噬的发生,从而减少内皮细胞凋亡相关。今后能否通过调控miRNA-126 表达,为预防糖尿病血管病变的发生提供实验依据和思路。

