青蒿素对高果糖诱导的小鼠脂质代谢紊乱血清代谢组学研究
李梦婷 董李晋川 陈 颖 张 红 杨紫玉 杨 庆 刘 丽 闫思超 蔡维艳 李 琦 翁小刚 王娅杰 朱晓新
(中国中医科学院中药研究所,北京,100700)
随着食品工业的快速发展,在过去的40年中果糖消耗量急剧增加,高果糖玉米糖浆以其廉价、甜度高的优势常用于饮料等食品加工领域[1]。近年来研究发现富含果糖的高热量饮食方式是多种疾病产生的重要原因之一,如果糖摄入过多可导致代谢综合征和非酒精性脂肪肝,还可能会诱发高血压、痛风等疾病[2-5],出现血压升高、高密度脂蛋白水平降低、三酰甘油水平升高和高血糖等症状[6]。10%果糖水长期喂饲可导致小鼠的血糖升高、血脂代谢紊乱和葡萄糖耐受不良等异常[7],并且引起小鼠肠道微生物群组成改变,肠上皮屏障受损以及海马神经炎症反应[8]。
青蒿素是由本研究所的屠呦呦团队从菊科植物黄花蒿ArtemisiaannuaL.提取的含过氧桥的倍半萜内酯类化合物,是治疗脑型疟、恶性疟的特效药[9]。近年来,青蒿素类药物在抗肿瘤、免疫疾病、抗炎等方面表现出显著作用[10-12]。如青蒿琥酯能够具有降血脂作用,可降低患高脂血症兔的血浆胆固醇和三酰甘油[13]。蒿甲醚能够显著改善2型糖尿病小鼠体内葡萄糖稳态和胰岛素抵抗[14]。由此可见,青蒿素类药物具有改善肥胖相关代谢紊乱,调节糖脂代谢的潜能[15]。但针对青蒿素干预高果糖饮食小鼠血清代谢组学的研究未见报道。本文旨在通过研究饮食果糖小鼠及青蒿素干预后小鼠代谢物的变化,探讨青蒿素改善高果糖引起的小鼠代谢紊乱的可能作用机制。
1 材料与方法
1.1 材料
1.1.1 动物 40只2周龄断乳雄性C57BL/6J小鼠,体质量8~10 g,购自斯贝福(北京)生物技术有限公司,动物许可证号:SCXK(京)2019-0010。动物饲养于中国中医科学院中医基础理论研究所动物室SYXK(京)2016-0021,SPF环境,温度为(25±2)℃,相对湿度为(50±15)%,明暗周期12 h,自由饮水、摄食。实验动物使用遵守3R原则。动物实验部分获得中国中医科学院基础理论研究所动物伦理委员会的批准(伦理审批号:20190722058)。
1.1.2 药物 青蒿素(浙江海正药业馈赠,批号:S181121),用羧甲基纤维素钠水溶液配制为5 mg/mL溶液;二甲双胍(中美上海施贵宝制药有限公司,批号:ABG0233),用羧甲基纤维素钠水溶液配制为20 mg/mL溶液。
1.1.3 试剂与仪器 葡萄糖(Glucose,GLU)测试盒(上海荣盛生物药业有限公司,批号:20201104037),三酰甘油(Triacylglycerol,TG)测试盒(南京建成生物工程研究所,货号:A110-1-1),总胆固醇(Total Cholesterol,T-CHO)测试盒(南京建成生物工程研究所,货号:A111-1-1),低密度脂蛋白胆固醇(Low-density Lipoprotein Cholesterol,LDL-C)测试盒(南京建成生物工程研究所,货号:A113-1-1),高密度脂蛋白胆固醇(High-density Lipoprotein Cholesterol,HDL-C)测试盒(南京建成生物工程研究所,货号:A112-1-1),普通饲料(南通特洛菲饲料科技有限公司,货号:LAD0011),标准热量型35%高果糖模型饲料(南通特洛菲饲料科技有限公司,货号:TP04103),UHPLC-Q-TOF-MS/MS(AB SCIEX,美国,型号:Triple TOF 5600),高速离心机(Eppendorf,德国,型号:Centrifuge 5424R)。
1.2 方法
1.2.1 分组与模型制备 小鼠适应性饲养1周后随机分为4组,每组10只,分别饲喂标准饮食(正常组)或35%高果糖饮食(模型组、青蒿素组、二甲双胍组),正常饮水。
1.2.2 给药方法 从第9周开始,青蒿素组小鼠的给药剂量为0.1 mL/10 g,二甲双胍组小鼠的给药剂量为0.1 mL/10 g,1次/d,连续灌胃6周。在实验过程中,每周记录1次体质量。连续灌胃6周后,将小鼠禁食过夜,用戊巴比妥钠麻醉(50 mg/kg)后取血,全血在573×g下离心10 min,分离血清,储存于-80 ℃冰箱。
1.2.3 检测指标与方法
1.2.3.1 小鼠血糖 取实验小鼠血清,血糖、三酰甘油、低密度脂蛋白、高密度脂蛋白及总胆固醇浓度用标准诊断试剂盒检测。
1.2.3.2 超高效液相色谱-四极杆-飞行时间串联质谱法分析 1)血清样本处理:取实验小鼠血清样品100 L,加入400 L预冷甲醇乙腈溶液(1∶1,v/v),涡旋60 s,于-20 ℃放置1 h沉淀蛋白,在4 ℃下17 968×g离心20 min,取上清冷冻,-80 ℃保存样本。2)色谱条件:采用Agilent 1290 Infinity LC超高效液相色谱(Ultra High Performance Liquid Chromatography,UHPLC)HILIC色谱柱,流动相A:水+25 mmol/L乙酸铵+25 mmol/L氨水,流动相B:乙腈。梯度洗脱程序:0~1 min,95%B;1~14 min,95%~65%B;14~16 min,65%~40%B;16~18 min,40%B;18~18.1 min,40%~95%B;18.1~23 min,95%B。流速0.3 mL/min,柱温25 ℃。3)质谱条件:分别采用电喷雾电离(Electrospray Ionization,ESI)正离子和负离子模式进行检测,Triple TOF 5600质谱仪进行质谱分析。ESI源参数如下:雾化气(Gas1)为60 psi,辅助气(Gas2)为60 psi,气帘气(CUR)为30 psi。温度:600 ℃。喷雾电压(ISVF)±5 500 V(正负2种模式)。TOF MS扫描范围:60~1 000 Da。product ion扫描范围:25~1 000 Da。TOF MS采样速率为0.20 s/spectra,product ion采样速率为0.05 s/spectra。二级质谱采用信息相关获取(Information Dependent Acquisition,IDA)获得,并且采用High Sensitivity模式,去簇电压(Declustering Potential,DP):±60 V(正负2种模式),碰撞能:35±15 eV,IDA设置如下:Exclude Isotopes within 4 Da,Candidate Ions to Monitor per cycle:6。4)数据处理与统计:原始数据经ProteoWizard转换成.mzXML格式,然后采用XCMS程序进行峰对齐、保留时间校正和提取峰面积。代谢物结构鉴定采用精确质量数匹配(<25百万分比浓度)和二级谱图匹配的方式,检索实验室自建数据库。数据经Pareto-scaling预处理后,进行多维统计分析,包括无监督主成分分析(Unsupervised Principal Component Analysis,UPCA)和正交偏最小二乘法判别分析(Orthogonal Partial Least Squares Discriminant Analysis,OPLS-DA),OPLS-DA以VIP>1和P value<0.05为筛选标准,模型组与正常组、给药组之间进行比较。单维统计分析包括Student′s t-test和变异倍数分析。
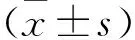
2 结果
2.1 小鼠体质量与血糖水平 实验过程中各组小鼠体质量差异无统计学意义(P>0.05)。见图1。模型组小鼠血清中葡萄糖、总胆固醇、高密度脂蛋白含量显著上升,三酰甘油含量升高;青蒿素组与模型组比较血清三酰甘油显著降低;各组之间低密度脂蛋白差异无统计学意义(P>0.05)。结果表明,模型组小鼠出现糖脂代谢紊乱,表现为高血糖及高三酰甘油血症,青蒿素显著改善了模型小鼠血清的三酰甘油水平。见图2。

图1 各组小鼠体质量变化
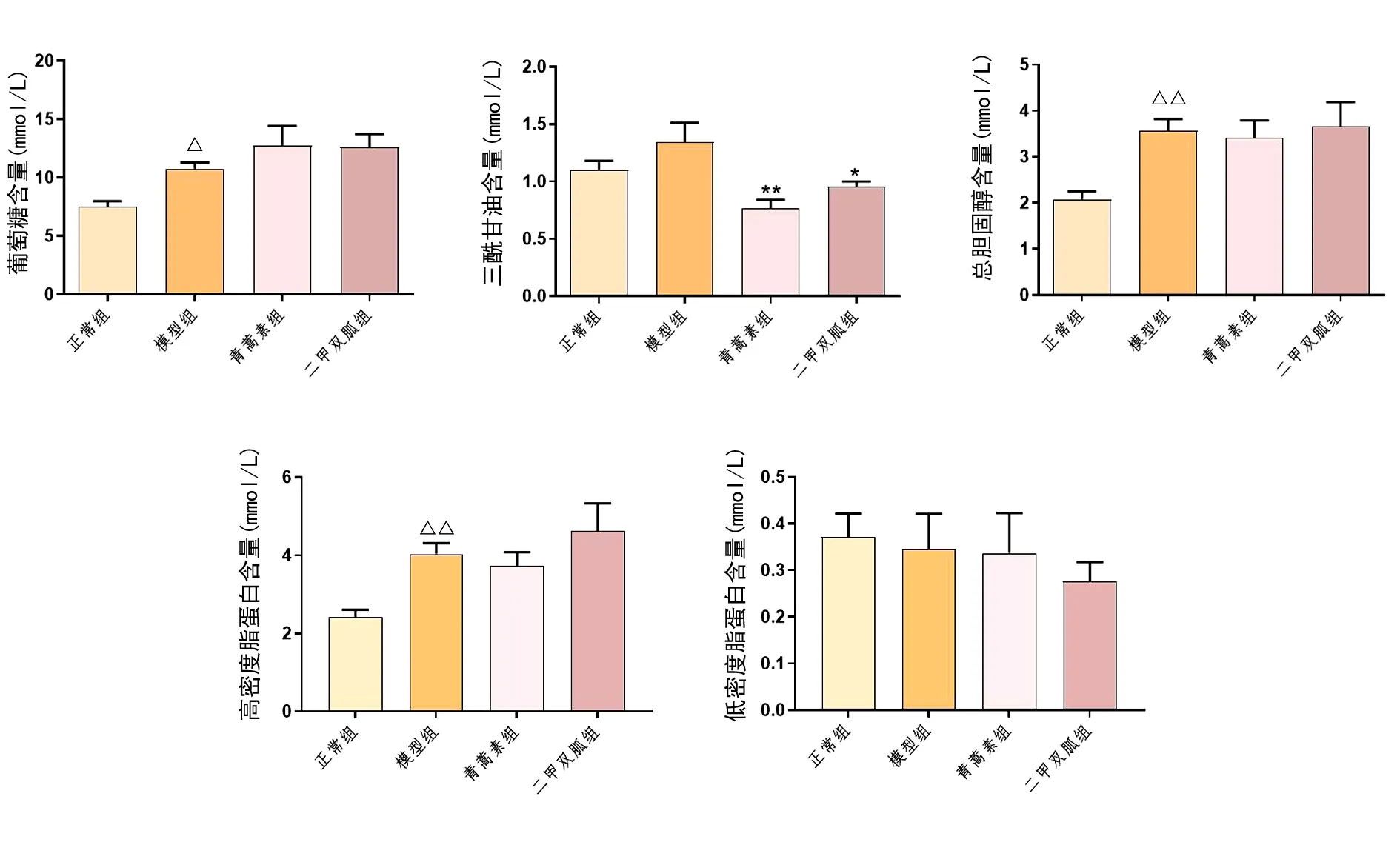
图2 各组小鼠血糖血脂水平注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01
2.2 代谢轮廓分析 采用XCMS软件对代谢物离子峰进行提取,并将正常组(C)、模型组(M)、青蒿素组(ART)、QC组样本提取到的峰经Pareto-scaling得到PCA模型。正离子模式(Positive Ion Mode,POS)和负离子模式(Negative Ion Mode,NEG)下QC样本PCA得分图见图3。
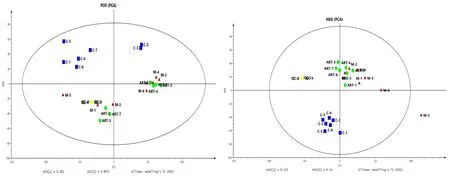
图3 正、负离子模式下样本的PCA得分
OPLS-DA常用于差异代谢物的筛选,正常组与模型组OPLS-DA得分:正离子模式R2=0.991、Q2=0.789,负离子模式R2=0.996、Q2=0.939。青蒿素组与模型组OPLS-DA得分:正离子模式R2=0.996、Q2=0.434,负离子模式,R2=0.977、Q2=0.635。见图4。
图4 正、负离子模式下模型组与正常组、青蒿素组与模型组的OPLS-DA得分
2.3 差异代谢物分析 根据OPLS-DA模型筛选标准选出87个具有显著性差异的代谢物,模型组与正常组共66个差异代谢物,给药组与模型组共32个差异代谢物。见表1。
与对照组比较,模型组亚油酸、顺式-9,10-环氧硬脂酸、3-吲哚丙酸、2,3-二羟基丙基(9Z,12Z)-十八烷-9,12-二烯酸酯、1-硬脂酰基-sn-甘油-3-磷酸胆碱的水平显著降低;棕榈酸、D-喹诺酮糖、α-酮异戊酸、愈伤酸、1,2-二油酰基-sn-甘油-3-磷脂酰胆碱、花生四烯酸(不含过氧化物)、L-古洛糖酸-γ-内酯的水平显著升高。
青蒿素使亚油酸、顺式-9,10-环氧硬脂酸、3-吲哚丙酸、2,3-二羟基丙基(9Z,12Z)-十八烷-9,12-二烯酸酯,1-硬脂酰基-sn-甘油-3-磷酸胆碱的含量进一步下降;花生四烯酸(不含过氧化物)、L-古洛糖酸-γ-内酯的含量进一步升高。与模型组比较,青蒿素显著下调了棕榈酸、D-喹诺酮糖、α-酮异戊酸、愈伤酸、1,2-二油酰基-sn-甘油-3-磷脂酰胆碱的水平。
2.4 差异代谢物京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析 对上述差异代谢物进行KEGG通路富集分析,结果表明,高果糖喂养的模型小鼠亚油酸代谢,蛋白质的消化吸收,苯丙氨酸、酪氨酸和色氨酸的生物合成等重要通路发生了显著变化(均P<0.01)。青蒿素组与模型组之间主要涉及脂质代谢类通路改变,其中包括脂肪酸生物合成、不饱和脂肪酸生物合成、亚油酸代谢等重要通路(均P<0.01)。见图5~6,表2。

表2 模型组与正常组,青蒿素组与模型组差异通路

图5 模型组与正常组KEGG通路富集分析
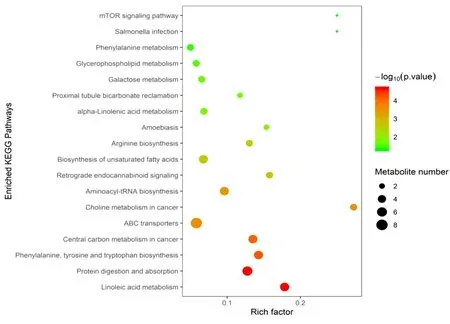
图6 青蒿素组与模型组KEGG通路富集分析
3 讨论
饮食高果糖动物模型目前主要用于研究脂质代谢、降糖作用及炎症反应[16]。果糖的大量摄入可增加参与脂肪生成和炎症反应途径的酶和转录因子的表达,可导致果糖诱导的代谢综合征[17],改变了葡萄糖代谢、胰岛素敏感性和血脂浓度[16]。果糖主要被肝脏摄取代谢[18],不受到限速酶限制,不通过胰岛素调控[19]。研究表明,果糖在肝脏中转化为三酰甘油,大量进入血液循环,长期的过量摄入可引起脑部的胰岛素抵抗,导致中枢神经系统的能量代谢失衡和神经炎症反应,从而神经突触可塑性降低[20]。本实验中喂饲高果糖饮食15周,与正常饮食组比较,小鼠体质量未发现明显变化;但是高果糖饮食可使小鼠血糖及血清三酰甘油、高密度脂蛋白胆固醇升高。长期的高果糖饮食可引起啮齿类动物的认知功能损伤和学习记忆障碍[21];高脂高果糖喂养的动物脑部小胶质细胞被激活[22]。果糖通过诱导大鼠脑组织中果糖转运蛋白葡萄糖转运子5(GLUT5)进而诱导产生中枢炎症反应[17]。高果糖摄入引起海马和背侧海马分子层白细胞介素-1b的显著增加[23]。我们前期也发现青蒿素及其衍生物可通过直接调节中枢炎症反应过程和抑制炎症反应用于治疗神经炎症[24-25],有助于保护海马细胞,下调炎症反应信号通路,降低了炎症介质的释放[26];通过调节肠道免疫反应和循环炎症介质间接调节神经炎症反应。今后研究我们也将关注长期高果糖饲养小鼠是否会具有炎性改变,青蒿素及其衍生物是否有可能通过调节免疫系统,抑制炎症反应信号转导。
在本研究中高果糖诱导的小鼠模型,青蒿素干预后可降低模型小鼠血清三酰甘油水平,对血糖、胆固醇水平没有影响。为深入研究青蒿素对高果糖饮食诱导的小鼠血清代谢物的变化,我们对小鼠血清进行代谢轮廓分析,正、负离子模式下QC样本紧密聚集在一起,表明分析方法重复性好;正、负离子模式下正常组与模型组、青蒿素组与模型组达到了很好的分离,证明模型稳定,可用于下一步差异代谢物分析。根据单变量统计分析筛选差异代谢物,青蒿素干预后主要涉及脂肪酸类成分的变化。对差异代谢物进行KEGG通路富集,发现高糖饮食能够引起小鼠脂肪酸、甘油磷脂、苯甲酸及其衍生物、糖醇、吡啶及其衍生物、异黄酮、氨基酸等相关代谢物水平变化;而青蒿素能够回调α-酮异戊酸、愈伤酸、顺式-9-棕榈油酸等差异代谢物。α-酮异戊酸是一种具有兴奋性神经毒性的支链氨基酸代谢物,使中枢神经系统发生改变,常对大脑造成损害,纹状体内注射能够引起大鼠惊厥[27]。血液中高浓度α-酮异戊酸会导致代谢酸中毒,发生代谢性疾病,如糖尿病等。在本研究中,青蒿素能够显著降低模型小鼠血清α-酮异戊酸含量,调节小鼠脂质代谢及中枢神经系统。棕榈酸、愈伤酸和顺式-9-棕榈油酸等差异代谢物都与脂肪酸代谢相关。青蒿素给药可使脂质类代谢物出现显著变化,其中包括中长链脂肪酸、胆汁酸及亚油酸相关代谢物。亚油酸可转化为具有代谢活性的花生四烯酸,具有诱导炎症反应、脂肪生成和内源性大麻素系统调节作用[28]。较高的亚油酸生物标志物与2型糖尿病发病率负相关,提示青蒿素可能改善模型小鼠的亚油酸代谢紊乱[29]。多不饱和脂肪酸在体内往往发挥着有益的作用,而饱和脂肪酸能引起人体内胆固醇转运系统的紊乱等一系列疾病[30]。
综上所述,14周的高果糖饮食改变了小鼠的脂质、氨基酸、碳水化合物代谢及消化、神经系统等系统相关的代谢物水平。青蒿素给药后可显著调节小鼠脂质代谢及神经系统相关的代谢物紊乱;脂肪酸及不饱和脂肪酸生物合成通路在给药后发生显著改变。虽然本研究结果显示青蒿素发挥了调节脂质代谢的作用,改善高果糖饮食引起的代谢紊乱,但是其发挥作用的特异性靶点和受体尚不明确,其潜在机制还有待进一步研究。
利益冲突声明:作者声明没有利益冲突。
——青蒿素

