基于参七汤的人参-三七药对治疗心肌梗死疗效的荟萃分析及网络药理学研究
魏路路 郭书文,2 力一凡 冯鹏飞
(1 北京中医药大学,北京,100029; 2 北京中医药大学房山医院,北京,102401)
心肌梗死(Myocardial Infarction,MI),是由于冠状动脉闭塞、血流中断导致心肌严重持久的缺血、缺氧引起的心肌局部坏死,严重时可并发心律失常、休克或心力衰竭,是造成人类死亡的主要原因之一[1]。相关报道显示,中国心血管病的患病率处于持续上升阶段,死亡率居首位,高于肿瘤及其他疾病[2],其中MI是重要致死因素之一。MI是急、危、重症,确诊后应立即抢救,应休息、镇痛、吸氧、补充血容量、抗休克等对症治疗。
MI在中医上属于“胸痹”“真心痛”的范畴,病机多为“本虚标实”,临床证候虚实夹杂,虚证以气虚最为常见,实证多为血瘀[3],针对气虚血瘀的病机,常以益气活血的方式治疗,参七汤作为益气活血的代表方药之一,临床具有很好的疗效。参七汤以人参、三七为君药,现代研究表明,人参皂苷作为人参的主要活性成分,具有抗心律失常、抗心肌肥厚、抗心肌缺血、抗心肌细胞凋亡等作用[4]。人参皂苷Rg1在MI的状态下能够抑制心脏纤维化以及促进血管再生[5]。三七总皂苷是三七的活性成分,能够通过上调血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)表达促进新生血管生成,减少心肌梗死面积[6]。然而有关人参、三七治疗MI的研究往往都是单一通路、单一机制研究,本研究通过荟萃分析了解参七汤治疗MI的有效率,并结合网络药理学的方法,全方位、多角度探讨人参-三七治疗MI的作用机制,揭示其内在机制。
1 资料与方法
1.1 文献来源 国家知识基础设施数据库(China National Knowledge Infrastructure,CNKI)、中国学术期刊数据库(China Science Periodical Database,CSPD)及中文科技期刊数据库(Chinese Citation Database,CCD)、PubMed、CochraneLibrary、Embase数据库建库以来发表的相关文献,手工检索《中国心血管杂志》《中华心血管病杂志》《心血管病学进展》等相关杂志。
1.2 检索策略 搜索时间截止到2022年12月。检索参七汤治疗心肌梗死的临床随机对照试验研究文献,中文搜索词:参七汤、胸痹、真心痛、心肌梗死,英文搜索词:shenqi、myocardial infarction。以CNKI为例,检索策略为[(全文=‘参七汤’)AND(全文=胸痹+真心痛+心肌梗死)]。
1.3 纳入标准 纳入以西医常规治疗为对照组,在对照组基础上联合参七汤治疗的临床随机对照试验研究,西医常规治疗可联合运动方案,不考虑盲法与否,不考虑参七汤在关键用药基础上的临床药物加减。试验研究对象应为心肌梗死后心室重构患者,研究对象诊断标准不设立统一标准,但主体内容应一致,符合中华医学会、欧洲心脏病学会、美国心脏病协会等权威机构发布的心肌梗死诊断标准,中医诊断应符合胸痹或真心痛。评价标准主要指标为左心室射血分数(Left Ventricle Ejection Fraction,LVEF)、左室舒张末期内径(Left Ventricular End-diastolic Dimension,LVEDD)、低密度脂蛋白胆固醇(Low Density Lipoprotein Cholesterol,LDL-C),次要指标为证候积分总有效率。主要指标≥1项可纳入。
1.4 排除标准 1)重要数据缺失文献;2)研究周期少于1个月文献;3)期刊文献与毕业大论文重复者。
1.5 资料提取及质量评价 1)资料提取:主要内容包括研究者信息、样本量、性别、年龄、干预措施和对照措施、疗程、结局指标。2)质量评价:质量评价严格按照Cochrane协作网的偏倚风险评估工具执行。共7个条目:随机序列生成、随机序列隐藏、受试者及研究人员的盲法、结局评价者盲法、不完整结局数据、选择性结局报告及其他偏倚,并针对每个条目的偏倚做出高风险(High risk)、低风险(Low risk)、不确定风险(Unclear risk)的判断来评价纳入研究的方法学质量。资料提取及质量评价由2位研究者独立完成并交叉核对,产生分歧时,与第3位研究者协商、讨论决定。
1.6 统计分析 采用Rev Man 5.4统计软件进行数据分析。计数资料用比值比(Odds Ratio,OR)及其95%置信区间(95% Confidence Interval,95%CI)表示,计量资料用均数差(Mean Deviation,MD)及其95%CI表示。若异质性检验结果为P>0.10时,多个研究的异质性无统计学意义,若P≤0.10,多个研究的异质性有统计学意义。通过I2来分析各研究间的异质性,当I2≤50%时,异质性较小,忽视异质性,采用固定效应模型;若I2>50%,则认为其为高异质性,选择随机效应模型进行Meta分析,并通过亚组分析和回归分析,尽量找出异质性来源。
1.7 网络药理学研究
1.7.1 人参-三七活性成分、相关靶点及作用MI相关靶点的筛选 活性成分及相关靶点:通过中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)寻找“人参”“三七”的活性成分,结合口服生物利用度(Oral Bioavailability,OB)≥30%和类药性(Drug Likeness,DL)≥0.18作为筛选条件,获得二者的活性化合物及其作用的蛋白质靶点[7]。利用Uniprot蛋白质数据库(https://www.uniprot.org)将上述蛋白质靶点进行统一规范。
作用于MI相关靶点的筛选:通过GeneCards数据库、OMIM数据库、DrugBank数据库以及TTD数据库筛选心肌梗死相关靶点[8-11],将4个数据库获得的相关靶点汇总并去重。将人参-三七活性成分的靶点和MI相关靶点取交集,将其作为人参-三七作用于MI的潜在靶点。
1.7.2 靶蛋白质-蛋白质相互作用(Protein-protein Interaction,PPI)网络的构建 将人参-三七作用于MI的潜在靶点导入STRING 11.0数据库(https://string-db.org/)构建PPI网络[12],生物种属选择‘Homo sapiens’,最小交互阈值选择‘highest confidence(0.900)’,下载PPI网络图片。
1.7.3 人参-三七作用MI的潜在靶点富集分析 将潜在靶点导入Metascape数据库进行基因本体(Gene Ontology,GO)富集分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析。分别进行分子功能(Molecular Functions,MF)、生物过程(Biological Processes,BP)、细胞组分(Cellular Components,CC)及KEGG通路分析,设置“P<0.01”,保存数据并使用OriginPro 2019b对结果进行可视化处理。
1.7.4 活性成分-靶点网络和成分-靶点-通路网络的构建及核心组分筛选 将人参-三七的活性成分和人参-三七作用于MI的潜在靶点导入Cytoscape 3.7.1软件[13],构建活性成分-潜在靶点网络,并分析关键网络拓扑参数,如连接度(Degree)、介数中心性(Betweenness Centrality)、接近中心性(Closeness Centrality)等,根据这些参数筛选人参-三七作用MI的活性成分和作用靶点。将KEGG通路富集分析的结果作为信号通路,选取比较有代表性的前20个通路,将这些道路对应的潜在靶点与活性成分导入Cytoscape 3.7.1构建活性成分-靶点-通路网络。
1.7.5 分子对接验证 从PDB数据库(http://www.rcsb.org/)获取核心靶点的蛋白质三维结构数据文件(Protein Data Bank,PDB),从TCMSP获取主要活性成分的MOL2结构。将核心靶点蛋白作为受体,活性成分作为配体,应用分子对接模拟软件AutoDock 4.2进行半柔性对接[14]。对接运算采用拉马克遗传算法(Lamarckian Genetic Algorithm,LGA),各参数选择默认值。对接完成后,对结果进行分析,并用pymol进行可视化处理[15]。
2 结果
2.1 文献检索结果 通过检索策略共获得224篇相关文献,筛重后共获得178篇文献,初筛后剔除明显不符合纳入标准文献159篇,精准阅读文献19篇,最终纳入文献9篇[16-24]。文献筛选流程见图1。

图1 文献筛选流程
2.2 纳入文献基本特征 本研究纳入9项研究,共650例,观察组共328例,对照组共322例。纳入研究的基本特征见表1。
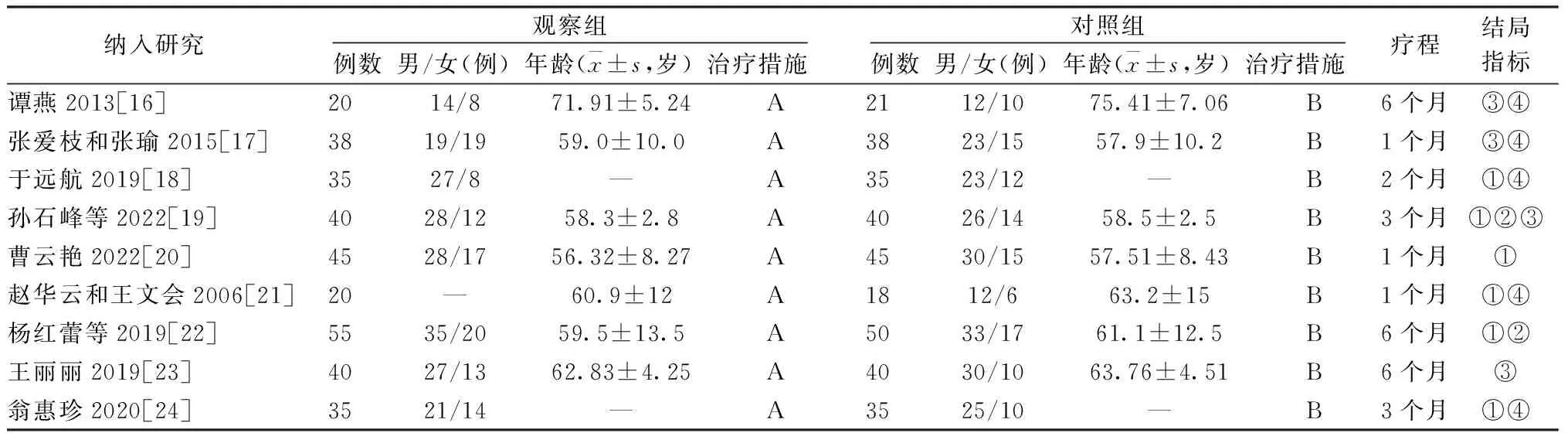
表1 纳入文献基本特征
2.3 质量评价 对纳入的9篇文献,采用Cochrane风险偏倚评价表进行质量评价。1)随机分配方法:9篇文献中6篇采用随机数字表分组法,评价为低风险,其余3篇未提及具体随机方法,评价为风险不明。2)分配方案隐藏:9篇文献中3篇未提及具体分配隐藏,评价为不明风险。3)盲法:9篇文献均未提及盲法设计,评价为不明风险。4)结果数据的完整性:文献中有1篇研究观察组与对照组均有脱落,作者已详述脱落与剔除原因,评价为低风险,其余8篇文献的病例数完整,均评价为低风险。5)选择性报告研究结果:9篇文献中,有1篇存在选择性报告结果,评价为高风险。6)其他偏倚来源:纳入的9篇文献中无其他偏倚来源。见图2。

图2 纳入文献偏倚风险
2.4 结局指标评价及结果分析
2.4.1 射血分数 共有6篇文献[18-22,24]进行了射血分数的判定,结果显示,各研究间存在明显异质性(P<0.000 01,I2=92%),采用随机效应模型,观察组优于对照组,但2组间差异无统计学意义(MD=3.22,95%CI为-0.26~6.69,P=0.07)。依据治疗时间进行亚组分析,结果显示,治疗1个月的2项研究存在明显异质性(P=0.002,I2=89%),差异无统计学意义(MD=1.11,95%CI为-11.47~13.68,P=0.86);治疗2~3个月的3项研究异质性降低(P=0.19,I2=39%),差异有统计学意义(MD=5.82,95%CI为4.19~7.44,P<0.000 01)。总合并效应量(MD=3.22,95%CI为-0.26~6.69,P=0.07)。结果显示,观察组相较对照组可提高LVEF。异质性的变化与疗程有关,考虑其异质性来源可能与疗程有关。见图3~4。
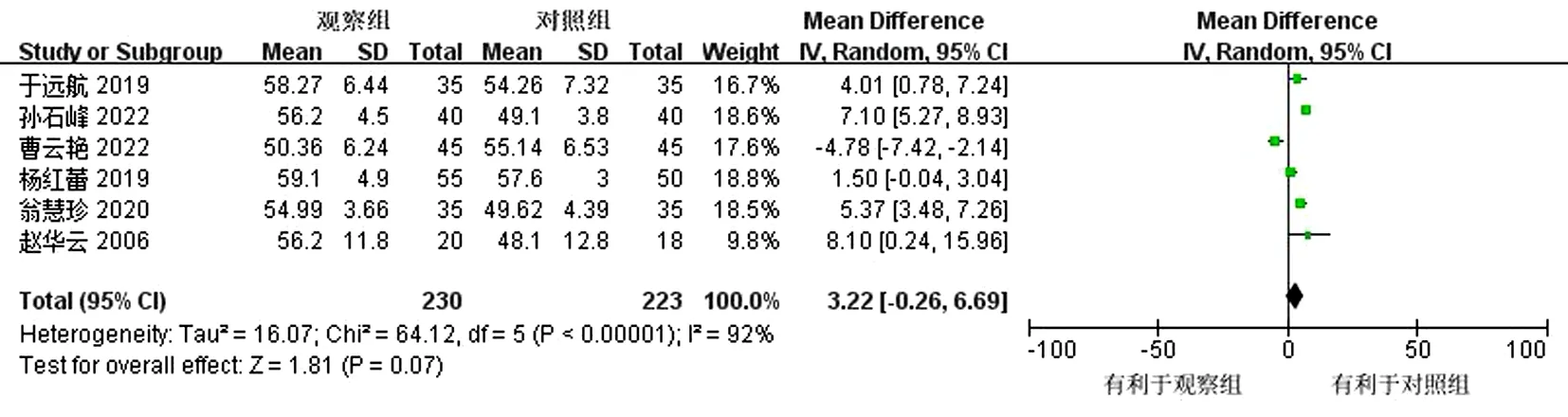
图3 LVEF森林图
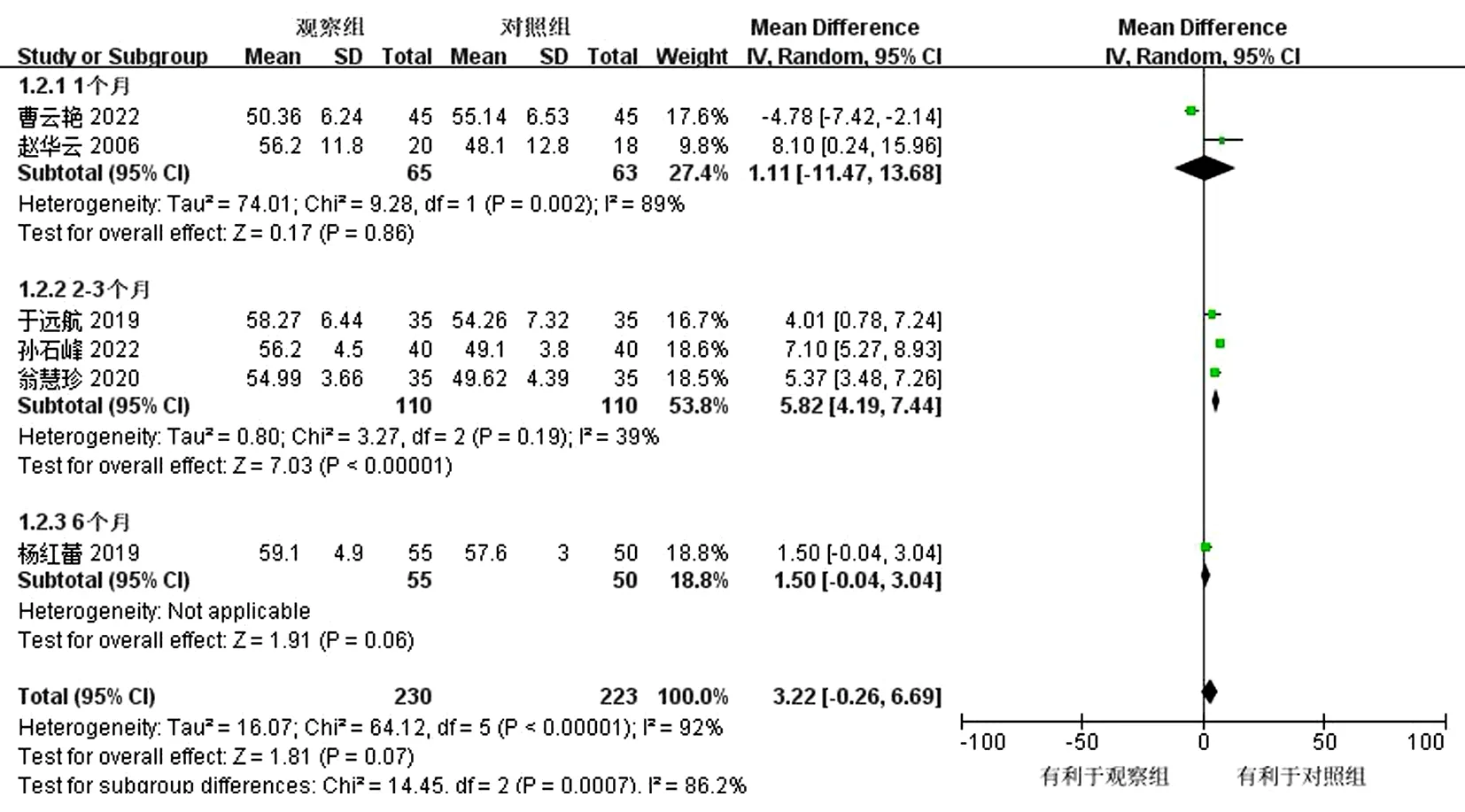
图4 LVEF亚组分析森林图
2.4.2 LDL-C 共有4篇文献[16,17,19,23]进行了,LDL-C的评定,存在明显异质性(P<0.000 01,I2=94%),采用随机效应模型进行分析。敏感性分析提示逐一排除文献未见明显异质性改变,考虑相关研究较少,暂不明确异质性来源。结果显示,观察组相较对照组可降低低密度脂蛋白,差异有统计学意义(MD=-0.48,95%CI为-0.7~-0.19,P=0.001)。见图5。
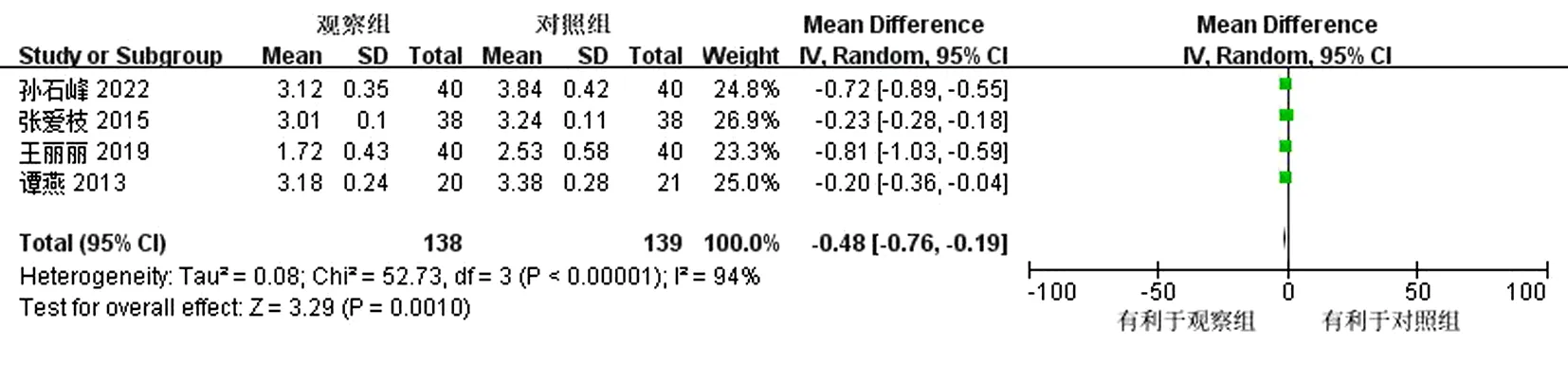
图5 低密度脂蛋白森林图
2.4.3 LVEDD 共有2篇文献[19,22]进行了LVEDD的评定,存在明显异质性(P=0.01,I2=85%),采用随机效应模型进行分析,考虑研究较少,暂不予异质性来源分析,结果显示,观察组相较对照组可降低左室舒张末内径,差异无统计学意义(MD=-2.45,95%CI为-5.68~0.77,P=0.14)。见图6。
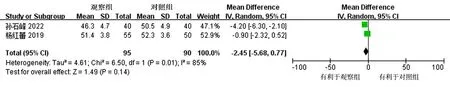
图6 左室舒张末内径森林图
2.4.4 证候积分总有效率 共有5篇文献[16-18,21,24]对证候积分总有效率进行了判定,结果显示,异质性检验提示各研究无明显异质性(P=1.00,I2=0%),故采用固定效应模式,提示观察组治疗总有效率优于对照组,差异有统计学意义(OR=4.46,95%CI为2.28~8.74,P<0.000 1)。见图7。
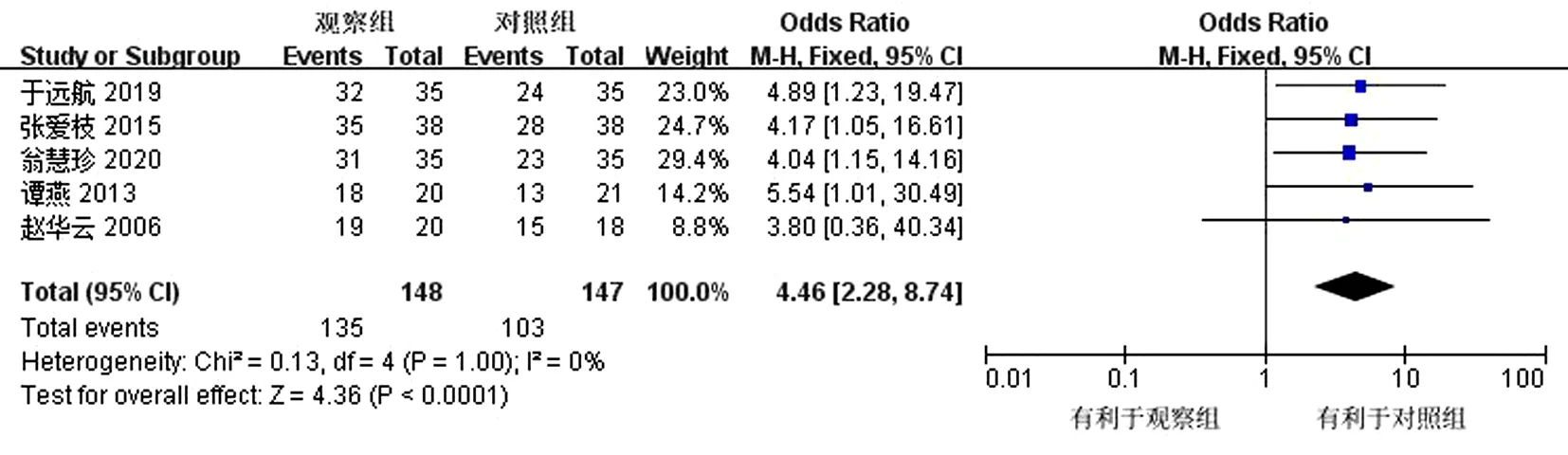
图7 证候积分总有效率森林图
2.5 人参-三七活性成分、相关靶点及作用MI潜在靶点的筛选
2.5.1 人参-三七活性成分与相关靶点 通过TCMSP数据库筛选出30个符合OB≥30%、DL≥0.18条件的化合成分,其中人参有22种,三七有8种活性成分,将二者汇总删除重复值,共得到人参-三七26种活性成分。主要有:高丽槐素(Inermin)、山柰酚(Kaempferol)、阿朴天仙子碱(Aposiopolamine)、南蛇藤苄酰胺(Celabenzine)、原阿片碱(Fumarine)、人参皂苷f2(Ginsenoside f2)、槲皮素(Quercetin)、β-谷甾醇(Beta-sitosterol)、豆甾醇(Stigmasterol)等。各个活性成分的OB和DL值见表2。人参活性成分作用靶点114个、三七活性成分作用靶点177个,合并后删除重复值共得到靶点197个。

表2 人参-三七活性成分
2.5.2 人参-三七作用MI的潜在靶点 从GeneCards、DrugBank、OMIM、TTD数据库筛选心肌梗死相关靶点,各获得靶点916个、105个、40个、23个,去重共得到相关靶点1 012个。将筛选出的人参-三七活性成分作用靶点与心肌梗死相关靶点取交集并绘制韦恩图,得到人参-三七作用心肌梗死的交集靶点102个。见图8。
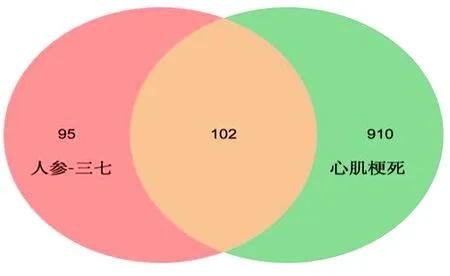
图8 人参-三七活性成分靶点与MI相关疾病靶点韦恩图
2.6 PPI网络的构建 将102个潜在靶点导入STRING 11.0平台,得到人参-三七作用MI靶点PPI网络,包含102个节点,255条边。其中节点表示蛋白,边则表示PPI关系。见图9。
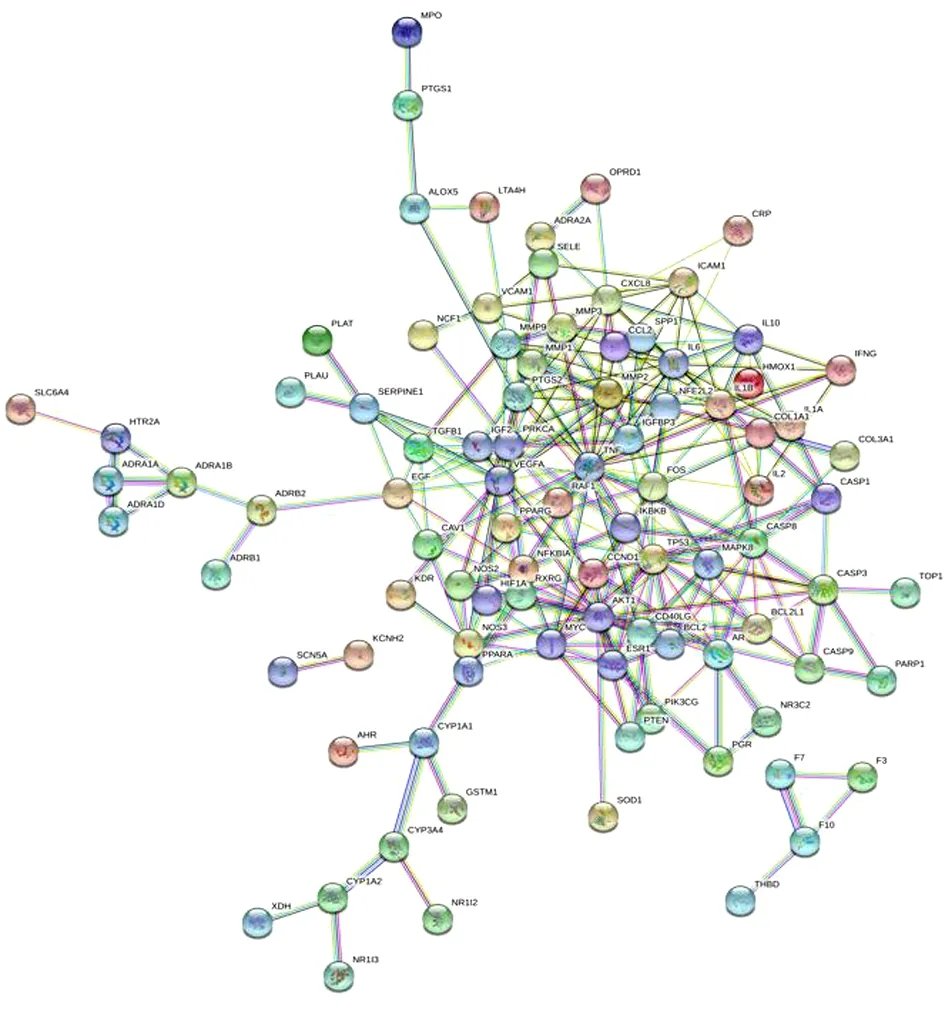
图9 人参-三七治疗MI相关靶点PPI网络
2.7 GO富集分析与KEGG通路分析 KEGG通路分析共获得149条通路,选取前20个通路利用OriginPro 2019b进行可视化处理。见图10A。结果显示,潜在靶点主要在AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications)、PI3K-AKT信号通路(PI3K-AKT signaling pathway)、核因子κB信号通路(NF-kappa B signaling pathway)、HIF-1信号通路(HIF-1 signaling pathway)、cGMP-PKG信号通路(cGMP-PKG signaling pathway)等通路富集。见图10。
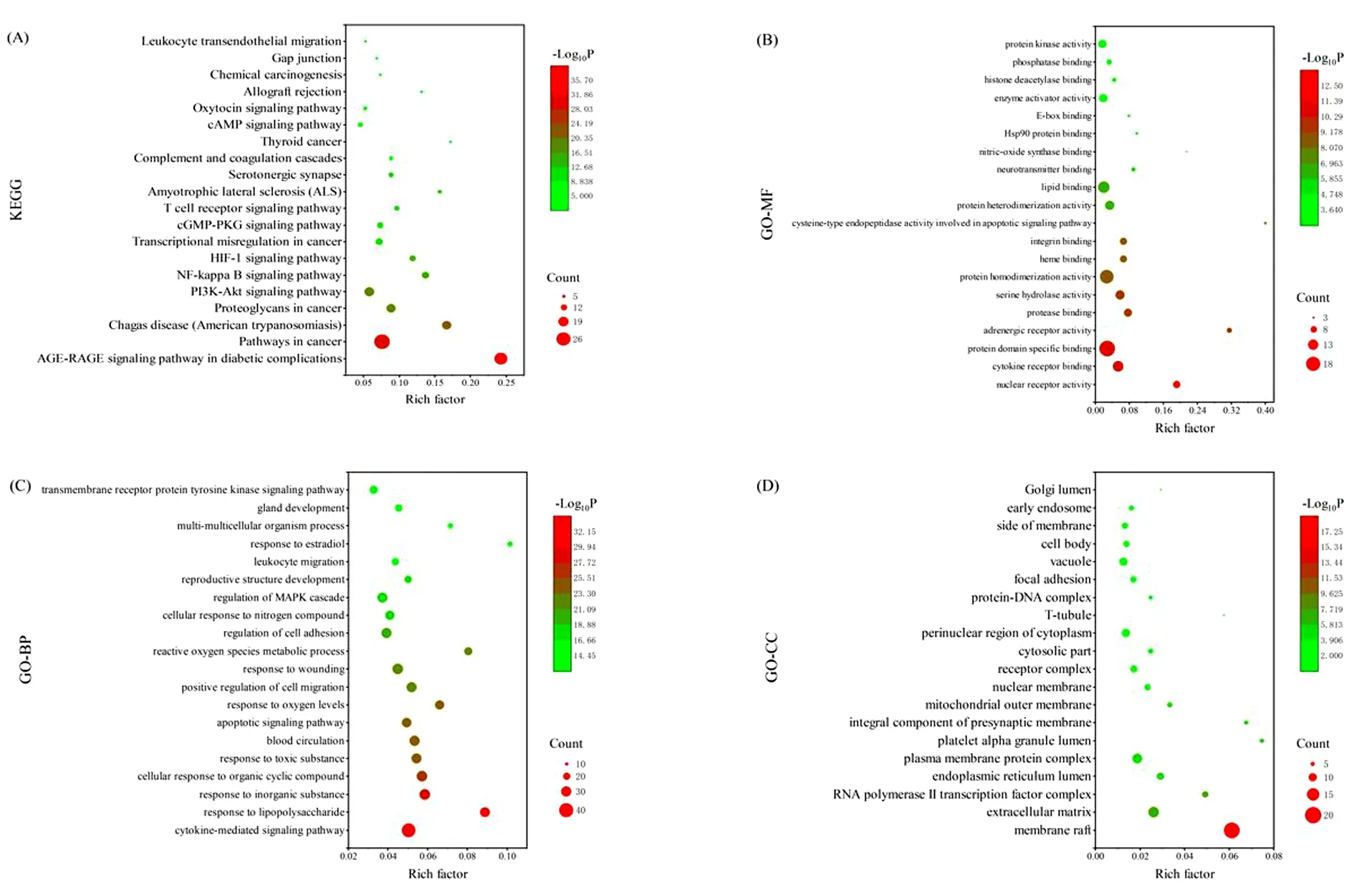
图10 KEGG通路分析和GO富集分析结果
GO富集分析结果显示潜在靶点参与的分子功能主要包括核受体化学(Nuclear receptor activity)、细胞因子受体结合(Cytokine receptor binding)、蛋白质结构域特异性结合(Protein domain specific binding)、蛋白酶结合(Protease binding)、丝氨酸水解酶活性(Serine hydrolase activity)等;生物过程主要有:细胞因子介导的信号通路(Cytokine-mediated signaling pathway)、对脂多糖的反应(Response to lipopolysaccharide)、对无机物的反应(Response to inorganic substance)、细胞对有机环状化合物的反应(Cellular response to organic cyclic compound)、对有毒物质的反应(Response to toxic substance)等;参与的细胞组分主要包括膜筏(Membrane raft)、细胞外基质(Extracellular matrix)、RNA聚合酶Ⅱ转录因子复合物(RNA polymeraseⅡtranscription factor complex)、内质网腔(Endoplasmic reticulum lumen)、质膜蛋白复合物(Plasma membrane protein complex)等。见图10。
2.8 网络构建及核心组分的筛选 筛选出人参-三七作用于MI的重要活性成分为槲皮素、山柰酚、β-谷甾醇、豆甾醇,重要靶点为前列腺素内过氧化物合酶(Prostaglandin G/H Synthase,PTGS)2、前列腺素内过氧化物合酶1(PTGS1)、β2肾上腺素受体(beta-2 Adrenergic Receptor,ADRB2)、心脏钠通道基因(SCN5A)。见图11。
KEGG通路富集共得到149条通路,选取其中20条通路。见图12。
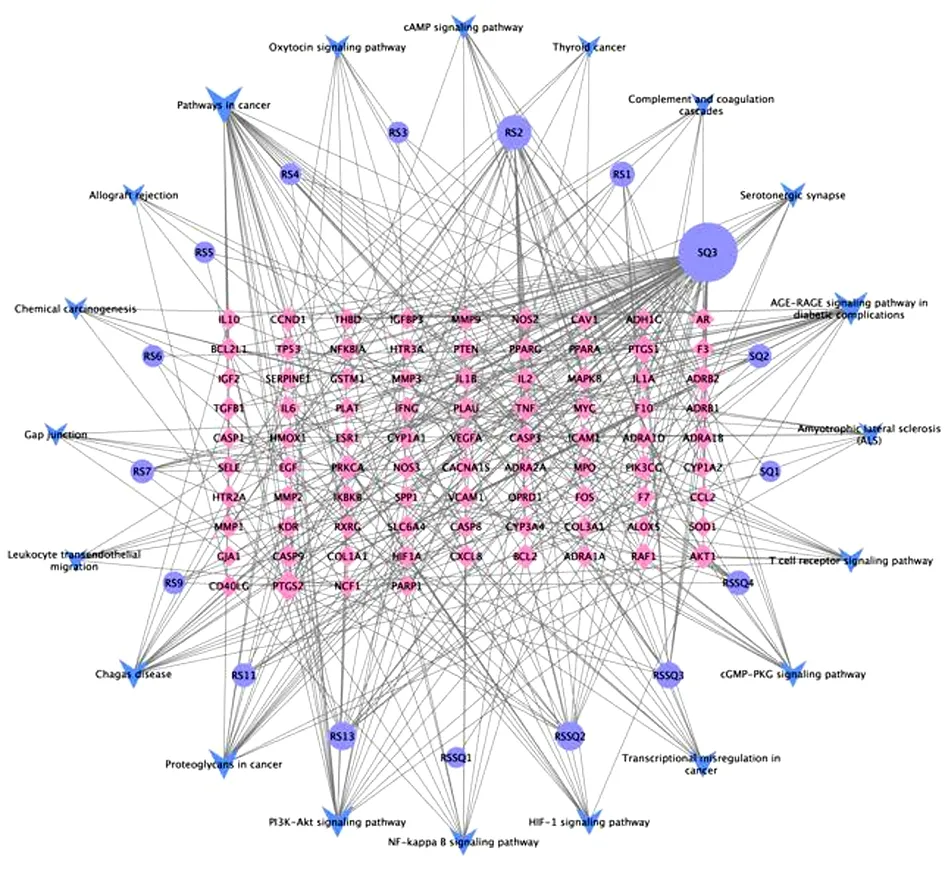
图12 成分-靶点-通路网络
2.9 分子对接验证 结果显示人参-三七的主要活性成分槲皮素、山柰酚、β-谷甾醇与靶点ADRB2结合较好,推测人参-三七治疗MI与槲皮素、山柰酚、β-谷甾醇以及靶点ADRB2关系密切。见图13。
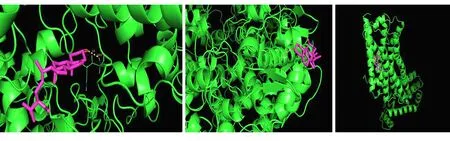
图13 槲皮素、山柰酚、β-谷甾醇与靶点ADRB2的对接结果
3 讨论
MI是心血管疾病中发病率较高的一种疾病,对中老年患者构成了很大的威胁。中医认为,MI的根本病因在于患者本身脏腑功能失调、劳倦内伤等内因与外邪侵袭、饮食不节等外因。根本病机在于不通则痛,不荣则痛。前者多表现为血瘀,可由外邪侵袭、痰浊、寒凝等引起。后者多由气虚、血虚、阳虚等引起[25]。临床MI患者多表现为气虚血瘀证,常用益气活血方治疗,本研究纳入9项以参七汤为主治疗MI的临床研究,共计650例患者,分别从LVEF、LVEDD、LDL-C、证候积分总有效率等指标评价参七汤治疗MI的有效性。结果显示参七汤联合西医常规治疗相较对照组能改善心功能,降低血脂水平,提高治疗有效率。不过本研究存在一定局限性:本研究纳入研究时间年限跨度较长,研究质量参差不齐,原始研究执行情况不明,可能导致研究异质性偏高;纳入文献未采用盲法,未采用安慰剂对照,纳入单项研究的样本量普遍偏少。
本研究通过网络药理学的方法初步筛选出人参-三七作用MI的活性成分有槲皮素、山柰酚、β-谷甾醇、豆甾醇等。心血管疾病的相关研究表明,槲皮素可以抑制心肌梗死模型大鼠白细胞与内皮细胞间黏附,抵抗微小血栓的形成,减少急性MI造成的心肌损伤[26]。还可以显著改善心肌纤维化大鼠的心功能,降低大鼠心肌组织中转化生长因子-β(Transforming Growth Factor-β,TGF-β)及结缔组织生长因子(Connective Tissue Growth Factor,CTGF)的表达水平,改善心肌的组织形态,减少胶原的沉积,逆转心肌纤维化[27]。山柰酚可抑制环氧合酶,以及抑制淋巴因子白细胞介素-6(Interleukin-6,IL-6)、IL-1、IL-18和肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)的释放,起到抗炎的保护作用[28]。β-谷甾醇可以抑制心肌缺血再灌注损伤大鼠的氧化应激反应和炎症反应,并下调细胞外信号调节激酶1/2(Extracellular Regulated Protein Kinases1/2,ERK1/2)信号通路磷酸化水平减少细胞凋亡从而减轻心肌损伤[29]。豆甾醇可以有效地减少由缺血再灌注损伤引起的神经功能缺损和梗死损伤,改善组织病理学变化[30]。
由人参-三七作用MI的PPI网络发现,人参-三七作用MI的主要靶点为PTGS2、PTGS1、ADRB2、SCN5A。PTGS2又称环氧合酶-2是花生四烯酸合成前列腺素的限速酶,能够促进炎症反应,参与诱导细胞凋亡和增殖[31]。PTGS1又叫环氧合酶-1,除参与炎症反应外,还参加很多疾病的病理过程,如疼痛、血栓症、动脉粥样硬化、内皮功能紊乱、高血压、癌症等[32]。ADRB2激活的下游蛋白激酶A(Protein Kinase A,PKA)能够负反馈调节ADRB2的磷酸化,这一过程促使ADRB2由亲和刺激性G蛋白(Stimulatory Protein,Gs)转换成亲和抑制性G蛋白(Inhibitory G-proteins,Gi)的状态,且Gi蛋白表达也增高,此时ADRB2可以通过偶联上调的Gi蛋白并激活下游PI3K-AKT信号通路,抑制心肌细胞凋亡[33]。SCN5A突变与多种疾病有关,如可诱发心律失常、特发性心房颤动、“SCN5A重叠综合征”等[34]。
KEGG通路富集分析显示人参-三七作用MI的潜在靶点主要在AGE-RAGE信号通路、PI3K-AKT信号通路、核因子κB信号通路、缺氧诱导因子-1(Hypoxia-Inducible Factor 1,HIF-1)信号通路、cGMP-PKG信号通路等富集。晚期糖基化终末产物与糖基化终末产物受体通过影响动脉粥样硬化、线粒体功能障碍、氧化应激、钙稳态和细胞骨架功能来影响心血管疾病的发病机制[35]。PI3K-AKT信号通路参与改善大鼠急性MI后的心功能损伤和减少心肌细胞凋亡,以及通过抑制过度自噬来减轻心肌梗死后期的损伤[36]。核因子κB信号通路的活性直接影响着下游炎症介质TNF-α、IL-6、IL-8等的表达,从而发挥着调节炎症的作用[37]。HIF-1是由HIF-1α和HIF-1β 2个亚基组成的异二聚体转录因子。HIF-1α在多种炎症免疫细胞中高表达,影响免疫细胞的募集、迁移、吞噬、杀伤等,在炎症发生及消退过程中都发挥重要作用[38]。缺氧状态下,HIF-1α通过正调控蛋白酶激活受体1的表达,进而改变Bcl-2/Bax的表达比例,诱导H9c2细胞凋亡[39]。cGMP-PKG信号通路可以抑制炎症介质的释放,减轻MI后的梗死面积和心肌损伤[40]。
综上所述,本研究通过网络药理学的方法系统阐述了人参-三七作用MI的分子机制,找到了人参-三七治疗MI的相关活性成分、作用靶点和信号通路,推测人参-三七主要通过调节线粒体功能、氧化应激、钙稳态、炎症反应以及抑制细胞凋亡等来治疗MI,为后续的实验研究提供了坚实的理论基础和科学依据。
利益冲突声明:无。

