六味地黄丸和通络救脑滴丸对2种痴呆模型小鼠脑组织Aβ降解的影响
贾亚泉 宋军营 曾华辉 谢治深 张紫娟 袁 永 原 野 张振强 狄 波
(1 河南中医药大学中医药科学院,郑州,450046; 2 中国中医科学院,北京,100700)
痴呆主要以认知和自理能力下降为主要表现,其发病与肾、心、脾、肝等脏腑功能失调密切相关。因肾精生髓通于脑,若肾精亏耗,髓海不足,脑元失养而“肾精不足”致呆;因忧愁思虑,痰蒙心窍,致七情不遂使脏腑功能失调,气滞血瘀而“毒损脑络”致呆。本文在此中医病机理论指导下,以补肾填精,解郁散结治法,采用SAMP8小鼠建立“肾精不足”证痴呆动物模型和SAMR1小鼠双侧海马区注射Aβ1-40建立“毒损脑络”证痴呆动物模型,比较2种痴呆模型的差异,通过六味地黄丸和通络救脑滴丸分别对此2种痴呆症进行治疗,采用免疫印迹法(Western Blotting法)检测调节脑内Aβ代谢的关键蛋白胰岛素降解酶(Insulin-degrading Enzyme,IDE)、低密度脂蛋白相关蛋白1(Low-density Lipoprotein Receptor-related Protein 1,LRP1)和晚期糖基化终末产物受体(Receptor for Advanced Glycation end Products,RAGE)的表达,探讨六味地黄丸和通络救脑滴丸对不同拟老年痴呆症模型小鼠脑组织中Aβ降解的作用特点。
1 材料与方法
1.1 材料
1.1.1 动物 无特定病原体(Specific Pathogen Free,SPF)级SAMP8小鼠,雄性,32周龄,48只;SPF级SAMR1小鼠,雄性,32周龄,68只,购自北京华阜康实验动物有限公司,生产许可证号:SCXK(京)2020-0004。动物购回后饲养于河南中医药大学动物实验中心,使用许可证号:SYXK(豫)2021-0015,期间自由饮食,饲养温度控制在(22±1)℃,相对湿度(45±5)%,照明每12 h明暗交替1次。本实验通过河南中医药大学实验动物福利伦理委员会审查批准(伦理审查号:DWLL201911028)。
1.1.2 药物 六味地黄丸(河南宛西制药股份有限公司,批号:18110401)、通络救脑滴丸(由栀子、三七组成,具有解营卫之毒、活血通络之功效,天津红日药业股份有限公司,批号:090603);盐酸多奈哌齐片(卫材药业有限公司,批号:1701069)。
1.1.3 试剂与仪器 Aβ1-40(Sigma,德国,货号:A1075),Aβ抗体(Abcam,英国,货号:Ab11132),IDE抗体(Abcam,英国,货号:Ab25970),RAGE抗体(Abcam,英国,货号,Ab37647),LRP1抗体(Epitomics,美国,货号:2703-1),抗β-Actin鼠单克隆抗体(北京康为世纪生物科技有限公司,货号:CW1313),DAB试剂盒(北京康为世纪生物科技有限公司,货号:CW0211),UltraSensitive S-P(Goat)(福州迈新生物技术开发有限公司,货号:KIT-9709),放射免疫沉淀测定(Radio Immunoprecipitation Assay,RIPA)裂解液(上海碧云天生物科技有限公司,货号:P0013B),二辛可宁酸(Bicinchoninic Acid,BCA)蛋白浓度测定试剂盒(上海碧云天生物科技有限公司,货号:P0012)。小动物脑立体定位仪(深圳市瑞沃德生命科技有限公司,型号:68003)、Morris水迷宫检测系统(深圳市瑞沃德生命科技有限公司,型号:63031),超声细胞破碎仪(Sonics,美国,型号:VCX130),电泳仪、转膜仪、凝胶成像仪(Bio-rad,美国,型号:P3000),电子天平(上海精密仪器仪表有限公司,型号:YP600),全自动酶标仪(Thermo,美国,型号:MK3),光学显微镜(Leica,德国,型号:DM500B)。
1.2 方法
1.2.1 分组与模型制备
1.2.1.1 分组 SAMR1小鼠分为空白对照组(N组)12只;模型一组(A组)、阳性对照组(AY组)、六味地黄丸组(AL组)和通络救脑滴丸组(AT组),每组14只。SAMP8小鼠分为模型二组(P组)、阳性对照组(PY组)、六味地黄丸组(PL组)和通络救脑滴丸组(PT组),每组12只。
1.2.1.2 双侧海马注射Aβ1-40动物模型制备 动物适应性喂养5 d后对SAMR1小鼠除空白对照组进行造模。造模前12 h对动物进行禁食不禁水处理。动物麻醉后,将动物腹位固定在脑立体定位仪上,剃除头顶部手术区毛发,用碘伏消毒后做0.5 cm左右纵向切口,参照大鼠脑立体定位图谱在前囟后2.3 mm,中线左右各1.8 mm,用牙科钻钻开颅骨,暴露硬脑膜,用微量进样针自脑表面进针2 mm,每侧注射Aβ1-40溶液0.5 μL,进样时间3 min,注射后留针3 min,之后用1 min时间缓慢撤针,肌内注射青霉素G 10万U/d,连续注射3 d,常规饲养。
1.2.2 给药方法 参照《中药药理实验方法》计算给药量,六味地黄丸(LWDH)3.333 g/(kg·d)、通络救脑滴丸(TLJN)0.618 g/(kg·d)、盐酸多奈哌齐片(YSDNPQ)1.667 mg/(kg·d),每天所需药量溶于1 mL去离子水中。Aβ1-40溶液的配制:将Aβ1-40溶于无菌生理盐水,参照Prediger的实验配置,使1 μL溶液含有400 pmol的Aβ1-40,将溶液在37 ℃恒温水浴中孵育4 d备用。在造模成功后第2天开始,每天早、晚8点各1次进行灌胃给药,每次灌胃量根据动物体质量计算给药体积。其中,N组、A组、P组给予等量去离子水,AL组、PL组给予六味地黄丸溶液,AT组、PT组给予通络救脑滴丸溶液,AY组、PY组给予盐酸多奈哌齐片,连续给药14 d。
1.2.3 检测指标与方法
1.2.3.1 行为学测试 1)Morris水迷宫实验:各组动物均于A模型造模后第15天适应性游泳60 s。第16天起正式测试,先将动物放在平台上适应10 s进行空间定位。动物放入水中后,软件开始计时,从入水到找到平台所需的时间为逃避潜伏期。在60 s内找到平台并停留超过2 s者为寻的成功,其潜伏期为实际所用时间;否则为寻的失败,其潜伏期为60 s。每次测试后将动物再次放置在平台上适应10 s。每只动物从未放置平台的3个象限依次测试1次,连续测试3 d。2次测试间隔3 h。每天动物测试顺序、入水象限、测试时段保持一致。2)避暗实验:水迷宫实验结束后第2天进行,电刺激30 V。避暗实验第1天,将小鼠放到明室自由活动,当小鼠进入暗室时,关闭明暗室之间的通道门,同时暗室通电,电刺激小鼠5 s后取出。24 h后将小鼠再次放入明室,测试时间5 min。从测试开始到小鼠第1次进入暗室的时间为避暗潜伏期,测试期间进入暗室的次数为错误次数,在暗室停留的时间为错误区时间。
1.2.3.2 免疫组化法检测海马与皮层Aβ的表达情况 行为学检测结束后,将小鼠快速断头处死,在冰上取出全脑,除去小脑,投入4%多聚甲醛溶液固定24 h后取出,常规脱水,石蜡包埋切片,片厚6 μm。常规脱蜡脱水,用3%过氧化氢灭活内源性过氧化物酶,热修复抗原,滴加5%BSA封闭液,室温20 min,滴加1∶100稀释的一抗,4 ℃孵育过夜。滴加二抗37 ℃温箱孵育20 min,滴加SABC,37 ℃温箱20 min,DAB显色,苏木精复染,常规脱水封片。显微镜下观察拍照,采用Image-Pro-Plus 7.0图像分析系统测其平均光密度值。
1.2.3.3 Western Blotting法检测海马和皮层IDE、LRP1、RAGE等蛋白的表达情况 在冰盘上快速取出小鼠全脑,分离双侧海马及皮层,提取总蛋白,定量。取总蛋白样品25 μg,经SDS-PAGE电泳后,转膜,放入37 ℃恒温摇床,60 r/min,封闭1 h。将膜浸入用封闭液稀释的一抗(IDE 1∶200、LRP1和RAGE 1∶1 000),4 ℃恒温摇床,60 r/min孵育。TBST洗膜3次。将膜浸入用封闭液稀释的二抗(1∶10 000),37 ℃恒温摇床,60 r/min,孵育1 h。TBST洗膜3次。滴加ECL后放入暗盒曝光,扫描图片,Image J分析软件比较灰度值。
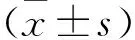
2 结果
2.1 LWDH和TLJN对2种模型小鼠行为功能学的影响
2.1.1 MWM逃避潜伏期的组间比较 与N组比较,2种模型组训练各天的逃避潜伏期均明显延长,差异有统计学意义(P<0.01);2种模型各观察组逃避潜伏期均随训练天数的增加而缩短,与N组比较,差异有统计学意义(P<0.05,P<0.01);AL组、AT组与A组比较,训练各天逃避潜伏期均缩短,差异有统计学意义(P<0.05),但AL组与AT组比较,差异无统计学意义(P>0.05);PL组与P组比较,从训练第2天起逃避潜伏期缩短,差异有统计学意义(P<0.05),但与PT组比较,差异无统计学意义(P>0.05)。见图1。
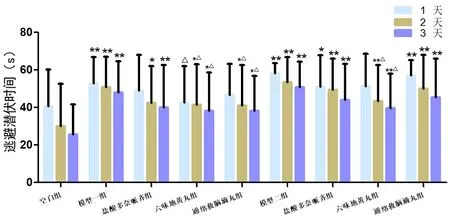
图1 各组小鼠的逃避潜伏期注:与N组比较,*P<0.05,**P<0.01;与各自模型比较,△P<0.05
2.1.2 MWM寻台成功率的组间比较 与N组比较,两模型各组寻台成功率均明显降低,差异有统计学意义(P<0.05,P<0.01),但各组随训练天数的增加寻台成功率均有提高趋势;与A组比较,AL组训练各天寻台成功率均提高,差异有统计学意义(P<0.05)。AL组和AT组之间差异无统计学意义;与P组比较,PL组从训练第2天起寻台成功率提高,差异有统计学意义(P<0.05,P<0.01)。与PT组比较,PL组训练各天的寻台成功率均较高,至第3天差异有统计学意义(P<0.01)。见图2。
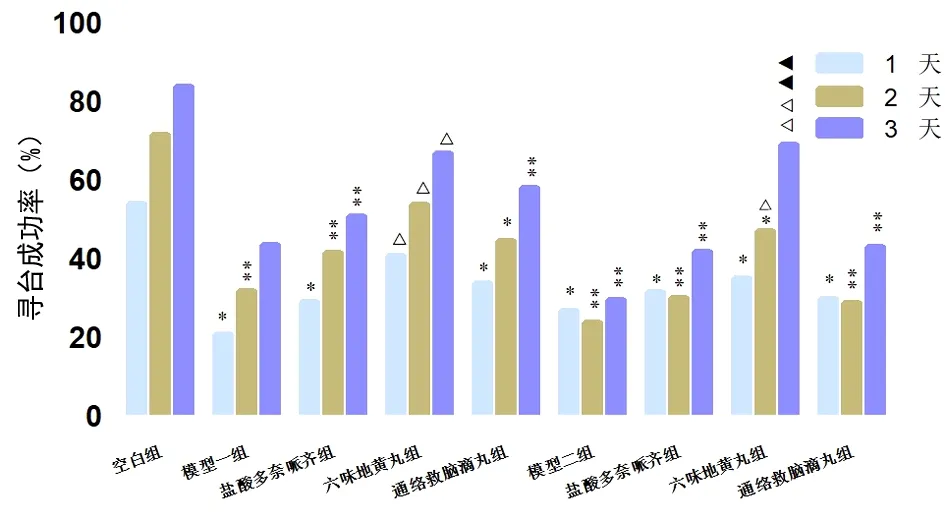
图2 各组小鼠的寻台成功率注:与N组比较,*P<0.05,**P<0.01;与各自模型比较,△P<0.05,△△P<0.01;与PT比较,▲▲P<0.01
2.1.3 MWM平均游速的组间比较 与N组比较,A模型各组游速差异无统计学意义(P>0.05);但P模型各组游速差异均有统计学意义(均P<0.01)。A模型与P模型组间游速差异有统计学意义(P<0.01)。见图3。

图3 各组小鼠的游速注:与N组比较,**P<0.01;2种模型之间,与A组比较,△△P<0.01
2.1.4 避暗实验结果分析 2种模型各组的避暗潜伏期均明显缩短,与N组比较,差异有统计学意义(P<0.01);单模型间,A模型中AT组与A组、AY组和AL组比较避暗潜伏期延长,差异均有统计学意义(均P<0.05);P模型中PL组与P组、PY组和PT组比较避暗潜伏期延长,差异有统计学意义(P<0.05,P<0.01)。见图4。
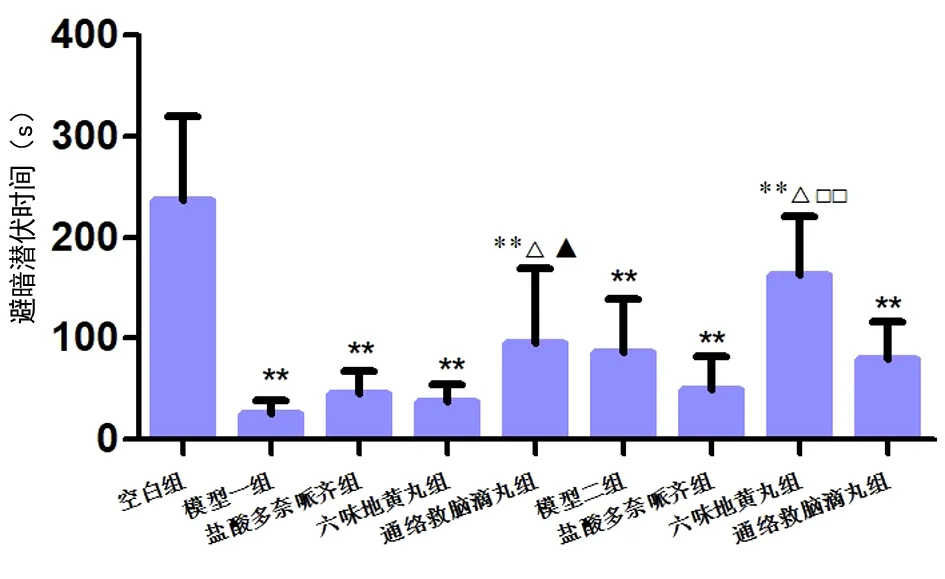
图4 各组小鼠的避暗潜伏期注:与N组比较,**P<0.01;与各自模型(A组/P组)比较,△P<0.05;与AL组比较,▲P<0.05;与PT组比较,□□P<0.01
2种模型各组的避暗错误次数有所增加,与N组比较,A组、AL组、P组和PT组错误次数增加,差异均有统计学意义(均P<0.05);单模型内,A模型中观察组与模型组比较,避暗错误次数均有不同程度减少,差异有统计学意义(P<0.01,P<0.05);P模型中观察组与模型组比较,避暗错误次数有减少趋势,差异无统计学意义(P>0.05);P组与A组比较,避暗错误次数减少,差异有统计学意义(P<0.05)。见图5。
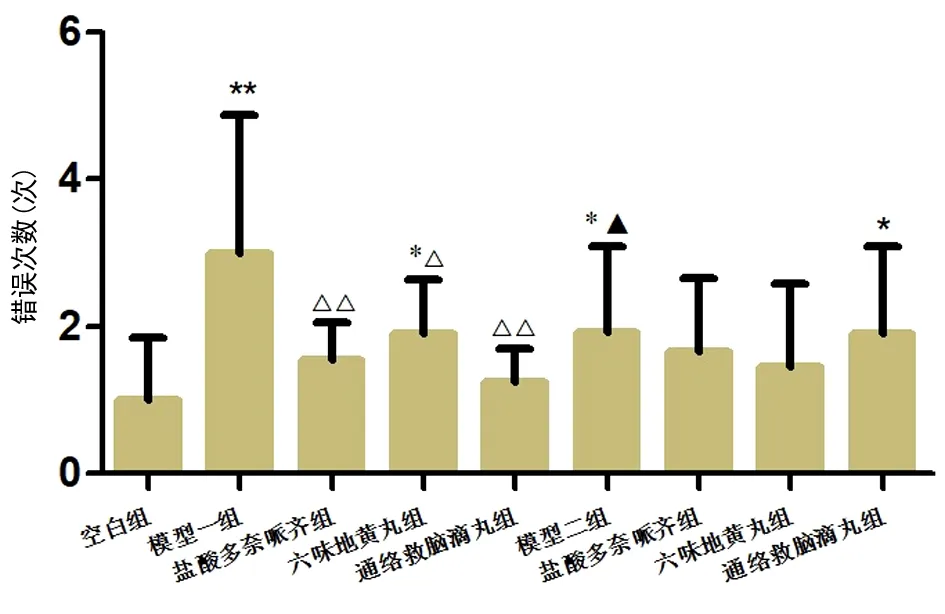
图5 各组小鼠的避暗错误次数注:与N组比较,*P<0.05,**P<0.01;与各自模型(A组/P组)比较,△P<0.05,△△P<0.01;2种模型之间,与A组比较,▲P<0.05
2种模型各组的避暗错误区时间均增加,与N组比较,仅A组避暗错误区时间增加,差异有统计学意义(P<0.01);单模型间,A模型中观察组与模型比较,避暗错误区时间减少,差异有统计学意义(P<0.01);P模型中各组避暗错误区时间差异无统计学意义(P>0.05);P组与A组比较,避暗错误区时间减少,差异有统计学意义(P<0.01)。见图6。

图6 各组小鼠的避暗错误区时间注:与N组比较,**P<0.01;与各自模型(A组/P组)比较,△△P<0.01;2种模型之间,与A组比较,▲▲P<0.01
2.2 LWDH和TLJN对2种模型小鼠脑组织皮层和海马Aβ的影响 在皮层和海马组织中,N组神经元形态完整,排列整齐,无明显Aβ阳性染色。A组、P组均可见少量Aβ阳性斑块,胶质细胞增生。A模型和P模型的各观察组Aβ阳性斑块有不同程度减少。见图7。
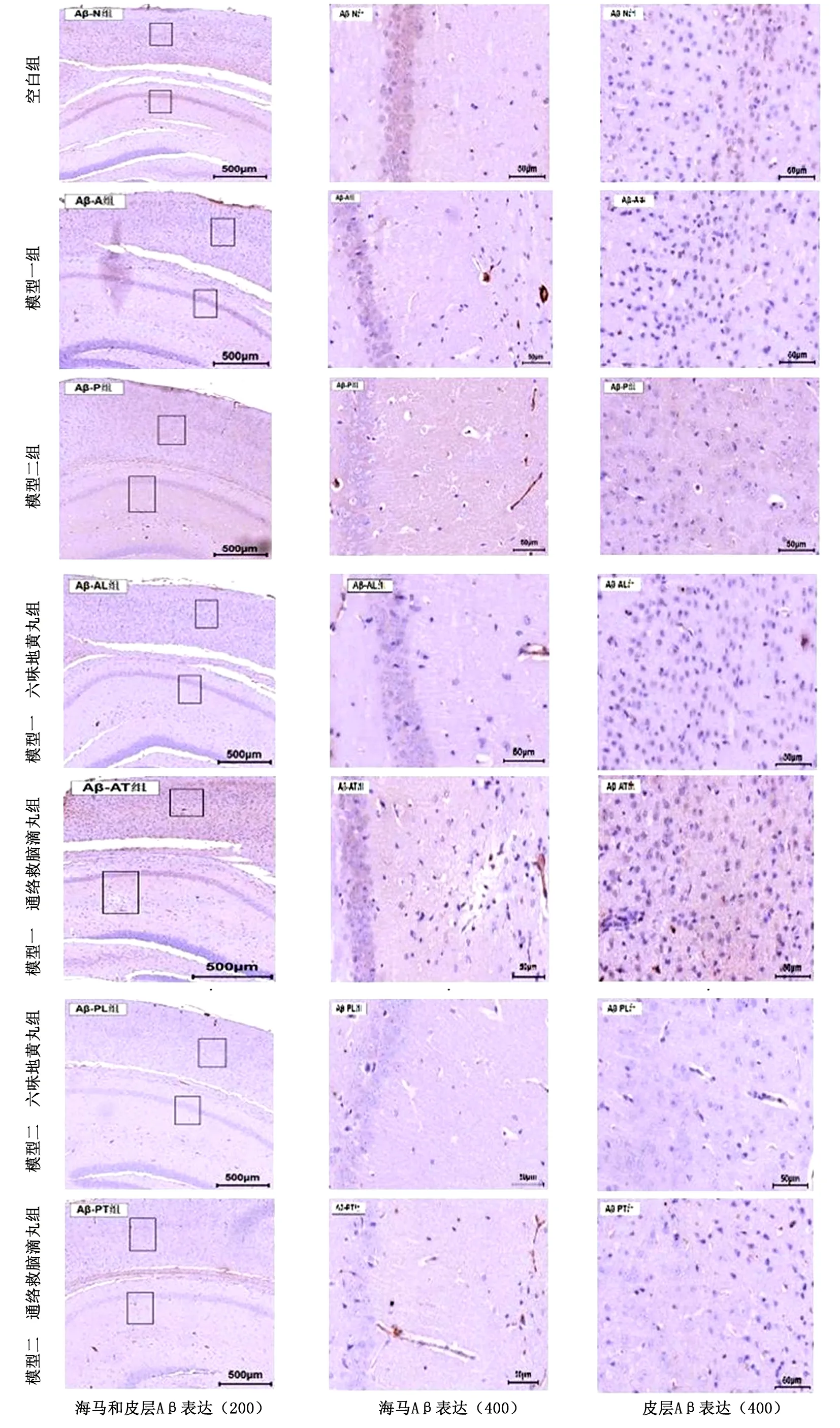
图7 各组小鼠脑组织海马与皮层Aβ的表达情况
在皮层组织中,仅A组Aβ蛋白表达与N组有不同程度增多,差异有统计学意义(P<0.05)。在海马组织中,除PL组外,其余各组Aβ蛋白表达与N组均有不同程度增多,差异有统计学意义(P<0.05,P<0.01)。与PT组比较,PL组海马Aβ蛋白表达降低,差异有统计学意义(P<0.01)。见图8。
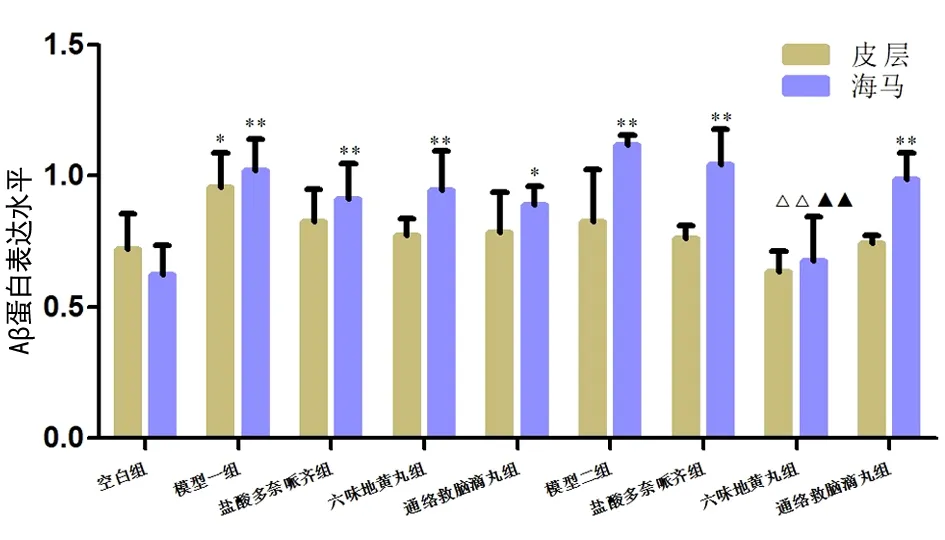
图8 各组小鼠脑组织皮层和海马中Aβ的表达水平注:与N组比较,*P<0.05,**P<0.01;与各自模型(A组/P组)比较,△△P<0.01;与PT组比较,▲▲P<0.01
2.3 LWDH和TLJN对2种模型小鼠脑组织皮层和海马IDE的影响 与N组比较,A组皮层、海马IDE表达升高,差异有统计学意义(P<0.01,P<0.05);P组皮层、海马IDE表达有降低趋势,但差异无统计学意义(P>0.05)。
经不同药物治疗后,AT组海马IDE表达降低至与N组无差异,且明显低于A组(P<0.01);AT组与AL组比较,海马组织IDE蛋白表达降低,差异有统计学意义(P<0.01);PL组皮层、海马IDE表达均明显升高,与N组、P组比较,差异有统计学意义(P<0.01);PL组与PT组比较,皮层、海马组织IDE蛋白表达均升高,差异有统计学意义(P<0.01)。
2种模型之间,与A组比较,P组皮层和海马IDE蛋白表达差异有统计学意义(P<0.01)。见图9~10。
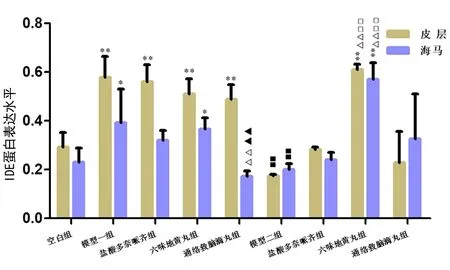
图9 各组小鼠脑组织皮层和海马中IDE的表达水平注:与N组比较,*P<0.05,**P<0.01;与各自模型(A组/P组)比较,△△P<0.01;与AL比较,▲▲P<0.01;与PT比较,□□P<0.01;2种模型之间,与A组比较,■■P<0.01
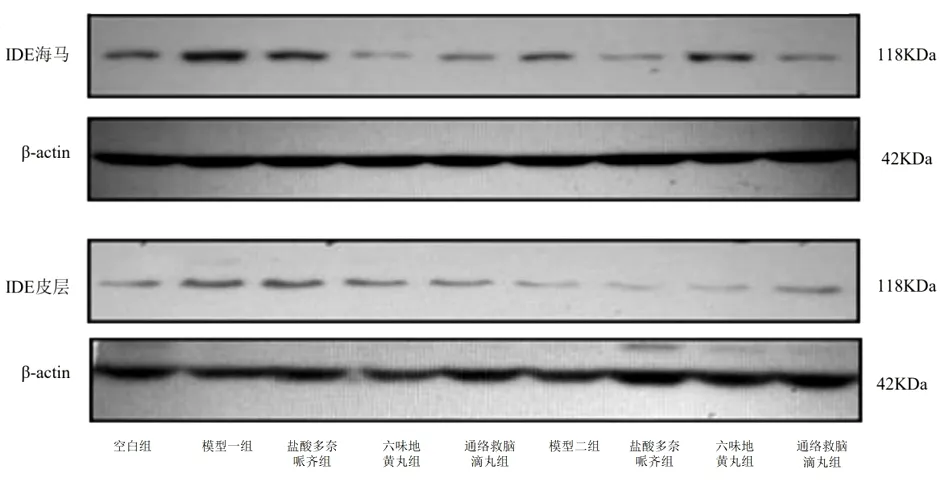
图10 Western Blotting法检测各组皮层和海马IDE表达情况
2.4 LWDH和TLJN对2种模型小鼠脑组织皮层和海马LRP1的影响 与N组比较,A组皮层LRP1表达降低,差异有统计学意义(P<0.01),而海马LRP1表达升高,差异有统计学意义(P<0.01);P组皮层、海马LRP1表达均降低,差异有统计学意义(P<0.01)。
经不同药物治疗后,AL组与AT组皮层、海马LRP1表达均比A组降低,差异有统计学意义(P<0.01,P<0.05);与AL组比较,AT组皮层LRP1表达升高,差异有统计学意义(P<0.01);PL组皮层、海马LRP1表达均升高,与P组比较,差异有统计学意义(P<0.01)。与PT组比较,PL组皮层、海马LRP1表达均有不同程度升高,差异均有统计学意义(均P<0.01)。2种模型之间,与A组比较,P组海马LRP1蛋白表达差异有统计学意义(P<0.01)。见图11~12。
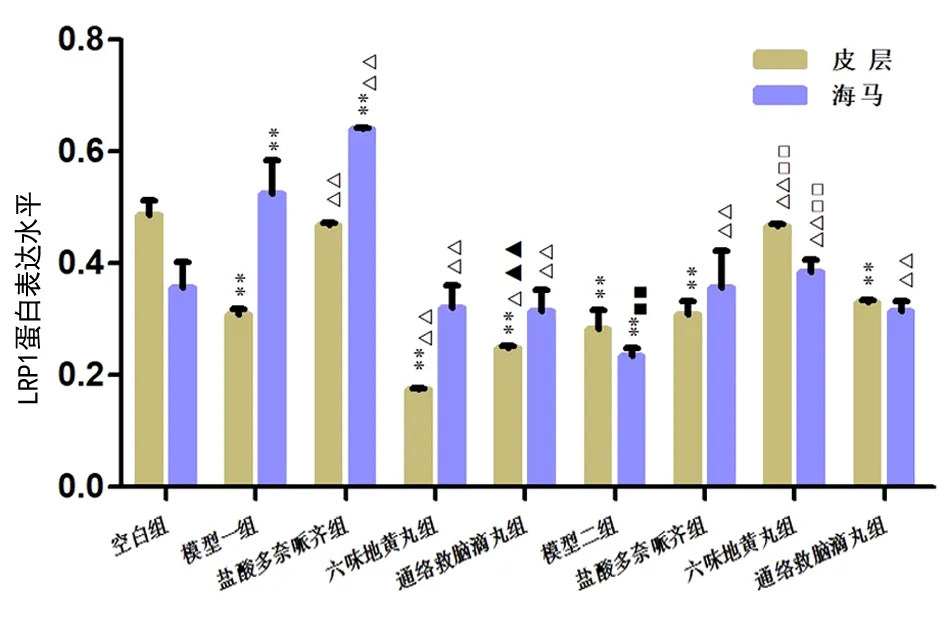
图11 各组小鼠脑组织皮层和海马中LRP1的表达水平注:与N组比较,**P<0.01;与各自模型(A组/P组)比较,△P<0.05,△△P<0.01;与AL比较,▲▲P<0.01;与PT组比较,□□P<0.01;2种模型之间,与A组比较,■■P<0.01
2.5 LWDH和TLJN对2种模型小鼠脑组织皮层和海马RAGE的影响 与N组比较,A组与P组皮层、海马RAGE表达均升高,差异均有统计学意义(均P<0.01)。经不同药物治疗后,AT组海马RAGE表达降低,与A组比较,差异有统计学意义(P<0.01)。AT组与AL组比较,海马RAGE表达降低,差异有统计学意义(P<0.01)。PL组皮层、海马RAGE表达降低,与P组比较,差异有统计学意义(P<0.01),但皮层RAGE表达降低至与N组无差异;PL组与PT组比较,皮层RAGE表达降低,差异有统计学意义(P<0.05)。2种模型之间,P组与A组比较,皮层和海马RAGE蛋白表达均更高,差异有统计学意义(P<0.01,P<0.05)。见图12~13。
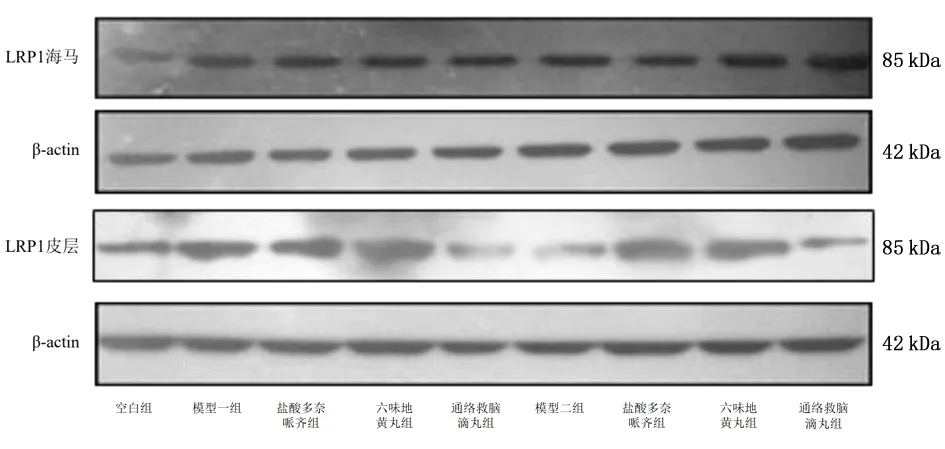
图12 Western Blotting法检测各组皮层和海马LRP1表达情况

图13 各组小鼠脑组织皮层和海马中RAGE蛋白的表达水平注:与N组比较,**P<0.01;与各自模型(A组/P组)比较,△P<0.05,△△P<0.01;与AL组比较,▲▲P<0.01;与PT组比较,□P<0.05;2种模型之间,与A组比较,■P<0.05,■■P<0.01
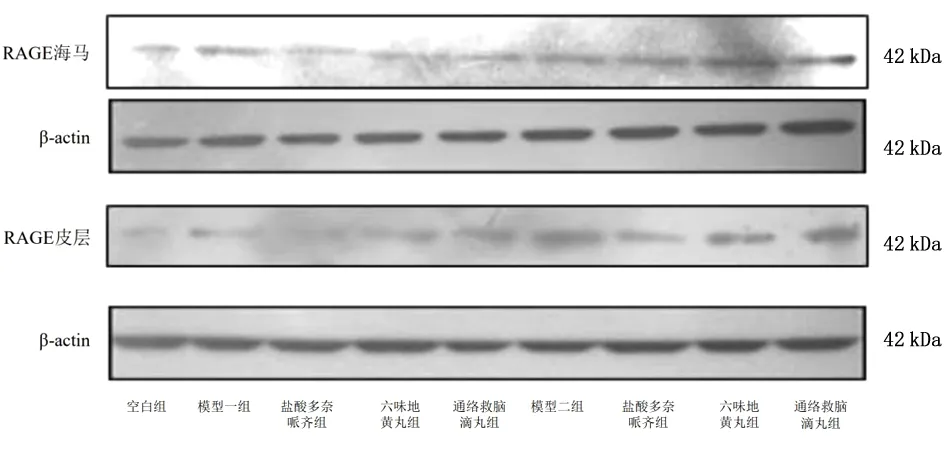
图14 Western Blotting法检测各组皮层和海马RAGE表达情况
3 讨论
痴呆是一种随着年龄增长、病情不断加重的神经退行性疾病[1],历代医家认为肾精亏损,脑髓化生不足为其主要病因,临床上以益精填髓为主要治法[2]。Aβ1-40通过损伤细胞器及细胞骨架而对神经细胞产生毒性作用,引起海马前炎症介质表达增多、氧化反应增强,触发AD病变级联反应,引发空间记忆障碍,学习记忆能力减退[3]。SAMP8小鼠是快速老化小鼠品系中的一个亚系,主要以学习、记忆障碍为主要特征,是目前公认的自然衰老痴呆模型[4]。本实验通过双侧海马注射Aβ1-40和自然饲养至32周龄的SAMP8小鼠复制痴呆动物模型,与空白对照组比较,2种模型组小鼠的逃避潜伏期明显延长,寻台成功率降低,避暗潜伏期缩短,说明2种模型小鼠均出现了痴呆症状。且双侧海马注射Aβ1-40模型组和32周龄SAMP8小鼠在实验过程中均死亡了2只,两模型组间差异无统计学意义。
现代医学研究表明,生理条件下外周和中枢内Aβ水平保持平衡[5]。若脑内Aβ清除功能下降,导致Aβ在脑内堆积,则引发突触功能异常、神经元凋亡等多种病理反应[6]。IDE在清除脑内Aβ的过程中起重要作用,其表达升高与Aβ斑块减少有直接关系[7]。LRP1是低密度脂蛋白受体家族成员之一,LRP1通过与Aβ直接结合,或通过LRP1配体与Aβ结合后,将脑内Aβ转运至血液[8-10]。RAGE是一种多功能受体,属免疫球蛋白超家族,广泛分布于内皮细胞、单核巨噬细胞、神经元及小胶质细胞等表面,是BBB上将Aβ从血液转运入脑组织的主要受体[11-14],与LRP1是一对作用相反的蛋白。BMECs细胞膜上的RAGE与Aβ结合后,可促使Aβ穿过BBB后在脑内积聚[15],并激活小胶质细胞,产生氧化应激反应,生成ROS,促进凋亡,同时促进炎症介质的表达,引起炎症反应[16-18]。另外,神经元和小胶质细胞上的RAGE也可与Aβ结合,激活小胶质细胞,引发AD相关病理过程[19-21]。
本研究结果表明,2种模型在神经行为学的水迷宫游速、避暗实验错误次数、错误区时间等活动度相关指标,和脑组织海马和皮层中IDE、RAGE和海马中LRP1等蛋白的表达上,差异均有统计学意义(均P<0.05)。SAMP8模型小鼠的水迷宫游速和避暗错误次数下降,脑组织中RAGE表达升高,IDE和LRP1表达降低,反映了肾虚精乏证模型的Aβ代谢障碍更严重。给予LWDH和TLJN治疗后,TLJN对改善双侧海马注射Aβ1-40模型小鼠的避暗潜伏期、脑组织海马区IDE和RAGE的表达水平作用明显,而LWDH对上述指标的调节作用不如TLJN;LWDH对改善SAMP8模型小鼠水迷宫寻台成功率、避暗潜伏期、脑组织皮层和海马区IDE表达和海马Aβ的表达水平,发挥了显著作用,而TLJN对上述指标的调节作用不如LWDH。由此说明,六味地黄丸可改善“肾精不足”痴呆模型动物脑组织Aβ清除障碍,通络救脑滴丸可改善“毒损脑络”痴呆模型动物脑组织Aβ清除障碍,而非对症治疗未发挥显著改善作用,甚至还有反作用。通过以方测证,证明了SAMP8小鼠作为“肾精不足”证和双海马注射Aβ1-40小鼠作为“毒损脑络”证的痴呆模型。
利益冲突声明:无。

