利用CRISPR/Cas9技术构建MDH2敲除细胞株及抗呕吐毒素效应研究
施炜涛 姚春鹏 魏文康 王蕾 房元杰 仝钰洁 马晓姣 蒋文张晓爱 邵伟
(1.新疆农业大学动物科学学院,乌鲁木齐 830052;2.广东省农业科学院农业生物基因研究中心 广东省农作物种质资源保存与利用重点实验室,广州 510640;3.广东省农业科学院蔬菜研究所 广东省蔬菜新技术研究重点实验室,广州 510640)
呕吐毒素又名脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON),属于B型单端孢霉烯族毒素,作为一种广泛存在于谷物和动物饲料以及食品中的真菌毒素,可由禾谷镰刀菌、亚洲镰刀菌等多种镰刀菌产生[1-2]。受到霉菌污染的玉米、小麦、大豆等饲料原料及青贮饲料中均存在不同浓度的DON[3-4]。在对陕西、新疆、甘肃和宁夏4省收获的小麦进行DON含量及流行率检测,结果显示82.9%的样品受到DON污染,平均浓度达500 μg/kg,根据我国规定的DON标准(中国国家标准GB2761-2017),其中10%的阳性样品超过1 000 μg/kg的最大限值[1]。对多地的饲料及原料取样监测分析,其中玉米及其副产品均有不同程度的DON污染[5]。一份对猪饲料样品的霉菌毒素含量检测报告显示,DON在不同品种猪饲料中含量普遍偏高,其中空怀母猪料和育肥料中DON含量高于国家规定[6]。
DON属于剧毒或中等毒物的范畴,对人和动物具有广泛的毒性效应,具体表现为呕吐、炎症、消化道出血,甚至死亡[7-8]。猪是对DON最敏感的动物之一,其次为小鼠、大鼠、家禽和反刍动物[9]。DON不仅对猪肠道具有局部毒性,而且会导致许多肠道功能失调并削弱免疫反应,减少采食量和体重增加[10]。摄入含DON的饲料时,猪的肠道会出现绒毛顶端坏死、多灶性萎缩和绒毛融合、固有层水肿、肠细胞胞浆空泡化、十二指肠绒毛高度降低和肠道细胞溶解等情况[11]。而当饲料中同时存在呕吐毒素和其他霉菌毒素如镰刀菌酸时,相互之间会产生协同和相加效应,混合物整体的毒性增强,出现呕吐、拒食、生长缓慢等现象[12-16]。
近年来已报道多个与DON毒性有关的基因,王海飞等[16]利用CRISPR/Cas9敲除文库筛选到THEM5等DON抗性重要候选基因。许写等[17]通过构建了稳定干扰METTL3基因表达水平的IPEC-J2细胞系,发现降低该基因的表达水平可以抵抗由DON诱发的细胞凋亡和炎症。Xu等[18]研究报道SLC4A11和MFSD3基因的过表达能够增强DON处理下IPEC-J2细胞的活力。
苹果酸脱氢酶2(MDH2)是线粒体中三羧酸循环(TCA)的关键酶之一,利用催化H+从苹果酸的羟基转移至NAD+上,以实现苹果酸和草酰乙酸之间的可逆转化,在乙醛酸旁路、氨基酸合成、糖的发生和氧化/还原平衡等代谢途径也发挥重要作用。MDH2以二聚体形式存在,单体分子量35.6 kD左右,包含5个NAD+结合位点和1个质子结合位点[19]。已有研究报道MDH2与癌症有密切联系,MDH2能够通过抑制PTEN增强子宫内膜癌细胞的增殖、迁移和侵袭[20]。刺激MDH2能够激活AKT通路,从而导致非小细胞肺癌(NSCLC)的转移和侵袭[21]。在前列腺癌细胞中也检测到MDH2的表达升高[22]。此外,MDH2被确定为是嗜铬细胞瘤和副神经节瘤的易感基因[23]。但目前尚未报道MDH2和毒素之间的存在联系。
前期我们利用CRISPR文库筛选了呕吐毒素诱导细胞死亡的相关基因发现,MDH2是候选基因之一。但目前对于MDH2基因对于DON的影响在国内外期刊中并没有相关报道,因此本研究采用CRISPR/Cas9系统构建猪MDH2基因稳定敲除的IPEC-J2细胞株,并检测了MDH2基因抗DON毒性效应的影响,为后续深入探究MDH2基因对DON的毒性作用机制奠定基础。MDH2基因后续可以作为抗DON的靶标,基因敲除或针对该靶标开发相关药物,可降低DON对肠道细胞的损伤以及对人和动物的毒性,在医疗和畜牧业中具有潜在应用价值。
1 材料与方法
1.1 材料
IPEC-J2细胞系由本研究室保存;呕吐毒素和二甲基亚砜(DMSO)购自Sigma公司;pSpCas9-2A-Puro(PX459)V2.0质粒购自淼灵生物科技有限公司;P3 Primary Cell 4D-NucleofectorTMX Kit转染试剂盒购自Lonza公司;T4连接酶、T4 PNK、10×T4连接缓冲液、限制性核酸内切酶BbsI购自New England Biolabs公司;大肠杆菌E.coliDH 5α感受态细胞购自北京金沙生物科技有限公司;无内毒素质粒提取试剂盒购自天根生物公司;胎牛血清FBS、胰酶、DMEM/F12培养基、嘌呤霉素购自Gibco公司;青霉素-链霉素双抗购自Hyclone公司;磷酸盐缓冲液(PBS)购自Procell公司;通用型RNA提取试剂盒购自艾科瑞生物技术有限公司;一抗Anti-MDH2购自HUABIO公司;Anti-Tubulin购自Cell Signaling Technology公司;二抗Goat Anti-Mouse IgG(H+L)HRP和Goat Anti-Rabbit IgG(H+L)HRP购自Affinity 公司;动物组织/细胞基因组DNA提取试剂盒购自索莱宝公司;CCK8(cell counting kit-8)试剂盒购自Apexbio公司;YO-PRO-1/PI细胞凋亡与坏死检测试剂盒购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1 细胞培养 DMEM/F12完全培养基包含10%FBS和1%双抗,IPEC-J2细胞接种于25 cm2底面积培养瓶中,放在37℃、5% CO2的细胞培养箱内培养。
1.2.2 DON的配制 用DMSO将DON粉末溶解,用0.22 μm滤膜过滤,配成5 mg/mL母液。再分别用DMEM/F12完全培养基配成浓度分别为4、2、1和0.5 μg/mL的DON溶液,整个过程在生物安全柜中完成。
1.2.3 猪MDH2基因sgRNA的设计 针对猪源MDH2基因(NCBI Gene ID: 397039)使用CRISPR DESIGN(http://crispr.mit.edu)网站进行设计,根据评分选取位于外显子9126-9203区域的sgRNA。并在sgRNA的5'端添加CACCG,形成正向Oligo DNA(sgRNA-MDH2-F),在反向Oligo DNA(sgRNAMDH2-R)的3'端添加C,在5'端添加AAAC(表1)。
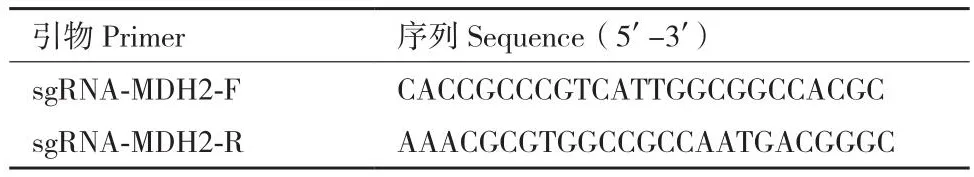
表1 MDH2靶向位点及sgRNA寡核苷酸序列Table 1 MDH2 targeting sites and sgRNA oligonucleotide sequences
1.2.4 猪MDH2基因编辑载体的构建及阳性克隆的筛选 首先将以上正链Oligo DNA(sgRNAMDH2-F)和负链Oligo DNA(sgRNA-MDH2-R)退火形成dsDNA,反应体系:正负链Oligo DNA各1 μL,10×T4 连接缓冲液1 μL,T4 PNK 0.5 μL,补H2O至10 μL,离心后置于PCR反应仪中进行反应(37℃ 30 min;95℃ 5 min)。取退火后形成的dsDNA与PX459载体连接,酶切与连接反应体系:PX459质粒模板25 ng,dsDNA和10×T4连接缓冲液各1 μL,BbsI和T4连接酶各0.5 μL,加入ddH2O补至10 μL体系,各成分离心后置于PCR反应仪中进行反应(37℃ 5 min;23℃ 5 min,25循环)。
放置连接产物和感受态细胞混合物于冰上30 min后42℃水浴热击90 s,经过冰浴冷却5 min后,加入普通的LB液体培养基,置于37℃振荡培养1 h,使细菌表达质粒编码的Amp抗性基因并恢复到正常生长状态;将菌液均匀涂布于含Amp的LB固体培养平板上,将培养皿倒置于37℃培养箱过夜培养。用含Amp的LB液体培养基对挑取的若干单菌落扩大培养,并提取质粒送至生工使用U6启动子进行测序。
1.2.5 基因编辑载体的转染及嘌呤霉素的筛选 用DMEM/F12完全培养基培养IPEC-J2细胞,置于37℃、5%的CO2培养箱中培养,待细胞密度达到70%-80%时,用胰酶将细胞消化下来,使用Lonza电转仪将上述构建的基因编辑载体导入细胞核中。用浓度为4 μg/mL嘌呤霉素的完全培养基连续筛选7 d,每2 d更换新鲜的含嘌呤霉素完全培养基,同时以IPEC-J2细胞作为对照组进行观察。待对照组完全死亡后用胰酶将存活的混合克隆细胞群消化下来,使用有限稀释法稀释成单克隆细胞于96孔板中。
1.2.6 单克隆细胞的筛选 待96孔板中的单克隆细胞团生长至一定数量,转移至24孔板中进一步扩大培养,再进一步扩大至6孔板中,提取细胞的基因组DNA,设计特异性引物并进行高保真PCR,将PCR产物送至生工进行测序。引物序列请见表2。
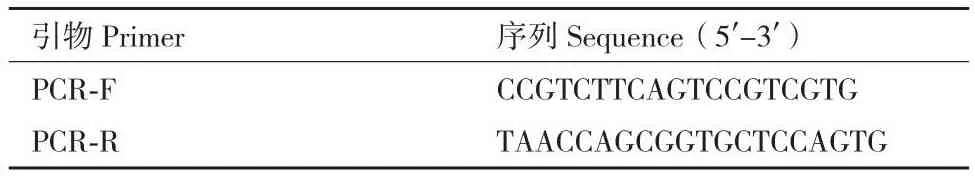
表2 MDH2基因PCR测序引物Table 2 Primers for PCR sequencing of MDH2 gene
1.2.7 RT-qPCR检测细胞中MDH2基因的表达水平 提取野生型IPEC-J2细胞和MDH2-KO细胞的RNA,通过逆转录为cDNA,加入到荧光定量PCR 96孔板之中,使用设计的引物进行扩增,94℃预变性30 s;94℃变性5 s、57℃退火15 s、72℃延伸10 s并收集荧光信号,共40个循环。每个样品设计5复孔,并以β-actin作为参照基因,用相对定量法对结果进行分析。引物序列请见表3。
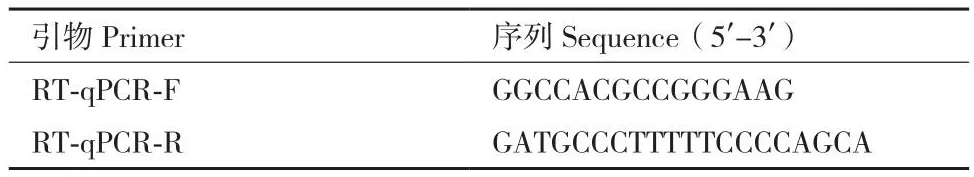
表3 MDH2基因RT-qPCR引物Table 3 RT-qPCR primers for MDH2 gene
1.2.8 Western Blot检测细胞中MDH2蛋白的表达水平 将野生型IPEC-J2细胞和MDH2-KO细胞分别培养于六孔板中,等待长满全孔后弃去培养基,用PBS清洗两遍后使用细胞裂解液裂解细胞,冰上孵育10 min后离心取上清,加入上样buffer,100℃煮样10 min获得蛋白样品。对照组和试验组分别各取15 μg蛋白样品通过10%的电泳胶进行分离,并转移至PVDF膜上,使用5%脱脂奶粉溶液室温封闭后,TBST洗去剩余奶粉,一抗Anti-MDH2(1∶1 000稀释)于4℃孵育过夜,TBST洗膜4次,每次20 min。用1∶6 000稀释的二抗Goat Anti-Rabbit IgG(H+L)HRP与膜在室温下孵育1 h,TBST洗膜4次,每次20 min。显影液漂洗后用化学发光仪显色拍照,以Tubulin为内参蛋白。
1.2.9 MDH2-KO在DON处理后的细胞活力测定 将野生型IPEC-J2细胞和MDH2-KO细胞以每孔2×104的密度接种96孔培养板,待细胞生长到合适密度,每孔加入不同DON浓度的完全培养基。每组加入等量100 μL含4、2、1、0.5和0 μg/mL DON浓度的完全培养基,每组浓度复5孔,充分混匀板中各孔的液体。第3天更换一次含不同浓度DON的完全培养基,并每天观察细胞状态,在37℃,5% CO2的细胞培养箱中培养5 d。
用CCK8试剂测定细胞活力,在96孔板中选取5个无细胞孔,每孔加入100 μL DMEM/F12完全培养基,以获得背景发光值。向96孔板中有液体的每个孔中加入10 μL CCK8试剂溶液,将96孔板置于37℃细胞培养箱中孵育1 h,酶标仪测量在450 nm处的OD值。
细胞活力计算公式:
细胞活力(%)=(实验组OD-背景值OD)/(对照组OD-背景值OD)×100%
1.2.10 MDH2-KO在DON处理后细胞死亡率检测 野生型IPEC-J2细胞和MDH2-KO细胞接种于六孔板培养板中,置于37℃、5%的CO2细胞培养箱内培养。待细胞长到合适密度,每孔更换为等量2 mL含4、2、1、0.5和0 μg/mL DON的完全培养基,第3天更换一次含不同DON浓度的完全培养基,共处理5 d。
将对照组和试验组贴壁细胞用15%胰酶消化后用完全培养液重悬,并用PBS洗涤一次。对于上一步骤的每个沉淀加入500 μL YP1/PI检测工作液,并重悬为单细胞悬液。放入37℃培养箱中避光孵育20 min。准备仅含缓冲液的细胞样品用作流式细胞仪检测时的阴性对照,该缓冲液与配制YP1/PI检测工作液的缓冲液宜保持一致。同时准备YP1和PI的单染样品用于调节补偿。孵育完成后,可以直接进行流式细胞仪检测(YP1染色阳性细胞为绿色荧光,Ex/Em=491/509 nm;PI染色阳性细胞为红色荧光,Ex/Em=535/617 nm),整个过程均需避光操作。将染色后的样品置于冰上,并在1 h内进行流式细胞仪检测和分析。
2 结果
2.1 MDH2基因编辑载体的构建
合成的sgRNA单链经退火形成双链,将其与PX459空载体经限制性内切酶BsbI酶切后的线性载体片段连接,构建重组质粒。从载体U6启动子后开始测序,结果显示插入PX459载体的碱基序列与设计的sgRNA序列完全一致,表明重组质粒构建成功,测序结果如图1所示,命名为PX459-sgRNA-MDH2。
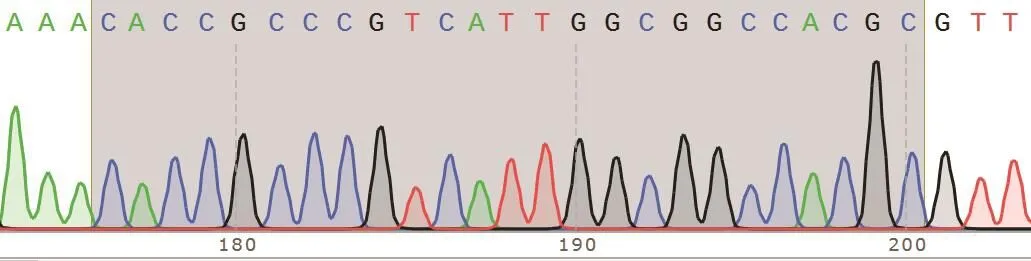
图1 重组质粒PX459-sgRNA-MDH2测序峰图Fig.1 Sequencing peak of recombinant plasmid PX459-sgRNA-MDH2
2.2 MDH2-KO细胞株的构建与验证
通过单克隆稀释和扩大培养,并挑选10株单克隆细胞提取基因组DNA,将通过高保真PCR所得产物送至公司测序。测序结果显示其中一株为单峰(图2),且与野生型MDH2基因(图3)相比缺失5 bp碱基(图4),这种缺失突变可导致基因开放阅读框改变、翻译提前终止。与IPEC-J2野生型细胞株相比,该细胞株的mRNA表达水平显著降低,且组内mRNA表达水平差异有统计学意义(P<0.001)。单克隆细胞蛋白样品的Western blot鉴定结果见图5-B,与野生型IPEC-J2细胞相比,筛选得到的细胞株中MDH2蛋白表达水平几乎完全丧失。结合基因组PCR产物测序及Western blot实验结果,认为该单克隆细胞系中目的基因被完全敲除且为单克隆,命名MDH2-KO。
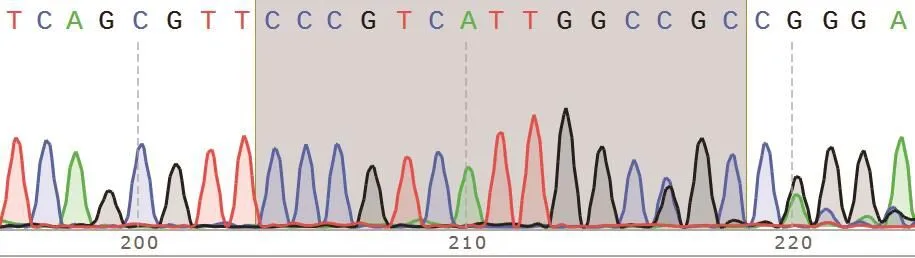
图2 MDH2-KO细胞系CRISPR靶位点测序峰图Fig.2 Sequencing peaks of CRISPR target sites in MDH2-KO cell line
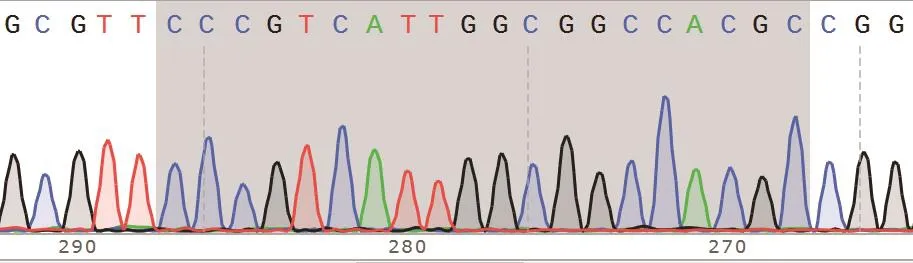
图3 MDH2野生型IPEC-J2细胞系CRISPR靶位点测序峰图Fig.3 Sequencing peaks of CRISPR target sites in MDH2 wild-type IPEC-J2 cell line
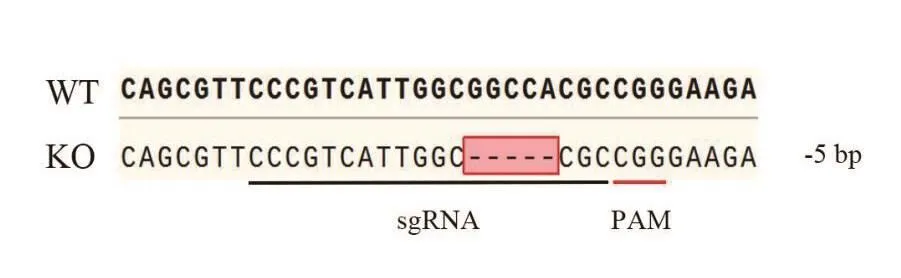
图4 野生型IPEC-J2细胞与MDH2-KO序列比对图Fig.4 Sequence comparison of wild-type IPEC-J2 cells with MDH2-KO
2.3 MDH2基因的敲除对IPEC-J2抗呕吐毒素毒性效应的影响
2.3.1 CCK8检测发现MDH2基因的敲除提高DON处理后的细胞活力 将野生型IPEC-J2细胞和MDH2-KO细胞系分别以每孔2×104的密度接种于96孔培养板中,用呕吐毒素(4、2、1和0.5 μg/mL)处理5 d后,用CCK8试剂测定细胞活力。发现MDH2-KO细胞系与野生型IPEC-J2细胞相比,在DON浓度为4、2、1和0.5 μg/mL的条件下细胞活力分别极显著提高18.67%(***P< 0.001)、19.59%(***P< 0.001)、26.36%(***P< 0.001)和27.01%(***P< 0.001)(图6)。表明敲除MDH2基因后可增强IPEC-J2细胞对呕吐毒素的耐受性。
2.3.2 流式检测发现MDH2基因的敲除降低DON处理后的细胞死亡率 不同浓度DON对IPEC-J2细胞和MDH2-KO细胞的死亡率影响结果如图7所示,经过YP1/PI染色和流式细胞仪检测,正常活细胞为Q4区域(YP1-/PI-),凋亡细胞的细胞核被染为绿色位于Q3区域(YP1+/PI-),坏死细胞的细胞核被染为红色位于Q1和Q2区域(YP1-/PI+和YP1+/PI+)。与野生型细胞相比,敲除MDH2使不同浓度DON(4、2、1和0.5 μg/mL)作用5 d条件下细胞死亡率分别极显著降低30.33%(***P< 0.001)、15.81%(***P< 0.001)、16.00%(***P< 0.001)和14.7%(***P< 0.001)。表明敲除MDH2基因后可增强IPEC-J2细胞对呕吐毒素的抗性。
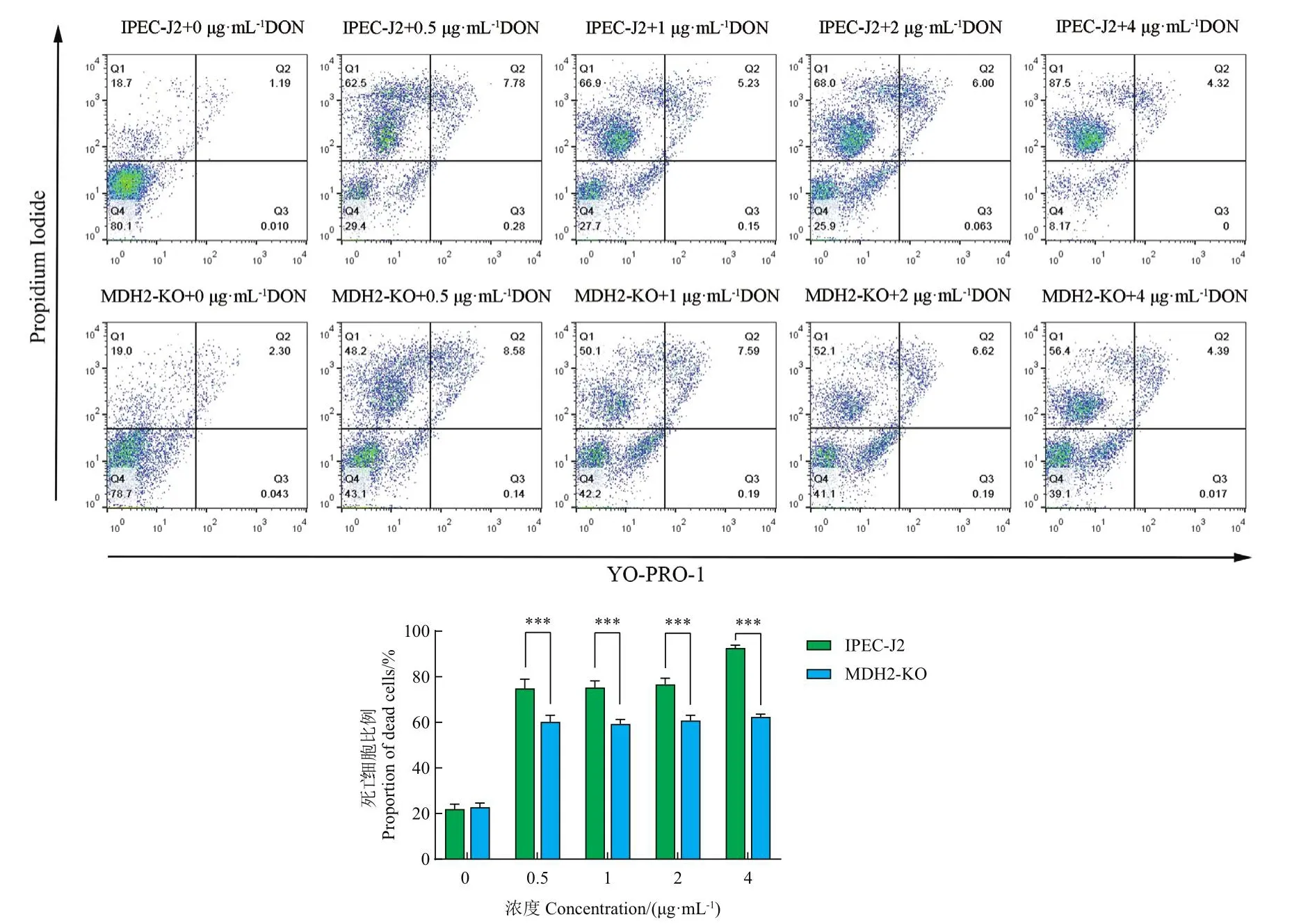
图7 流式检测DON处理后IPEC-J2和MDH2-KO的细胞死亡率Fig.7 Flow assay of cell mortality of IPEC-J2 and MDH2-KO after DON treatment
3 讨论
本研究表明MDH2在DON诱导的细胞死亡毒性中发挥重要作用。DON毒性机制包括:诱导细胞活性氧(ROS)和活性氮(RNS)积累引起氧化应激及脂质过氧化,破坏DNA结构[24];促进凋亡蛋白Caspase家族表达引起细胞凋亡[25];与rRNA结合后激活p38、JNK、ERK1/2、MAPKS等信号通路抑制蛋白质合成影响细胞功能[26]。许多研究发现DON处理后细胞的ROS水平提高,与细胞凋亡和炎症相关的基因及蛋白表达增加[27-28]。而由DON处理提高的ROS会破坏线粒体膜结构,导致通透性增加,凋亡因子Cyt-c释放进入细胞质内,并激活下游Caspase凋亡蛋白家族,引发细胞凋亡[29]。此外,DON对前列腺癌细胞的作用与NF-κB/HIF-1α信号转导有关,并以剂量依赖的方式显著增加HIF-1α的表达[30]。
MDH2既在能量代谢过程中发挥关键作用,也与细胞死亡调控有密切联系。MDH2作为TCA循环的关键酶利用NAD-NADH辅酶系统催化苹果酸可逆地氧化为草酰乙酸,产生的NADH作为氧化磷酸化的还原当量,是细胞ATP生物合成、耗氧的基本过程,但同时也能为mETC提供电子诱导ROS的产生并启动细胞死亡过程[31-35]。Zhao等[36]发现敲除MDH2基因能够显著降低苹果酸处理后HeLa细胞中的ROS水平和细胞凋亡,表明MDH2在调节细胞凋亡过程中起着至关重要的作用。Wang等[37]报道了MDH2基因的突变会阻止Caspase-3活化和果蝇幼虫唾液腺细胞死亡,并导致细胞的ATP水平降低。抑制MDH2可降低肾小管上皮细胞缺氧-复氧状态下HIF-1α水平和氧化应激,并减少细胞凋亡和铁性细胞死亡,表明MDH2也可以通过调控HIF-1α相关的信号途径来调控细胞死亡[38]。
综上可见,DON与MDH2在调控细胞死亡方面存在共同的信号途径,本研究揭示了MDH2基因的敲除赋予IPEC-J2细胞抗呕吐毒素的能力,能减少呕吐毒素诱导的细胞死亡。我们推测MDH2基因的敲除可能通过降低ROS的水平、抑制Caspase凋亡蛋白和下调HIF-1α的表达,从而减少细胞死亡降低呕吐毒素对细胞的毒性。而MDH2基因在这些途径中具体发挥哪些功能还需进一步深入研究。
4 结论
本研究利用CRISPR-Cas9基因编辑技术成功制备出猪MDH2基因敲除的IPEC-J2单克隆细胞系,并通过细胞活力和细胞死亡检测,证明敲除MDH2基因能使细胞具有抗呕吐毒素毒性效应的能力。