单细胞水平解析人牙龈间充质干细胞异质性
吴昊 刘紫微 郑颖 戴雅文 时权
(解放军总医院第一医学中心口腔科,北京 100853)
间充质干细胞(mesenchymal stem cells,MSCs)的优良生物学特性给人类疾病治疗带来了新希望,显现出巨大应用潜力。但越来越多的研究证实MSCs内部具有异质性,常规群体水平的测序分析往往无法反映MSCs最真实的特征[1]。而缺乏对MSCs功能异质性的全面了解,严重阻碍了MSCs有效的、可复制的临床应用[2]。单细胞测序技术是在单个细胞水平上,对基因组、转录组、表观组进行高通量测序,利用生物信息学分析,挖掘单细胞水平基因组的生物学意义,揭示单个细胞的基因结构和基因表达状态,反映细胞间的异质性,在发掘新的疾病诊断标志物、分辨细胞亚型、差异基因等方面具有独特的优势[3-4],为探究MSCs内部的功能异质性提供了可能[5]。
牙龈干细胞(gingival mesenchymal stem cells,GMSCs)是从牙龈固有层中提取的间充质干细胞[6],其不但容易获得、来源丰富,而且具有良好的生物学功能,在组织工程、再生医学、免疫疾病治疗方面展现了较好的应用前景[7]。本研究拟分离培养人GMSCs,利用单细胞转录组测序(single cell RNA sequencing, scRNA-seq)技术对GMSCs进行分析,从微观角度分析GMSCs内部的功能异质性,为GMSCs的精准化应用提供理论与实验基础。
1 材料与方法
1.1 材料
1.1.1 材料 细胞培养皿、离心管(NEST,中国);α-MEM、胎牛血清(GIBCO,美国);Dispase、IV胶原酶、胰蛋白酶(Sigma,美国);PBS(碧云天,中国);CCK-8(同仁,日本);CD73-PE、CD29-APC、CD90-FITC、CD105-APC、CD31-PE、HLA-DRFITC抗体(BD Biosciences,美国)、台盼蓝(碧云天,中国);10×Genomics Single Cell 3'v3试剂盒(10×Genomics公司,美国)。
1.1.2 仪器 倒置显微镜(Nikon,日本);酶标仪(Thermo Fisher,美国);流式细胞仪(BD Biosciences,美国); 10×Genomics测序仪(10×Genomics公司,美国)。
1.2 方法
1.2.1 GMSCs分离培养及鉴定 人牙龈组织来自我院口腔科接受智齿拔除术、阻生尖牙导萌术的患者。患者既往体健,无传染病、慢性病、牙周疾病,牙龈组织经患者同意后获得,临床实验标本的获得经过解放军总医院伦理委员会批准。根据本课题前期的方法提取人GMSCs[8-10],简要步骤为:获得牙龈组织立即至于含4×双抗的α-MEM培养基中并转移至超净工作台,PBS漂洗3-5次后放在2 mg/mL的Dispase酶中4℃消化12 h。随后分离牙龈,收集固有层皮片剪碎,IV型胶原酶37℃消化1 h,1 000 r/min离心5 min,弃上清。将细胞重悬后至于10 cm细胞培养皿中,用含10% FBS、2×双抗、2 mol/L L-谷氨酰胺的α-MEM培养基中,37℃、5% CO2的环境下培养。6 h后弃除原培养基及未贴壁的细胞,加入新鲜培养基继续培养。细胞汇合率达80%时,1∶4传代培养。取P3代GMSCs,消化离心后PBS重悬细胞,调整细胞密度为1×106个/mL,流式细胞仪检测细胞表面标记物CD90、CD73、CD29、CD105、CD31、HLA-DR。将GMSCs按2×103/孔的密度接种96孔板,CCK-8法测定GMSCs增殖曲线。
1.2.2 单细胞测序样本制备 取生长良好的P3代GMSCs,用PBS洗涤2遍,加入0.125%无EDTA胰酶消化细胞,离心、弃上清,PBS重悬细胞制成单细胞悬液,取10 μL的细胞悬液与90 μL 0.4%台盘蓝溶液混合,细胞计数,要求单细胞悬液细胞存活率在95%以上,细胞浓度700-1 200 cells/μL,细胞总量不少于5×105,无明显的结团现象,用于建立单细胞转录本文库。参照10×Genomics平台操作流程及要求制备单细胞微滴并建立文库,进行单细胞转录组测序。
1.2.3 数据分析 高通量测序中产生的原始数据文件经CASAVA碱基识别转化为测序读段(sequenced reads)。使用Fast QC软件对原始数据进行质量控制评估。采用Cell Ranger对原始数据进行数据质量统计和比对参考基因组,对高通量单细胞转录组进行定量,获得高质量细胞数、基因中位值、测序饱和度等质量控制统计信息。
应用Cell Ranger Seurat软件对细胞进行聚类和分群;利用CellCycleScore函数对细胞进行G1、S和G2/M分期、细胞周期状态推断;应用Seurat中的VlnPlot函数对GMSCs表面标记物、成骨、成软骨等相关基因表达水平进行分析;应用FindAllMarkers函数获得GMSCs细胞亚群的差异表达基因,并对各亚群的标记基因进行GO通路富集分析。CellPhoneDB分析各个亚群之间受体配体的互作关系情况。
2 结果
2.1 GMSCs观察与鉴定
本研究中提取到的人GMSCs呈旋涡状贴壁生长,为长梭形、多边形(图1-A)。体外培养的GMSCs生长旺盛,增殖趋势呈“S”型(图1-B)。流式细胞仪检测GMSCs阳性表达CD73、CD90、CD105、CD29,阴性表达CD31、HLA-DR(图1-C)。
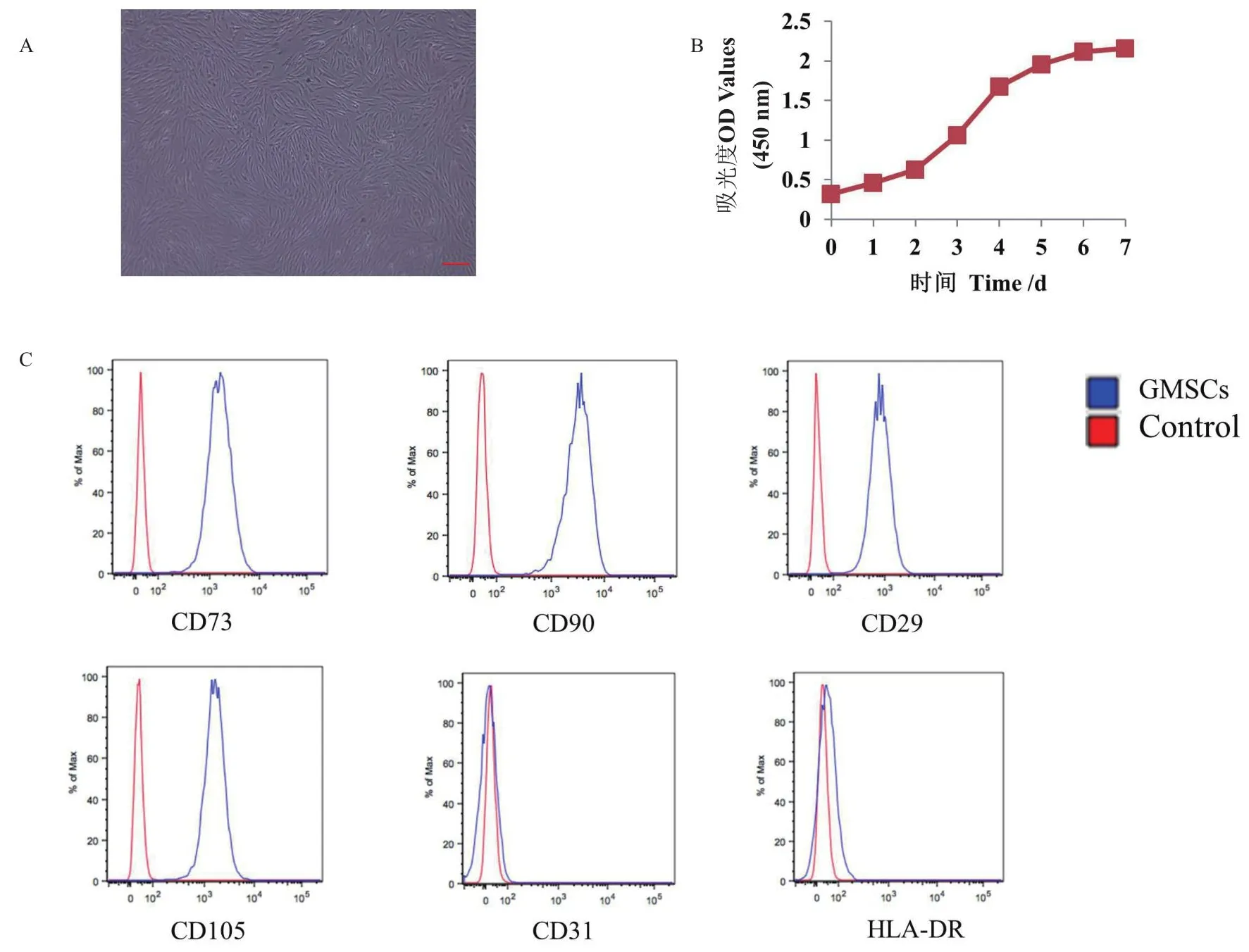
图1 GMSCs培养与鉴定Fig.1 Culture and identification of GMSCs
2.2 单细胞测序数据质量
根据图2中的基因数和线粒体数分别设置过滤参数及阈值,过滤掉多重细胞、基因数小于200以及线粒体基因比例大于20%的低质量细胞,共获取了9 842个高质量的单细胞测序数据,每个细胞基因检测数中位数为4 245,细胞中的Fraction reads为91.3%。
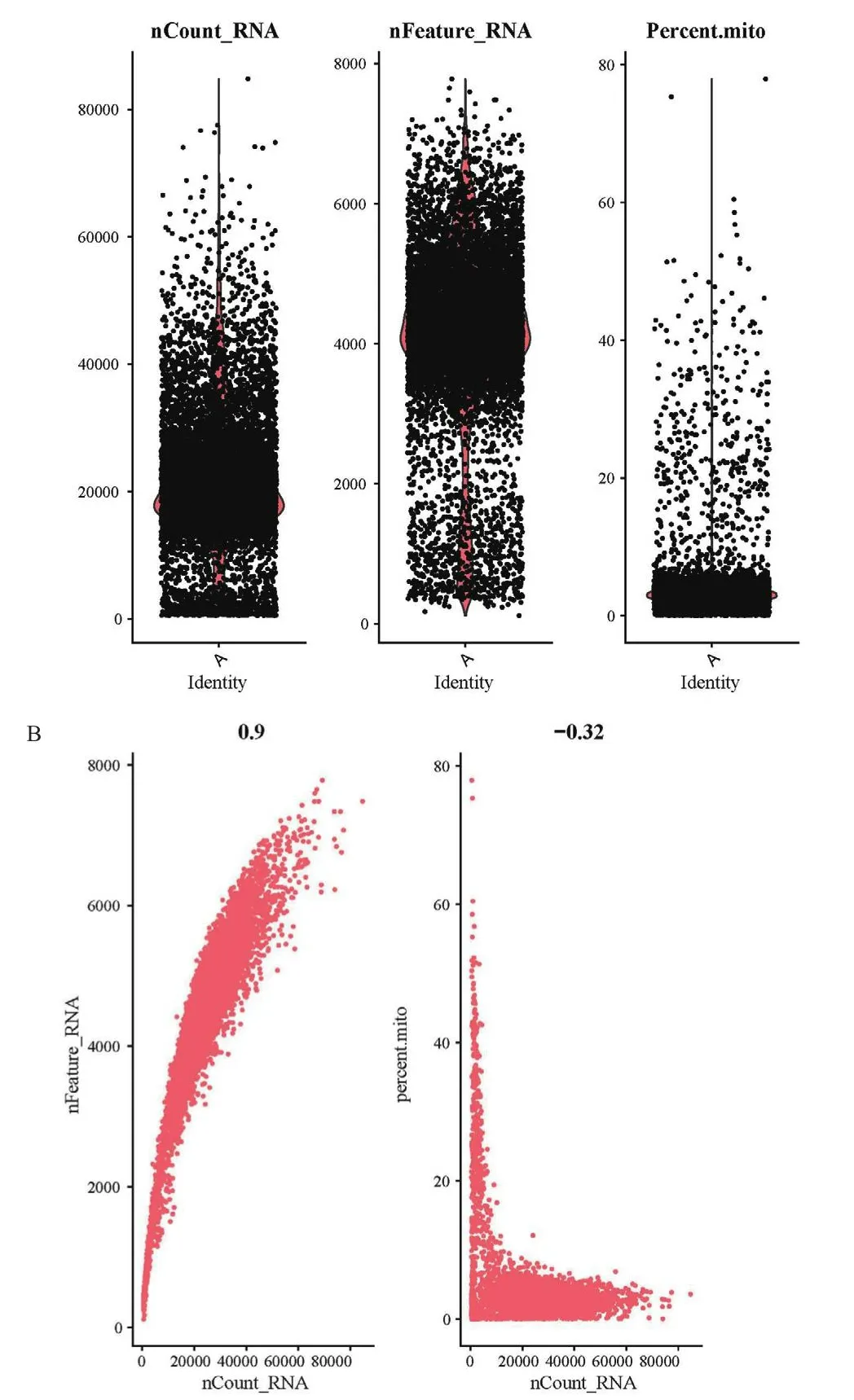
图2 数据总体质量Fig.2 Overall data quality
2.3 GMSCs细胞亚群分析
t-SNE可视化结果显示GMSCs包含9个细胞亚群,但每个细胞亚群包含的细胞数不同(图3-A)。如图3-B所示,在单细胞水平分析GMSCs的细胞表型结果表明,GMSCs高表达ENG(CD105)、NT5E(CD73)、THY1(CD90)、ITGB1(CD29)和CD44,阴性表达CD34、CD14、PTPRC(CD45)及PECAM1(CD31)。
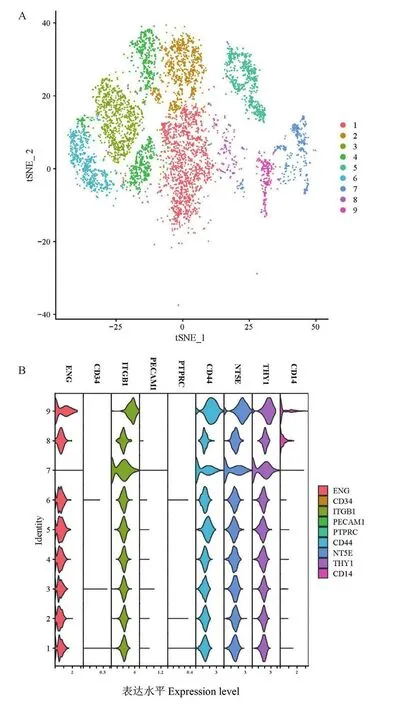
图3 单细胞测序分析GMSCs功能亚群与标记物Fig.3 Single cell sequencing analysis of functional clusters and markers of GMSCs
2.4 GMSCs亚群增殖异质性分析
CellCycleScore函数对所有细胞进行G1、S、G2/M细胞周期状态分析(图4-A),结果显示GMSCs总体G2/M期所占比例为41.59%;亚群1、3、5、6、7、8、9的G2/M比例最低,提示这些亚群内的细胞大多处于静止期,细胞增殖能力低,其中亚群6的G2M期比例最低为16.44%;而亚群2(99.08%)、亚群4(78.93%)的G2/M期细胞所占比例明显高于其它亚群,提示这些细胞大多处于分裂期,细胞增殖能力强。以上结果提示GMSCs包含的9个细胞亚群具有增殖的异质性。
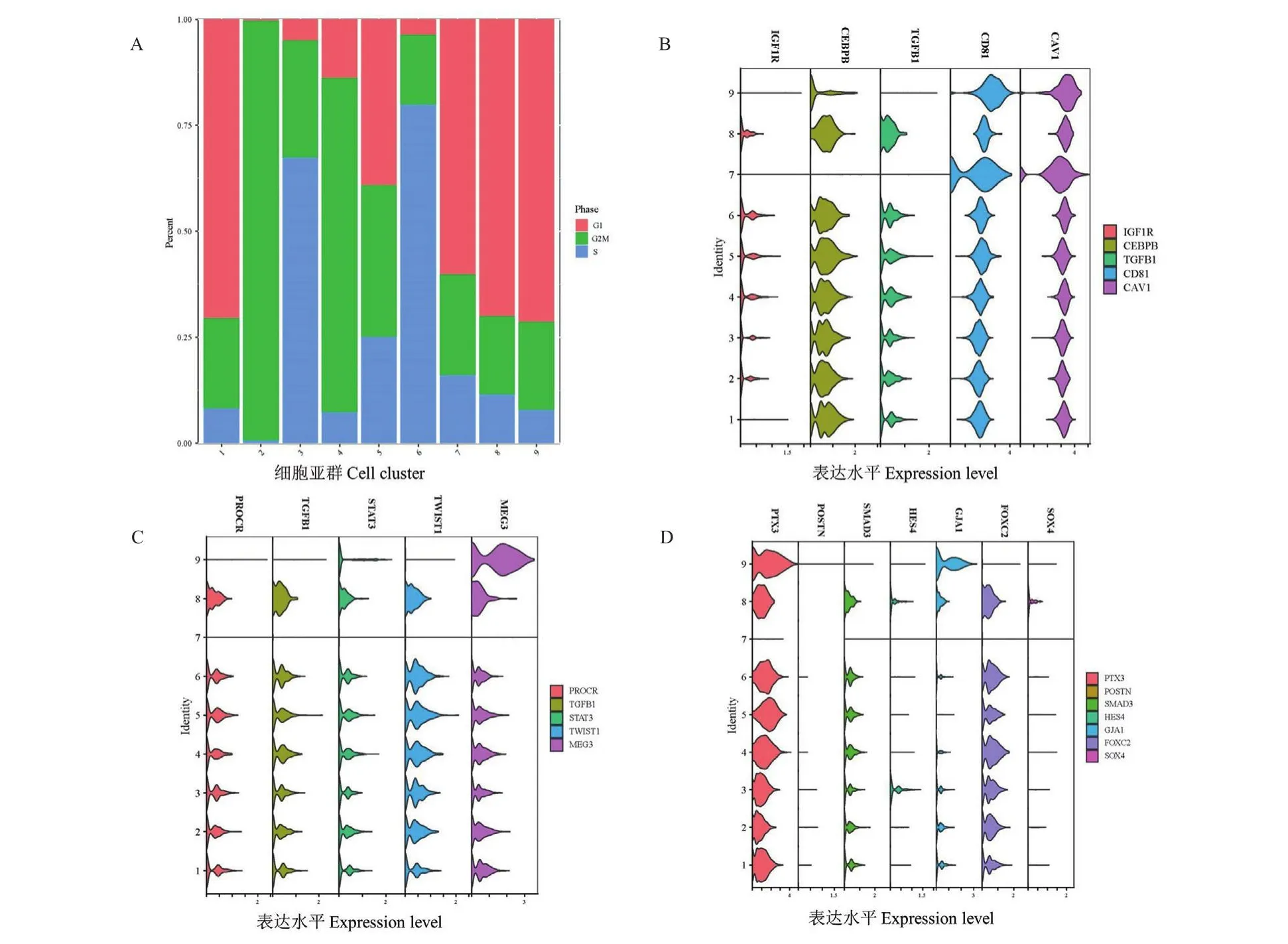
图4 GMSCs亚群细胞周期与三系分化基因表达分析Fig.4 Analysis of cell cycle and three-line differentiation gene expression in GMSCs clusters
2.5 GMSCs多向分化能力异质性分析
GMSCs的9个细胞亚群表达三系分化的基因差异结果显示,成脂、成软骨、成骨相关的基因表达在9个细胞亚群中的表达不完全相同(图4-B-D)。其中,亚群7的相关基因表达与其余亚群具有较大不同,在本研究展示的基因中,其只高表达成脂相关基因CAV1与CD81。成软骨相关基因在亚群9仅MEG3高表达。
2.6 GMSCs亚群差异表达基因分析
9个亚群具有不同的基因表达谱(图5),对top表达的marker基因分析显示,亚群2/4具有较高的相似性,相对高表达TOP2A、UBE2C、KPNA2、CENPF等基因;亚群3/6具有较高相似性,高表达HIST1H4C、HIST1H1B、CLSPN等基因;亚群5高表达DKK1、KRT7、ID1等基因;亚群9高表达MALAT1、FN1、NEAT1等基因。对不同亚群的基因进行GO通路富集分析(图6),亚群2/4主要与细胞分裂相关,亚群3与ATP代谢、钙黏着蛋白附着、蛋白丝氨酸激酶活性相关,亚群5主要与胞外基质组成、氧化应激反应、腺体发育相关,亚群6主要与G蛋白偶联受体结合、受体配体活性、信号受体激活相关,亚群7/9与细胞黏附、胞外基质组成相关,亚群8主要与胞外囊泡形成和分泌相关。
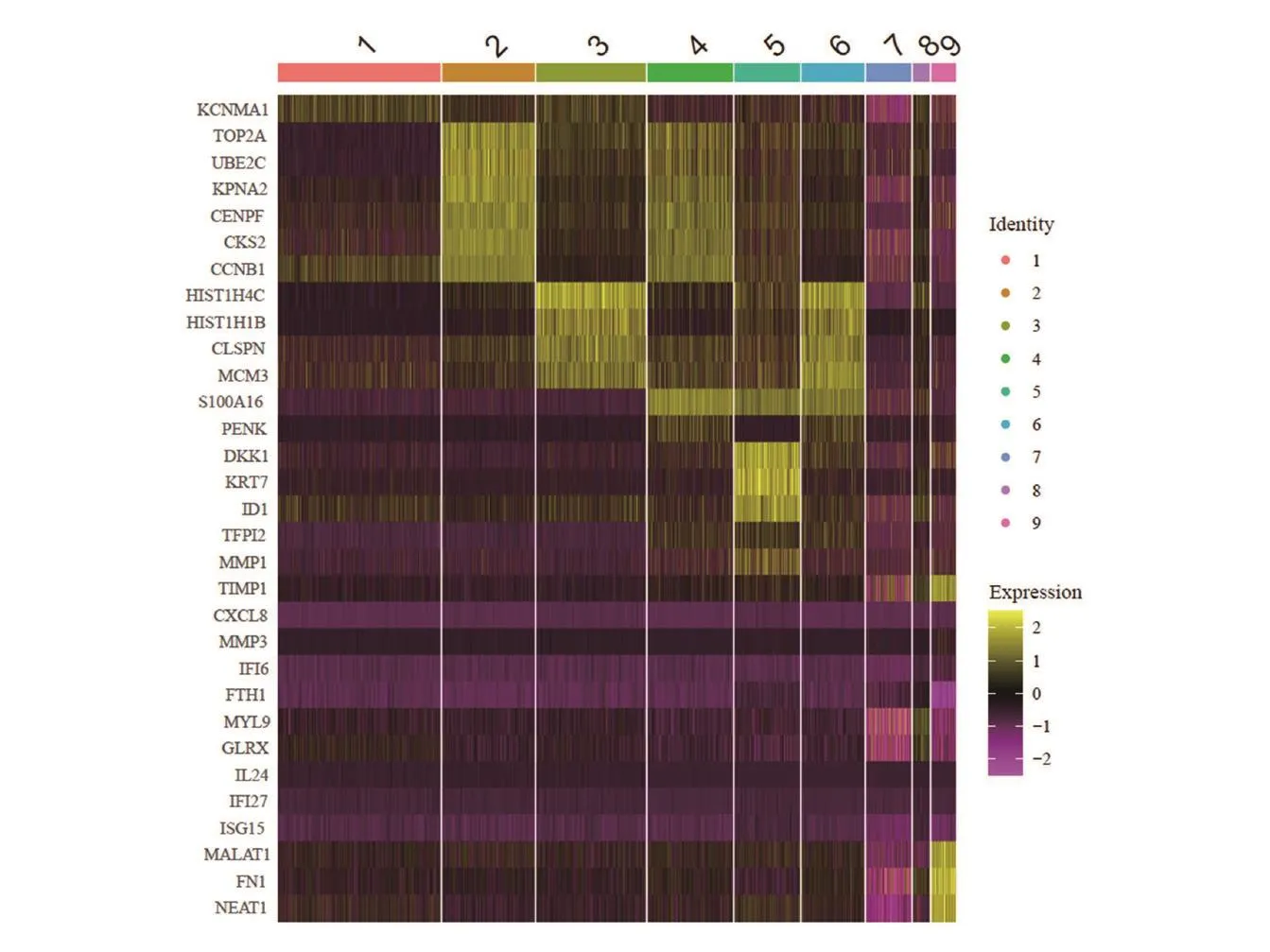
图5 GMSCs亚群差异表达top基因heatmap图Fig.5 Heatmap of differentially expressed top genes in GMSCs clusters

图6 GMSCs亚群差异基因 GO 通路富集分析Fig.6 Analysis of GO pathway enrichment of GMSCs clusters differential genes
2.7 GMSCs各亚群之间受体配体互作情况
如图7-A所示,在GMSCs各亚群中,亚群9与其他亚群间的通讯最为活跃,进一步分析亚群9和其他亚群的受配体对相互作用,结果显示其与亚群1-7在PROS1/AXL受体配体对的相互作用均较强,且亚群9与亚群7在多个受体配体对中均显示了较强的作用,涵盖了WNT通路、转化生长因子及胞外基质等相关的受体配体对,如WNT5A/FZD2、TGF-β1/TGFbR2、NOTCH2/IL-24等(图7-B)。
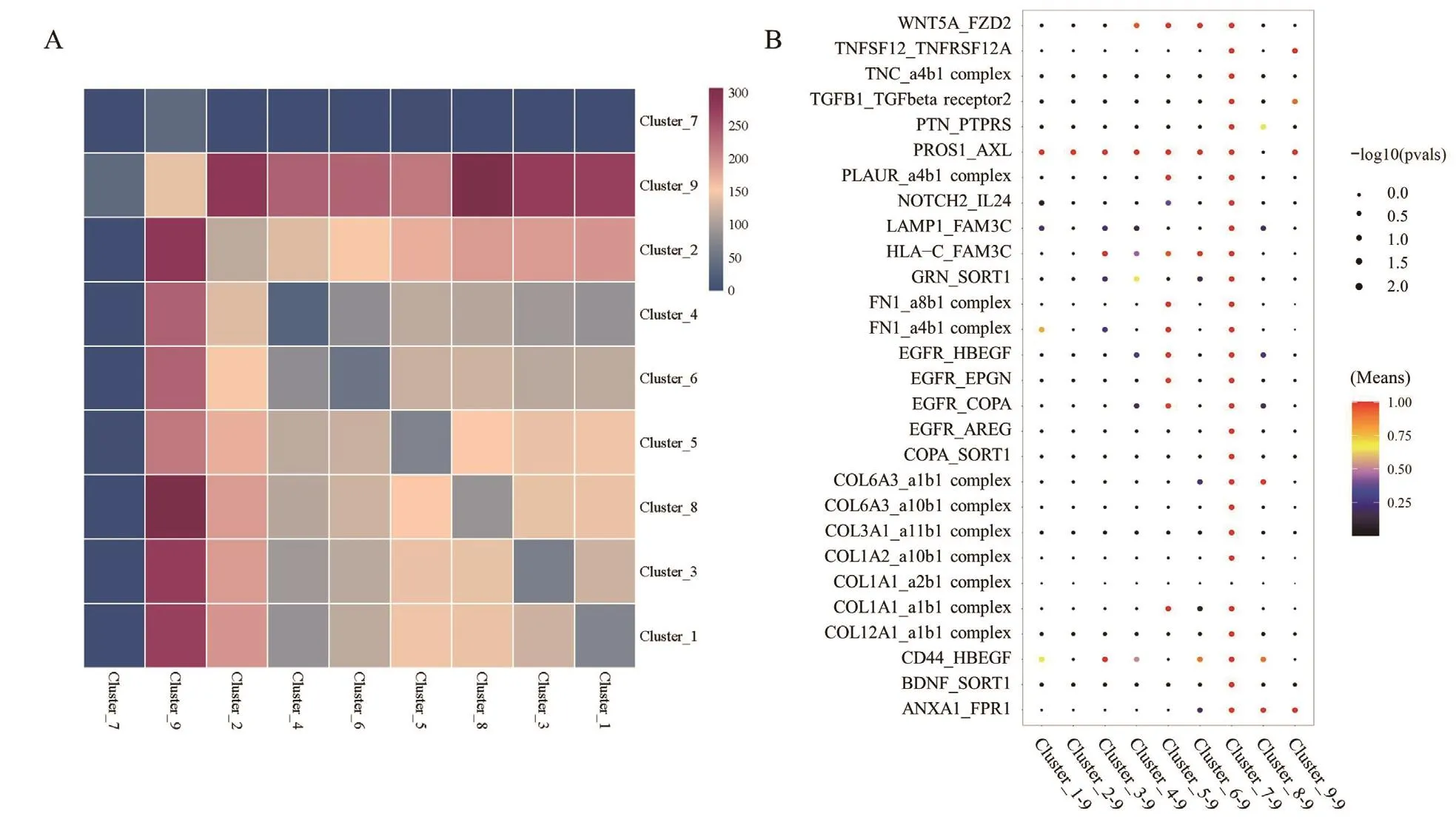
图7 GMSCs各亚群之间受体配体互作情况Fig.7 Interactions of receptors and ligands between different clusters of GMSCs
3 讨论
MSCs具有多种优良的特性,在组织工程、疾病治疗等方面被寄予厚望。但是进一步研究发现MSCs治疗疾病的效果存在差异性[1,11],严重影响了MSCs的临床转化应用,造成这种现状的原因之一可能是MSCs内部的功能异质性。因此,深入分析MSCs内部的功能异质性,提高对MSCs细胞亚群的认识对MSCs的精准与有效应用具有重要的意义。本研究利用scRNA-seq技术,首次对GMSCs的异质性进行分析。
本研究成功提取了人GMSCs,目前GMSCs的分离与培养方法比较成熟,本课题组前期已经利用相同的方法提取到GMSCs并从形态、表面标记物、多向分化等方面进行了鉴定[8-10],本文中的鉴定结果与前期结果相一致。单细胞分析显示GMSCs内部具有9个功能亚群,这些亚群在细胞增殖能力、多向分化能力等方面具有异质性。对GMSCs细胞亚群的表面标记物基因分析结果与常规的流式细胞仪检测结果相同。既往研究显示GMSCs具有较强增殖能力,且这种能力高于骨髓干细胞、牙周膜干细胞[12-13]。本研究中对细胞周期检测显示,GMSCs的G2/M期占比为41.59%,高于经单细胞测序研究的人羊水间充质干细胞[14]、脐带间充质干细胞[15]等,与既往关于GMSCs增殖能力的研究结果相一致。但GMSCs各个亚群的具体比例不同,尤其是亚群2、4,具有高于其他亚群的G2/M期比例,说明GMSCs内部存在增殖异质性。
GMSCs的多向分化能力已经被证实[6],我们前期研究也证实GMSCs在体外可以向成脂、成骨、成软骨向分化[8-10]。本研究对GMSCs单细胞测序分析显示GMSCs亚群多向分化能力具有异质性,其各细胞亚群相关基因的表达量有差异。这与郑瑞婷等[14]的研究一致。此外,我们的研究显示GMSCs亚群7的基因表达情况与其余亚群具有较大差异,可能是一类特殊的细胞群,尚需进一步研究。
细胞通讯分析可以了解细胞与细胞之间的互作关系,解析细胞间通信网络,揭示发育过程中各类细胞的相互作用、挖掘疾病潜在的治疗靶点等。本研究中发现GMSCs亚群9与其他亚群间的通讯非常活跃,因此,进一步分析了亚群9和其他所有亚群的受体配体对相互作用,结果显示其与亚群1-7在PROS1/AXL受配体相互作用均较强,且亚群9与亚群7在多个受体配体对中均作用较强,这些结果提示我们有必要针对亚群9及PROS1/AXL受配体在其中的作用深入探讨,以明确其中潜在的生物学特性与作用。
对各个亚群表达的基因分析显示,不同亚群的细胞基因表达谱、富集的生物学通路具有差异性。例如亚群2/4高表达细胞增殖相关的基因TOP2A、UBE2C、KPNA2等,GO通路富集分析也显示亚群2/4主要与细胞分裂相关,这与对GMSCs亚群细胞周期分析的结果相一致。本研究与目前关于MSCs功能异质性的研究相类似[16-17],这些研究结果都证明了在MSCs内部的功能异质性及其可能的生物学基础,同时也提示需要对MSCs的内部异质性进行深入分析才能获得需要的MSCs功能亚群及生物学作用,从而实现临床的精准应用。
本研究为后续进一步研究GMSCs的生物学特征以及相关的机制提供了研究基础。但本研究也有一定的局限性,虽然初步分析了GMSCs亚群的异质性,但为了对GMSCs的功能亚群进行精准定义,需要进一步对各个亚群的具体功能及对应的表面标记物进行确定,才能为GMSCs功能亚群的分选及精准应用提供参考。
4 结论
本研究基于单细胞水平分析了GMSCs的异质性,证实了GMSCs存在不同的功能亚群,且各个亚群的基因组表达谱、增殖能力存在差异性,即GMSCs具有功能异质性、增殖能力的异质性,需进一步研究各亚群的生物学特性为GMSCs精准应用奠定基础。