单核细胞增生李斯特菌LMXJ15全基因组测序及分析
杜冬冬 钱晶 李思琪 刘雯菲 魏向利 刘长勇 罗瑞峰 康立超
(新疆农垦科学院分析测试中心 新疆生产建设兵团食品检验所, 石河子 832000)
单核细胞增生李斯特菌(Listeria monocytogenes,LM)是一种人兽共患食源性致病菌,在自然环境广泛存在,对多种恶劣环境有较强的耐受力,并且能通过多种途径抵御食品加工过程的极端环境,从而在食品中存活[1]。研究显示食用被LM污染的食物可导致患李斯特菌病,其临床症状包括发热性胃肠炎、败血症、脑膜炎、流产和死胎等,孕妇、新生儿、老人和免疫功能低下的人为主要易感人群,病死率高达30%[2]。据研究统计,在发达国家有多次李斯特菌病暴发的报道。2011年,在美国28个州发生了由于食用被LM污染的香瓜而导致147人感染发生李斯特菌病暴发疫情,30人死亡[3]。在2018南非爆发了一次最严重李斯特菌病疫情,导致1 000多人患病,216人死亡[4]。我国LM感染引发的暴发事件和临床病例报道较少,但LM在食品中的污染情况普遍存在,例如2010-2014年间辽宁省14个城市的食品中LM的检出率为1.87%[5];2016-2019年重庆市39个区县的即食食品中检出率为1.77%[6]。同时随着抗生素的滥用,使得LM对抗生素耐药性水平逐渐提高,导致LM的预防治疗愈加复杂困难,对人们的健康产生严重的威胁[7]。
随着测序技术迅速发展,大量的LM菌株完成基因组测序,为研究LM提供了参考信息。全基因组测序不仅有利于了解菌株遗传背景和生理特性,以及基因组结构变化,进化关系和基因功能等[8],而且也能通过分析基因组中的毒力基因来预测菌株的潜在致病性。多位点序列分型(mutilocus sequence typing, MLST)是通过对细菌的多个管家基因(abcZ,bglA,cat,dapE,dat,ldh,lhkA)测序后,分析不同等位基因间的差异从而确定菌株间的相关性和进化关系[9-10]。
目前关于新疆地区食源性LM的基因组研究报道较少,本研究对一株新疆某地区分离的食源性LM进行了全基因组测序,分析了其携带的毒力基因,并与其它地区和国家来源菌株进行了亲缘关系的比较,为研究本地区的LM分子特征提供了参考信息。
1 材料与方法
1.1 材料
1.1.1 菌株 单核细胞增生李斯特菌LMXJ15菌株由新疆农垦科学院分析测试中心微生物鉴定室从新疆某地的调理肉制品中分离鉴定并保存。
1.1.2 主要试剂和仪器 脑心浸出液肉汤(brain heart infusion broth,BHI),北京路桥有限公司;单核细胞增生李斯特菌诊断血清,日本DENKS SEIKEN公司;细菌基因组DNA快速提取试剂盒,北京博迈德生物技术有限公司;台式高速冷冻离心机,Sigma公司。
1.2 方法
1.2.1 基因组测序和拼接 将LMXJ15菌株划线接种于BHI固体培养基,37℃过夜培养进行活化,挑取单菌落接种于10 mL BHI液体培养基中37℃培养16 h。按照DNA提取试剂盒说明书提取LMXJ15菌株的基因组DNA,并通过琼脂糖电泳和核酸蛋白测定仪(SMARTSPEC PIUS,美国BIO-RAD)检测,确保提取基因组的质量和浓度。提取的LMXJ15菌株DNA由生工生物工程(上海)股份有限公司采用PacBio和Illumina HiSeq测序平台进行全基因组测序和拼接组装。
1.2.2 基因预测与注释 采用Glimmer 3.02软件进行开放阅读框(open reading frame,ORF)预测,Prokka对组装结果进行基因元件预测,CRISPR预测采用CRT,将所有预测蛋白序列与Gene Ontology(GO)数据库比对,完成蛋白序列的功能注释。
1.2.3 血清型鉴定 利用单核细胞增生李斯特菌血清型鉴定试剂盒的方法测定分离株LM的O和H抗原,并结合参照Doumith等[11]的多重PCR方法中的引物序列与基因组序列匹配方法确定LM血清型。
1.2.4 毒力基因预测及分析 通过VirulenceFinder-2.0 Server(https://cge.cbs.dtu.dk/services/VirulenceFinder/)分析LMXJ15菌株的毒力基因携带情况。
1.2.5 MLST分析 对LMXJ15菌株的基因组序列与其它从 NCBI(https://www.ncbi.nlm.nih.gov/genome/)网站下载的72株LM全基因组序列通过https://cge.cbs.dtu.dk/services/MLST/进行分析,确定单核细胞增生李斯特菌的7个管家基因(abcZ,bglA,cat,dapE,dat,ldh,lhkA)的等位基因号和ST型别及CC复合克隆系。
2 结果
2.1 LMXJ15菌株的基因组特征
采用PacBio和Illumina HiSeq测序平台获得LMXJ15菌株的完成图。基因组序列总长度(genome size)为3 017 732 bp,平均GC含量为37.81%。基因预测分析,获得编码基因(CDS No)3 154个,编码57个tRNA、6个rRNA,编码基因总长度为2 734 315 bp,平均长度为866.94 bp。
2.2 CRISPR预测结果
CRISPR(clustered regularly interspaced short palindromic repeat sequences)是一类独特的DNA正向重复序列家族,通常由长度为25-48的重复序列以及单一序列间隔组成[12-13]。CRISPR的作用机制类似于真核生物的RNAi,即利用间隔区识别并沉默外源的遗传物质。CRISPR/Cas系统为细菌抵抗外来基因片段的自身免疫系统,对LM的致病性、耐药性及新陈代谢具有重要作用[14]。LMXJ15菌株中发现一个CRISPR序列,位于染色体上的270 451-270 928 bp位置,长度为478 bp(表1),提示LMXJ15菌株可能通过CRISPR途径提供相应的获得性免疫,来对抗侵略细菌的外源DNA、质粒和噬菌体,提高在自然环境中的适应性。

表1 LMXJ15菌株的CRISPR序列Table 1 CRISPR sequences of strain LMXJ15
2.3 GO注释结果
GO注释结果(图1)显示,LMXJ15基因组中有2 241个基因得到了功能注释,占所有编码基因的75.03%,包括细胞组成(cellular component,CC)、生物过程(biological process,BP)、分子功能(molecular function,MF)三大类(图2)。在BP这一层面得到22种功能注释,其中和代谢有关基因数量、与细胞过程相关基因最多。在CC层面得到17种功能注释,其中细胞膜和细胞膜组分功能相关的基因最多。在MF层面得到12 种功能注释,其中与催化活性和细胞附着有关的基因最多。

图1 CRISPR重复片段的SeqLogo图Fig.1 SeqLogo plot of CRISPR repeats
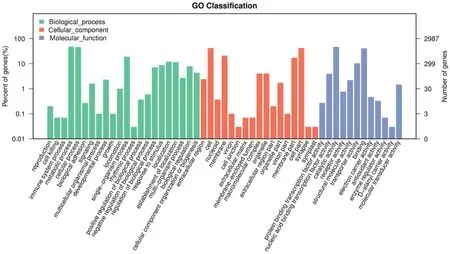
图2 LMXJ15菌株基因的GO功能分类Fig.2 GO functional classification of genes of strain LMXJ15
2.4 血清鉴定结果
血清型是细菌分型中非常重要的意义,往往和细菌的毒力、宿主特异性疫苗是否有保护性相关[15]。本研究利用鉴定LM的O和H抗原、对已获得的基因组序列和血清分型相关基因及特异性引物进行匹配,鉴定LMXJ15菌株为1/2a血清型。
2.5 毒力基因预测
通过VirulenceFinder-2.0 Server的毒力基因预测显示,LMXJ15菌株携带88个毒力相关基因,其中与表达调控相关的基因10个,与耐受环境压力相关的基因21个,与逃避宿主免疫系统作用相关的毒力基因18个,与侵袭和黏附相关的毒力基因26个,与生存和增殖相关的毒力基因12个,其他相关毒力相关基因2个(表2)。

表2 LMXJ15菌株基因组上的致病相关基因Table 2 Pathogenicity-related genes on the genome of strain LMXJ15
2.6 MLST分析结果与基因组共线性分析
对72株单核细胞增生李斯特菌分型结果显示如表3,通过7个保守基因序列进行分子进化树构建(图3),结果显示72株菌分成3个不同的分支,并呈现谱系聚类,谱系I和谱系II分别含有25和28个进化分支,谱系III含有4个进化分支,显示菌株进化关系与血清型有较为直接的关系。谱系I中主要以4b血清型菌株最多,谱系II中主要为1/2a血清型菌株。LMXJ15序列型为ST8属于CC8复合克隆系,与意大利分离株IZSAM_Lm_15_17439_A144、瑞士分离株LmN1546和一株从熏鲑鱼分离菌株R479a在同一个进化分支上,亲缘关系较近,具有相同的ST型和血清型(1/2a)。采用Mauve 软件对4株菌株进行共线性分析,结果如图4所示,菌株间基因组的相似度较高,含有9个较大的本地共线性模块(locally colinear blocks, LCB),但是它们所在的区域以及排列顺序有一定的差异。
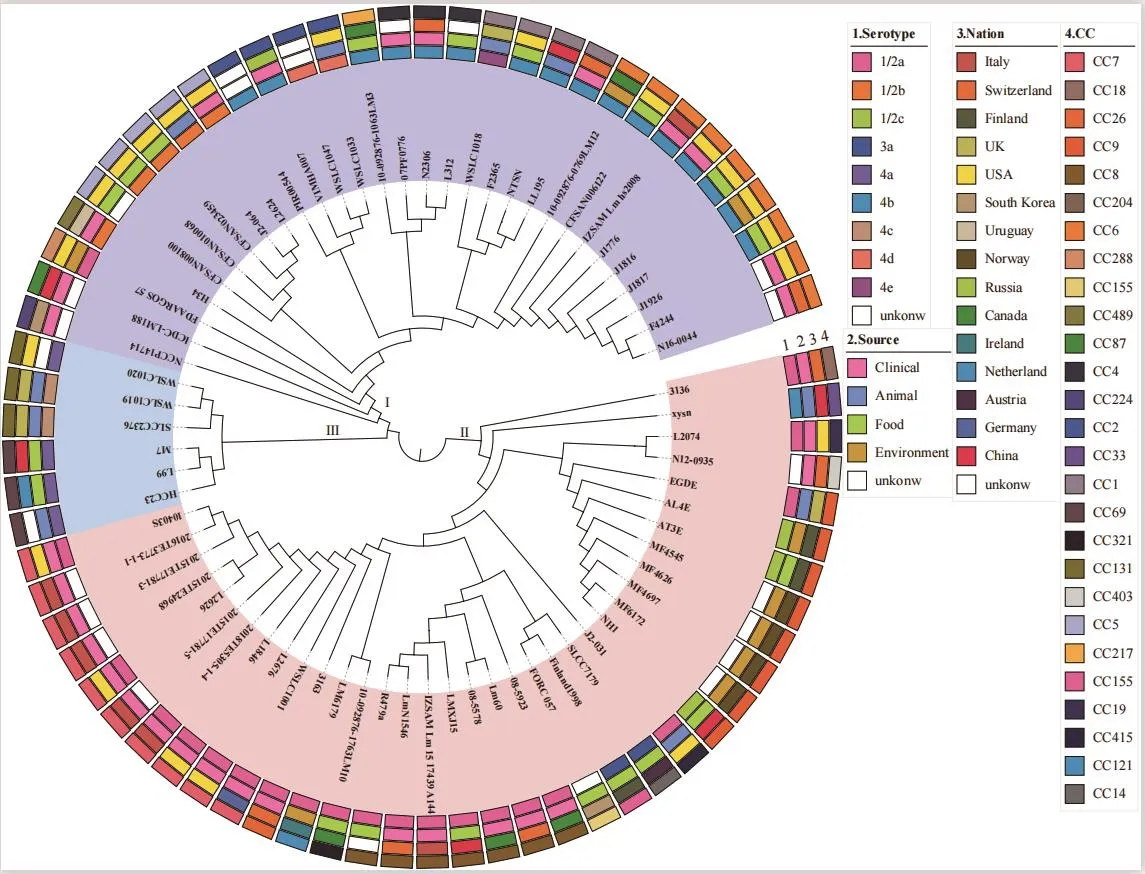
图3 72株单核细胞增生李斯特菌基于MLST管家基因序列的系统发生树Fig.3 Phylogenetic tree of 72 Listeria monocytogenes strains based on the housekeeping gene sequences of MLST

图4 全基因组共线性分析Fig.4 Whole genome alignment analysis
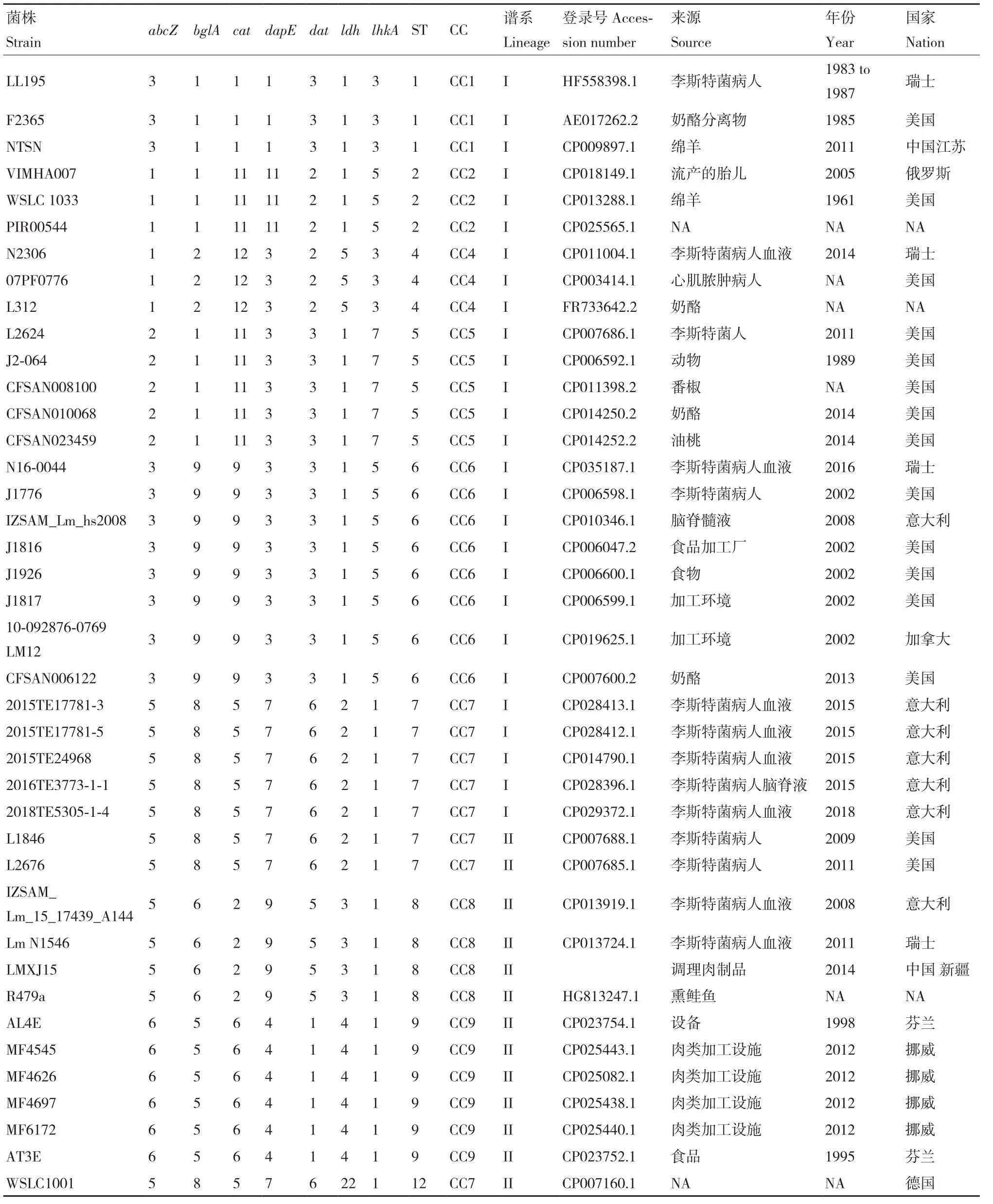
表3 72株单核细胞增生李斯特菌MLST分型结果Table 3 MSLT typing results of 72 strains of Listeria monocytogenes
3 讨论
LM是一种人畜共患病病原菌,具有分布广、耐受力强和致病力高等特征,通过污染食品来传播疾病,孕妇、新生儿及免疫力低下的成人为主要易感人群,感染后将引起败血症、脑膜炎、孕妇流产及新生儿死亡,病死率高达30%,因此被WHO列为四大食源性致病菌之一[16-17]。近几年,全国各地大量食品污染监测数据表明,LM在各类食品中存在不同程度的污染,其风险不容忽视[18-20]。但由于中国居民饮食习惯的差异以及对食源性致病菌监控体系建立起步较晚,目前对该致病菌的监测数据少,分离株数量少,大量的研究工作仍然停留在污染监测上,同样在新疆地区也是如此,对于LM分子遗传特征阐述与分析的数据量低,数据的缺失,使得防控出现空白。因此阐明LM的血清型、分子分型、基因组功能特性和毒力基因携带情况,对LM的预防与控制具有重要的意义。
本研究通过PacBio和Illumina HiSeq测序平台完成了1株分离自调理肉制品的单核细胞增生李斯特菌LMXJ15的全基因组测序,基因总长度为3 017 732 bp,GC含量为37.81%,预测到3 154个编码基因,其中编码基因总长度为2 734 315 bp,平均长度为866.94 bp,基因中包含6 个rRNA操纵子和57个tRNA。通过CRISPR预测,LMXJ15菌株中发现一个CRISPR序列,位于染色体上的270 451-270 928 bp位置,长度为478 bp,说明菌株LMXJ15可能通过CRISPR途径提供相应的获得性免疫,提高在环境中适应能力。
通过血清型分析LMXJ15为1/2b型,对LMXJ15与临床、食品、动物、环境相关的LM(NCBI上公布)进行MLST比较分析并构建进化树,发现72株菌株主要属于CC6、CC7、CC8、CC9复合克隆系,同时呈现谱系聚类。LMXJ15序列型为ST8属于CC8复合克隆系,属于谱系II,与意大利IZSAM_Lm_15_17439_A144临床分离株[21]、瑞士LmN1546临床分离株[22]和一株从熏鲑鱼中分离的R479a菌株[23]具有相同ST型血清型(1/2a),并在同一个进化分支上,对这4株LM的基因组共线分析结果显示高度相似,其毒力因子的数目也相同,这与梁慧贤等[24]的研究结果相类似,毒力基因的分布与遗传进化表现出一定的相关性。
LM成功入侵宿主细胞中存活、增殖需要多种毒力因子在不同感染阶段发挥作用[25],对LMXJ15毒力分析显示,不仅具有hpt、pycA、fri、relA、oppA、lplA1、prsA2、chiA、dal、fur、pgl、stp等毒力因子来提高在各种环境中的生存能力,还有促进LM入侵宿主上皮细胞且在感染动物的毒性表型中具有重要作用的inlA、inlB、inlF、inlH、inlJ、lap等毒力因子,以及在自噬识别逃逸中发挥重要作用的hly、plcA、plcB、mpl等毒力因子,这些表明LMXJ15菌株具有较强的毒力,有感染人患病的风险。
4 结论
LMXJ15基因组大小为3 017 732 bp,包含3 154个基因,其中GO中注释有2 241个基因;通过CRISPR预测LMXJ15菌株中发现一个CRISPR序列;MLST比较分析LMXJ15属于CC8复合克隆系ST8型,与人源临床分离株亲缘关系较近、基因组高度相似性,并且携带有多种毒力因子。本研究丰富了单核细胞增生李斯特菌的基因组数据库,为新疆地区单核细胞增生李斯特菌的研究提供了参考数据。