多重PCR检测肺炎链球菌血清型方法及临床应用*
吴丽娟 邹建话 刘小月 郑 磊 王 前
吴丽娟1,2,邹建话1,刘小月1,郑 磊3,*,王 前3,*
1 广东省深圳市宝安区妇幼保健院检验科,深圳518133; 2南方医科大学检验系,广州510515; 3南方医科大学南方医院检验科,广州510515; *通讯作者
肺炎链球菌(Streptococcus Pneumonia,SP)是全球儿童社区获得性感染的首要病原菌,既可导致儿童脓胸、败血症、脑膜炎等侵袭性感染,也可导致中耳炎(SP占30%~60%)、肺炎(SP占30%~50%)等呼吸道感染。我国每年因SP相关性疾病导致儿童死亡人数列全球前10名[1]。SP细胞外的多糖荚膜是其致病的关键,同时也是疫苗作用的靶点,根据荚膜多糖的不同,已经鉴定出46个血清群,93个血清型。SP的血清型既与致病性、耐药性有关,也与荚膜置换、疫苗有效性有关,是相关研究的核心[2]。由丹麦国家血清研究院(Statens Serum Institut,SSI)提供的荚膜肿胀法和乳胶凝集法是传统方法检测SP血清型的金标准[3],但其抗血清昂贵,不能自动化及批量检测。由于90多种血清型的荚膜多糖基因序列(cps)的公布,分子分型技术有望替代传统方法,更简单快捷地检测SP血清型[4]。本研究旨在建立一种简易的血清型多重PCR(mPCR)方法,检查几种常见重要SP血清型(4、6、9 V、14、18、19F、23F、19 A),通过检测相应已知血清型和未知血清型临床菌株并与测序结果比较,以初步探讨该方法的应用价值。
1 材料与方法
1.1 实验菌株
1.1.1 已知血清型SP菌株:4、6、9 V、14、18、19F、23F、19 A(北京大学人民医院惠赠)各1株,血清型由SSI荚膜肿胀法确定。
1.1.2 未知血清型SP菌株:分离自2009年1月~2011年12月深圳市某区妇幼医院儿科患儿不重复SP菌株126株[5],其中16株来源于血液,其它来源于呼吸道,用苛氧菌菌种保存管(MAST,英国)-70℃保存。SP鉴定标准为奥普托欣纸片敏感和胆汁溶菌试验阳性。
1.1.3 质控菌株:选取标准菌株ATCC49619(已知血清型为19F)作为质控菌株。
1.2 实验试剂与设备
二氧化碳培养箱(Shellab,美国);Axygen细菌基因组DNA小量提取试剂盒(美国);Taq DNA聚合酶、d NTP Mix、10×Loading Buffer、DNA Mar ker(Ta Ka Ra公司,日本);琼脂糖(Biowest公司,法国);溴化乙锭等常规分子生物学试剂(南方医科大学检验系提供);TA载体试剂盒(上海拜力公司);琼脂糖凝胶DNA纯化试剂盒(Ta Ka Ra公司,日本);PCR扩增仪(Eppendorf,德国);凝胶电泳成像分析系统(Bio-rad,美国)。
1.3 实验方法
1.3.1 引物设计:参照文献[6],根据广泛应用的SP 7价结合疫苗覆盖血清型及近年来常见的19 A血清型,设计9对PCR引物,包括SP荚膜多糖基因的保守序列cpsA,血清型4、6、9 V、14、18、19 A、19F、23F特异性引物,由Invitrogen公司合成,各引物序列见表1。
1.3.2 DNA提取、PCR扩增:将冻存的SP临床菌株复苏,重传至羊血平板(广州迪景),置5%CO2、35℃温箱孵育18~24h。将新鲜纯SP菌落刮入1 ml生理盐水,按Axygen细菌基因组DNA小量提取试剂盒(柱提取法)步骤提取模板DNA。PCR反应体系为Ex Taq DNA 聚合酶0.1μl,10×Ex Taq buffer 2μl,模板 DNA 2μl,d NTPs 1.6μl,9种混合引物(每种引物 200μM)0.75μl,重蒸水补足至20μl。循环参数:94℃15 min,94℃30s,57℃30s,72℃30s,35个循环,72℃10 min。扩增产物经2%琼脂糖凝胶电泳,用凝胶电泳成像系统观察产物条带。

表1 8种特异性SP血清型引物序列
1.3.3 DNA测序:在紫外灯下切割有条带的胶块,按DNA纯化试剂盒说明书对DNA进行纯化后,按TA载体试剂盒说明书与p MD18-T载体进行连接,平板克隆。完成后送华大基因公司测序,测序结果经Blast检索与Gen Bank数据库进行同源性比较分析。
2 结 果
2.1 8株已知血清型SP DNA经mPCR扩增后结果
每株SP都能扩增出cpsA特异性产物,同时每种血清型均在对应的产物大小位置出现特异性条带,血清型18和19 A由于产物大小太接近,无法直接区别,需克隆后测序区分;产物测序结果与mPCR结果一致。见图1。
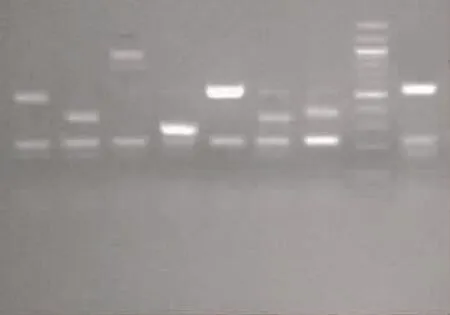
图1 已知血清型SP经mPCR扩增后电泳图
2.2 126株未知血清型临床SP DNA经mPCR扩增后结果
共有124株SP能扩增出cpsA特异性条带,14株血液来源SP有特异性条带,检出5种血清型,35株呼吸道来源SP有特异性条带,检出8种血清型(表2)。所有血清型特异性条带均经过纯化克隆后测序验证,结果显示与mPCR结果一致。
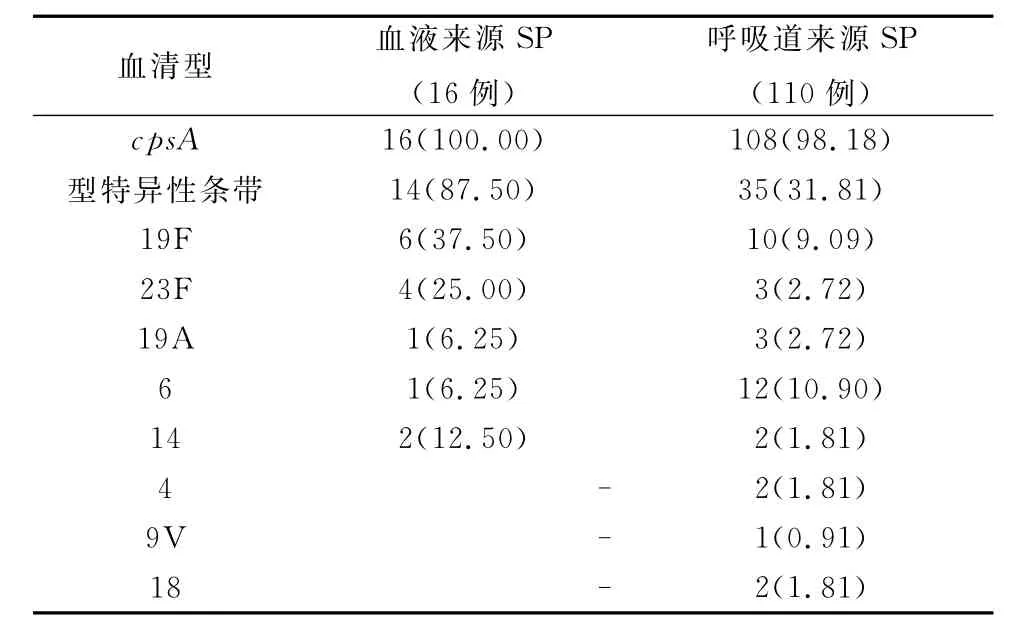
表2 126株临床SP血清型检出率(n,%)
3 讨 论
cps基因座上的荚膜多糖合成基因决定SP荚膜多糖的产生,其开始部位的基因序列cpsA高度保守,几乎可出现在所有SP中,除外不能分型的SP(无荚膜),cps基因座中心部位的位点包含血清型特异性基因,可作为分子分型的基础[4]。本文设计的mPCR引物针对最常导致侵袭性感染(血流感染)的8种SP血清型的cps保守序列,通过mPCR检测的8种SP血清型与传统方法检测的血清型均一致,可以直接通过产物大小区分特异性血清型,无交叉反应,cpsA可作为内参。表明该方法可简单、直接地区分8种血清型。
SP通过两种不同方式对人体致病:一是侵袭性菌株通过有效的人类个体间传播导致菌血症;二是菌株长期定植在鼻咽部,伺机导致呼吸道感染。因此出现侵袭性感染和呼吸道感染SP血清型的不同流行分布特点。全球范围内,13种SP血清型导致了超过75%的儿童侵袭性SP感染(血流感染)[1],我国Lian等[3]用传统方法检测儿童血液来源SP血清型发现87.8%的菌株分布在这13种血清型中,尤以血清型19F、14、19A、6和23F最常见。与本研究中血液来源SP 87.50%分布在19F、14、19 A、6和23F相一致,表明mPCR对血液来源SP血清型检测有较高的应用价值,通过一次mPCR即可检测出绝大部分菌株的血清型,简单有效。
本文结果显示本方法对呼吸道来源样本SP的血清型检出率显著低于血液样本,只有31.81%的样本出现特异性条带,这与呼吸道SP血清型异质性大,分布更广有关,仅用一次mPCR不能达到检测目的。对此可采用 Karen等[7]设计的一系列mPCR实验,逐步完成对所有呼吸道样本SP血清型的筛查。
mPCR分子分型法检测SP血清型不用购买昂贵的血清型抗血清,又能达成准确、简单、高通量检测血清型。同时,mPCR还可应用于呼吸道多种血清型SP混合定植的筛查,这是传统方法无法做到的。总之,本文建立的mPCR检测SP血清型方法可简单、直接地检测出8种SP重要血清型,尤其对于血液来源SP血清型有较大优势,至于呼吸道SP血清型检测尚需完善更多mPCR方案。
1 Katherine LB,Lara J W,Ja mes PW,et al.Bur den of disease caused by Streptococcus pneumoniae in children younger than 5 years:global estimates[J].Lancet,2009,374(9 693):893~902.
2 Daniel MW,Richar d M,Marc L.Serotype replacement in disease after pneumococcal vaccination[J].Lancet,2011,378(9 807):1 962~1 973.
3 Lian X,Kaihu Y,Guilin X,et al.Serotype distribution and antimicr obial resistance of Streptococcus pneumoniae isolates that cause invasive disease among Chinese children[J].Clin Infec Dis,2010,50(5):741~744.
4 Stephen DB,David MA,Angeliki M,et al.Genetic analysis of the capsular biosynthetic locus from all 90 pneumococcal ser ot ypes[J].PLoS Genet,2006,2(3):e31.
5 吴丽娟,邹建话,缪小佟,等.社区获得性呼吸道感染患儿肺炎链球菌耐药特征分析[J].中国实验诊断学,2011,15(12):2 147~2 149.
6 Rekha Pai,Robert EG,Ber nard B,et al.Sequential multiplex PCR approach for deter mining capsular serotypes of Streptococcus pneumoniae isolates[J].J Clin Micro,2006,44(1):124~131.
7 Karen M,Carolynn DB,Marcella H,et al.Serotyping of streptococcus pneumoniae isolates from nasopharyngeal samples:use of an algorit h m combining microbiologic,ser ologic,and sequential multiplex PCR techniques[J].J Clin Micr o,2011,49(9):3 209~3 214.

