瑞香狼毒降低YAP1表达抑制肝癌细胞增殖的作用
周文汉 郑康宁 李永民
(河北中医学院,石家庄 050200)
原发性肝细胞癌(hepatocellular carcinoma,HCC)死亡率高居癌症第三位[1]。目前,除手术和肝移植外,放化疗是主要治疗手段,但放化疗药物的毒性及耐受性限制了其治疗效果,导致患者5年生存率低于30%[2],因此,HCC是严重危害人类健康的重大疾病。
Yes关联蛋白1(yes-associated protein 1,YAP1)是Hippo通路下游的关键效应分子。研究表明,YAP1的过度活化导致组织器官的增殖失调[3]。临床研究表明,肝癌组织中,YAP1过表达且处于活化状态;同时,激活YAP1促进肿瘤细胞的增殖、侵袭和转移[4]。沉默YAP1的表达抑制了SMMC-7721的增殖[5]。因此,YAP1是潜在的肝癌治疗靶点之一。
瑞香狼毒(Stellera chamaejasmeL.serum group,SCL)为瑞香科狼毒属植物,一般药用部位为干燥根,是我国西北、内蒙古、黑龙江等地一种分布广泛的植物。SCL最早记载于《神农本草经》,是药用狼毒的正品。其味苦辛、性平,入肺、脾、肝经,具有逐水祛痰、破积杀虫之功效。近几年研究发现,SCL在治疗肿瘤及结核病等方面有很多值得探讨与开发的价值[6]。然而关于SCL抑制肝癌细胞增殖的机制鲜见报道。
本研究以肝癌HepG2215 细胞及Yap1敲除(Yap1LKO)小鼠和Yap1flox/flox小鼠肝原位癌模型为材料,进行了细胞活力检测、蛋白水平表达验证、病理组织学观察和分子对接等体内外实验,拟得出结论:SCL抑制肝癌增殖与降低YAP1表达有关,为原发性肝细胞癌的病理机制研究和临床治疗提供依据。
1 材料与方法
1.1 材料
1.1.1 细胞和动物 HepG2215(整合HBV基因的细胞株)和L02(正常肝细胞)细胞株均购自湖南亚大丰晖新材料有限公司,并由上海翼和应用生物技术有限公司进行STR基因型检测鉴定。SD雄性大鼠购于北京维通利华(许可证号SCXK(京)2016-0006)。肝细胞特异性Yap1敲除(Yap1LKO)小鼠购自赛业(广州)生物科技有限公司。此研究已获得河北中医学院伦理委员会批准(伦理编号:DWLL2019029)。
1.1.2 试剂与耗材 SCL干燥根取材于河北省张家口市尚义县(经河北北方学院刘贵河教授确认是SCL正品)[7];胎牛血清购自于美国Hyclone公司;RPMI 1640培养基、CCK-8细胞增殖检测试剂盒购自于北京索莱宝科技有限公司;蛋白提取试剂盒;柱式动物组织/细胞总蛋白抽提试剂盒购自于上海雅酶生物医药科技有限公司; 12%聚丙烯酰胺预制胶购自于南京金斯瑞生物科技有限公司;兔抗YAP1(D8H1X)XP单克隆抗体购自于美国 Cell Signaling Technology 公司;兔抗GAPDH抗体购自于上海泊湾科技有限公司;HRP 标记的山羊抗兔 IgG购自于上海生工生物工程股份有限公司;通用型 ECL 发光液购自于上海圣尔生物科技有限公司;N-亚硝基二乙胺(diethylnirtosamine,DEN)购自于美国 Sigma 公司; 组成型雄甾烷受体激动剂(3,5-dichloro-2-[4-(3,5-dichloropyridin-2-yl)oxyphenoxy]pyridine,TCPOBOP)购自于北京博奥派克生物科技有限公司;苏木素-伊红染色液购自于安徽雷根生物技术有限公司;多功能成像系统购自于法国 VILBER BIO IMAGING公司;多功能微孔板读数仪购自于赛默飞世尔科技(中国)有限公司;Image-J软件购自于美国National Institutes of Health公司;MS250超声换能器的成像系统购自于多伦多VisualSonics公司。
1.2 方法
1.2.1 制备SCL水煎液 称取642 g SCL的干燥根,加水5 L浸泡1 h。将SCL干燥根在砂锅中煎煮2 h,并浓缩至2 L,制成321 mg/mL的SCL水煎液,放于-20℃冻存备用。使用时,用蒸馏水稀释至160.5 mg/mL。
1.2.2 制备SCL含药血清 12只雄性SD大鼠随机分为2组。SCL组:灌胃SCL水煎液(3.21 g/kg)1 mL,每天2次;生理盐水(NS)组:灌胃NS 1 mL,每天2次。连续灌胃4 d,末次灌胃2 h后,SD大鼠经2%戊巴比妥钠麻醉,股动脉取血。全血常温静置2 h,2 500 r/min离心15 min,取上清液,56℃水浴30 min,分装后,-80℃冻存备用。
1.2.3 CCK-8法检测细胞生长活性 将HepG2215和L02细胞分别置于含10% 胎牛血清的RPMI 1640培养基中,37℃、5% CO2饱和湿度环境培养。收集处于对数生长期的HepG2215和L02细胞,制成1×105个/mL的细胞悬液,以每孔100 μL细胞悬液接种于96孔板中。细胞贴壁后,加入用培养基稀释的含不同体积比的SCL含药血清(0%、5%、10%、15%、20%和30%)培养24 h,每孔加入100 μL配置的CCK-8溶液(CCK-8溶液∶RPMI1640培养基=1∶9),混匀后,孵育2 h,多功能微孔板读数仪检测波长为450 nm处的OD值。细胞存活率(%)=(试验孔吸光度-空白孔吸光度)/(对照孔吸光度-空白孔吸光度)×100%。
1.2.4 Western blot法检测HepG2215细胞中YAP1表达水平的变化 SCL含药血清处理细胞24 h后,按照柱式动物组织/细胞总蛋白抽提试剂盒步骤提取HepG2215细胞蛋白,100℃加热变性,用12%聚丙烯酰胺预制胶进行蛋白分离;转膜后封闭,并用兔抗YAP1(D8H1X)XP单克隆抗体(1∶1 000稀释)和兔抗GAPDH抗体(1∶2 000稀释),4℃过夜;洗膜后加入山羊抗兔IgG-HRP(1∶10 000稀释)室温下摇床孵育1.5 h。洗膜后,进行ECL曝光,用多功能成像系统检测条带,并用Image-J软件测量条带灰度值,分析结果。
1.2.5 大鼠肝脏毒性检验 为了选出有疗效且不损伤正常肝细胞的SCL剂量,将大鼠随机分为3组,分别为高浓度SCL水煎液组(3.21 g/kg)、低浓度SCL水煎液组(1.605 g/kg)和NS组。连续灌胃4 d,取出大鼠肝脏,拍照。
1.2.6 DEN/TCPOBOP化学诱导的肝原位肿瘤小鼠模型 肝细胞特异性Yap1敲除(Yap1LKO)小鼠由广州赛业生物科技有限公司构建并鉴定成功[8]。将2周龄雄性Yap1flox/flox小鼠和Yap1LKO小鼠,腹腔注射DEN 25 mg/kg; 从第4周龄开始,每2周注射1次TCPOBOP(3 mg/kg),共计10次。24周龄时,通过MS250超声换能器的成像系统,通过超声测定小鼠肝脏内的肿瘤数量[9]。对造模成功的10只Yap1flox/flox小鼠和10只Yap1LKO小鼠随机分为SCL组和NS组。根据动物之间给药剂量的计算参照公式:小鼠药量×3=大鼠药量×6。小鼠的给药量是大鼠的2倍。SCL用量为2.293 g/(kg·d),共计7 d。
1.2.7 H&E染色观察肿瘤组织的病理形态 小鼠肝脏组织经4%多聚甲醛固定后,梯度酒精脱水、透明、浸蜡、组织包埋后,进行组织切片(厚度5 μm)。组织切片脱蜡后,经苏木精染色、分化液酸化、返蓝后,再用伊红染色,酒精脱水,透明、中性树胶封片,晾干后显微镜观察拍照。
1.2.8 LC-MS技术对SCL全物质鉴定 取SCL水煎液,SCL含药血清和NS血清各100 μL,加入400 μL的萃取液(甲醇∶乙腈=1∶1)。涡流混匀30 s后,低温超声萃取30 min(5℃,40 kHz)。然后用4℃冷冻离心机13 000 r/min离心15 min,取出上清液,用氮气吹干。加入100 μL的重组液(乙腈∶水=1∶1),超声提取,离心。最后转入小瓶进行LC-MS分析。将原始数据导入代谢组学处理软件Progenesisqi进行基础分析。接着利用该软件对特征峰搜索数据库进行识别,并对代谢数进行分析。MS的质量误差设置为小于10 PPM,根据二级质谱匹配评分鉴定代谢物(主要数据库为http://www.hmdb.ca/和https://metlin.scripps.edu/)。上述检测和分析由上海美吉生物医药科技有限公司进行。
1.2.9 SCL含药血清活性成分与YAP1分子对接 应用PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)下载活性成分的2D结构,并进行能量最优化。在Uniprot数据库(https://www.uniprot.org/)中寻找YAP1蛋白结构,通过PDB数据库(https://pdbj.org/)下载靶蛋白结构。用PyMol软件去除水分子和小分子配体,使用Auto Dock Tools 1.5.6软件添加氢键,Vina进行受体和配体分子对接,得到分子对接的分数值。利用PyMol软件展示配体分子与受体蛋白的结合位点。
1.2.10 统计学方法 采用SPSS 26.0软件进行统计分析,计量资料数据以均数标准差(S)表示,两组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 SCL含药血清不影响人正常肝细胞L02的增殖
选用高浓度(3.21 g/kg)与低浓度(1.605 g/kg)SCL水煎液及生理盐水,分别灌胃大鼠7 d。肉眼观察大鼠肝脏的形态变化,发现高浓度SCL组大鼠的肝脏形态有肉眼可见的改变,而低浓度SCL组和NS组的大鼠肝脏并未观察到明显的变化(图1-A)。选用低浓度的SCL含药血清进一步处理L02细胞24 h,CCK-8法检测结果显示,不同体积比(0%、5%、10%、15%、20%和30%)的SCL含药血清对L02细胞的增殖均无影响(图1-B)。因此,在后续细胞试验中,均采用低浓度的SCL含药血清干预细胞。

图1 低浓度瑞香狼毒含药血清对人正常肝细胞L02增殖的影响Fig.1 Effects of low concentration of SCL serum on the proliferation of normal liver cells L02
2.2 低浓度SCL含药血清抑制肝癌HepG2215细胞的增殖
为了探究SCL含药血清对HepG2215细胞的影响,不同体积比(0%、5%、10%、15%、20%和30%)的SCL含药血清处理HepG2215细胞24 h。形态学观察结果发现,随着SCL含药血清比例的增加,HepG2215细胞形态皱缩、细胞数量减少、悬浮细胞增多;NS血清处理的细胞生长状态良好,细胞呈多边形生长,形态规则(图2-A)。

图2 不同浓度瑞香狼毒含药血清抑制HepG2215细胞的增殖Fig.2 Proliferation of HepG2215 cells inhibited by different concentrations of SCL serum
不同体积比SCL含药血清处理HepG2215细胞24 h,CCK-8法结果显示,随着SCL含药血清浓度的增加,HepG2215细胞的存活率逐渐降低(图2-B)。24 h时,SCL含药血清干预HepG2215细胞的IC50值为(19.38±0.73)%(图2-C)。结果表明,SCL含药血清能抑制HepG2215细胞的增殖活力。
2.3 SCL含药血清降低HepG2215细胞中YAP1蛋白的表达水平
临床上,YAP1在肝肿瘤组织中高表达。为进一步探究SCL能否影响YAP1的表达水平,Western blot分析结果显示,SCL含药血清降低了HepG2215细胞中YAP1的蛋白表达水平(P<0.05)(图3)。

图3 瑞香狼毒含药血清降低HepG2215细胞YAP1蛋白表达水平Fig.3 Expression of YAP1 decreased by SCL serum in HepG2215 cells
2.4 SCL水煎液抑制肝原位癌小鼠肝脏肿瘤的增长
为了验证SCL是否能通过YAP1抑制肝癌细胞的增长,DEN/TCPOBOP联合诱导Yap1flox/flox和Yap1LKO小鼠构建肝原位癌模型,SCL水煎液和NS灌胃7 d。在NS组中,与Yap1flox/flox小鼠相比,Yap1LKO小鼠的肝肿瘤体积明显减小。结果表明,敲除Yap1能减小小鼠肝肿瘤的体积。在Yap1flox/flox组中,与NS组相比,SCL组小鼠肝脏的肿瘤体积缩小了。结果表明,SCL能抑制Yap1flox/flox小鼠肿瘤增长。在Yap1LKO组中,与NS对照组相比,SCL组小鼠肝脏的肿瘤体积缩小,但效果不如Yap1flox/flox组。结果表明SCL能抑制Yap1LKO小鼠肿瘤增长。有趣的是,YAP1敲除后,SCL抑制肝肿瘤体积增长的作用减弱(图4-A)。H&E染色结果显示,在Yap1flox/flox和Yap1LKO组中,NS组的正常肝脏组织结构被肿瘤组织浸润破坏,肝癌细胞呈巢状排列,松散程度更高,多数肝癌细胞体积大,有大小不一的空泡,胞浆丰富,细胞核多核分裂象多见;SCL组肿瘤组织边界清楚,肝癌细胞排列呈多角形,细胞核双核分裂象多见。在SCL组中,与Yap1flox/flox小鼠相比,Yap1LKO小鼠肝脏组织结构更加完整(图4-B)。这些结果说明SCL能抑制肝原位癌小鼠肝脏肿瘤的增长。
2.5 SCL降低肝原位癌小鼠肝癌细胞中YAP1的表达
为了进一步探究SCL抑制小鼠肝原位癌增长的机制,肝原位癌Yap1flox/flox和Yap1LKO小鼠分别经NS和SCL灌胃后,Western Blot检测小鼠肝癌组织中YAP1蛋白的表达水平。Western Blot结果显示了Yap1LKO小鼠的YAP1已被敲除。同时在Yap1flox/flox小鼠中,与NS组相比,SCL降低了小鼠肝癌组织中YAP1的表达水平(图5)。综合2.4和2.5的结果,SCL抑制小鼠肝脏肿瘤增长与降低肝肿瘤组织中YAP1表达水平有关。

图5 瑞香狼毒降低肝原位癌小鼠肝癌细胞YAP1的表达Fig.5 Expression of YAP1 decreased by SCL in the mice with tumors in liver
2.6 SCL含药血清中的4种主要活性成分
为进一步验证SCL抑制肝癌细胞的主要成分,利用LC-MS对NS血清、SCL含药血清和SCL水煎液所含成分进行全物质鉴定。分析结果显示,NS血清、SCL含药血清和SCL水煎液3组样本LC-MS负极检测到的化合物数量分别为314、309和1 468种,正极检测到的化合物数量分别是527、527和1 068种,以上结果均为去除未命名化合物后的数量(图6)。SCL含药血清与SCL水煎液中共有的化合物,确定为SCL发挥作用的活性成分(附图1)。这些活性成分是3-硫酸咖啡酸(caffeic acid 3-sulfate)、5-苄恶唑-2-酮(5-benzyloxolan-2-one)、3, 4, 5-三羟基-6-[(2-氧代-2H-铬-5-基)氧]氧烷-2-羧酸(3,4,5-trihydroxy-6-[(2-oxo-2H-chromen-5-yl)oxy]oxane-2-carboxylic acid)和异东莨菪内酯(Isoscopoletin),见表1。

表1 瑞香狼毒发挥作用的活性成分Table 1 Active ingredients of SCL
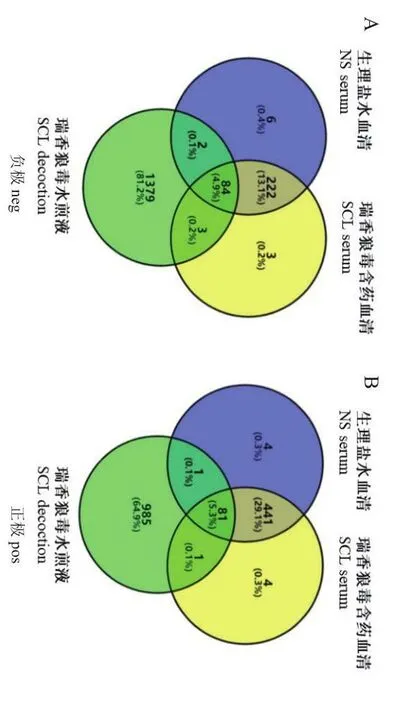
图6 LC-MS检测不同组别化合物数量Venn图Fig.6 Venn diagram of the number of compounds of different groups detected by LC-MS
2.7 SCL中3种活性成分能直接结合YAP1蛋白
在PubChem数据库中,未检索到活性成分5-苄恶唑-2-酮的化学结构。因此,选取SCL的3种活性成分3-硫酸咖啡酸、3,4,5-三羟基-6-[(2-氧代-2H-铬-5-基)氧]氧烷-2-羧酸和异东莨菪内酯分别与YAP1进行分子对接,进一步验证SCL活性成分是否与YAP1蛋白存在直接结合作用。结果表明,3-硫酸咖啡酸与YAP1在Gln410位点处形成氢键,对接能为-6.0 kcal/mol;3,4,5-三羟基-6-[(2-氧代-2H-铬-5-基)氧]氧烷-2-羧酸与YAP1在Glu381和Lys281位点处形成氢键,对接能为-7.8 kcal/mol;异东莨菪内酯与YAP1在Gln410处形成氢键,对接能为-7.2 kcal/mol。阳性对照verteporfin(YAP1抑制剂)与YAP1在ARG-291和GLY-283处形成氢键,对接能为-7.5 kcal/mol(图7)。结果表明,SCL的这3种活性成分能直接结合YAP1蛋白,与阳性对照相比,3种活性成分与YAP1的结合能力与Verteporfin类似。表明SCL的3种活性成分可能通过直接结合YAP1,从而发挥抑制肝癌细胞增殖的作用。
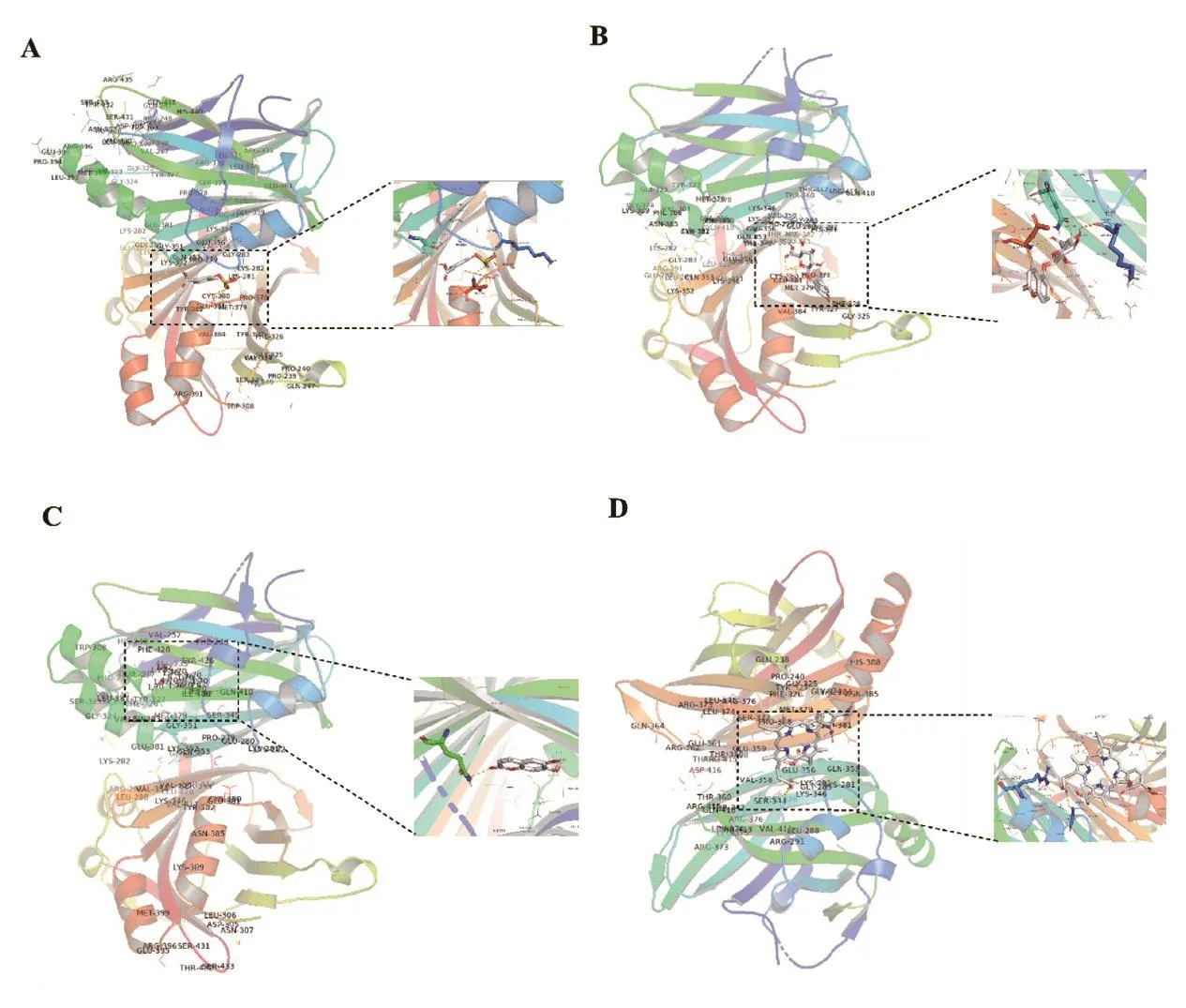
图7 瑞香狼毒活性成分与YAP1分子对接示意图Fig.7 Schematic diagram of molecular docking between the active ingredients of Stellera chamaejasme L.and YAP1
3 讨论
约50%的HCC临床标本中存在YAP1过表达且核定位的活化形式[10]。而且,YAP1作为一种基因转录共激活因子在维持肿瘤细胞的自我更新及分化中起着重要的作用[11]。YAP1的活化是肝癌发展的早期事件,YAP1过表达导致细胞增殖和集落形成能力增加[12]。沉默YAP1抑制了肝癌细胞SMMC-7721的增殖[5]。因此,YAP1是肝癌的治疗靶点。课题组前期研究发现,肝细胞特异性Yap1敲除的小鼠肝脏表面肿瘤的数量明显减少[13]。
SCL作为一种传统的中药,已经广泛应用于我国北部和西南部的许多地区。主要应用于癌症、皮肤病、支气管炎以及结核病的治疗[14]。本研究发现,低浓度SCL含药血清在体外能抑制肝癌细胞HepG2215生长活性,体内能抑制小鼠肝肿瘤的增殖;同时,对正常肝细胞的生长活性无明显抑制作用。相似的研究也显示,SCL提取物能逆转TGF-β诱导的HepG2间充质形态,调节标记蛋白的表达,显著抑制TGF-β诱导的肝癌HepG2细胞迁移和侵袭[15]。而且,SCL提取物提高了H22细胞体外移植小鼠肿瘤抑制率,且没有明显的毒副作用[16]。
现有资料未阐明SCL抑制肿瘤增殖的活性成分。本研究利用LC-MS进一步阐释了SCL抑制肝癌细胞增殖的成分,明确了SCL水煎液和SCL含药血清中均含有3-硫酸咖啡酸、5-苄恶唑-2-酮、3,4,5-三羟基-6-[(2-氧代-2H-铬-5-基)氧]氧烷-2-羧酸和异东莨菪内酯4种有效成分。同时,分子对接的结果也证实,3-硫酸咖啡酸、3,4,5-三羟基-6-[(2-氧代-2H-铬-5-基)氧]氧烷-2-羧酸和异东莨菪内酯这3种主要成份能与YAP1蛋白形成氢键,发挥直接结合YAP1的作用。因此,认为这3种成分可能是SCL水煎液在体内发挥降低YAP1表达关键成分。体外试验结果表明,异东莨菪内酯能抑制肝癌细胞HepG2、肺癌细胞A549、乳腺癌细胞MCF7[17]和结肠癌[18]的生长。体内研究也表明,SCL水提物能抑制肝脏肿瘤细胞的生长,延长肝癌原位移植瘤小鼠的生存时间[19]。
在机制方面,本研究利用肝细胞特异性Yap1敲除小鼠的肝原位荷瘤模型进一步明确了SCL抑制肝癌增殖的效应与降低YAP1表达水平有关。但是,关于SCL调控肝癌细胞YAP1表达的具体机制仍有待进一步深入探讨。
4 结论
肝脏YAP1基因异常是肝肿瘤形成的重要因素,瑞香狼毒可通过降低肝癌细胞中YAP1的表达抑制肝细胞癌增殖。其内在的作用机制可能是瑞香狼毒中的3-硫酸咖啡酸、3,4,5-三羟基-6-[(2-氧代-2H-铬-5-基)氧]氧烷-2-羧酸和异东莨菪内酯等3种瑞香狼毒活性成分直接结合YAP1有关。
文章所有附图请到本刊官网下载(http://biotech.aiijournal.com/CN/1002-5464/home.shtml)。