木犀草素对肝星状细胞活化和CCl4诱导小鼠肝纤维化的抑制作用及机制研究
刁莹,王仲娟,李敏
(苏州大学 生物医学研究院,江苏 苏州 215123)
肝纤维化是肝脏组织周围过度沉积大量胶原蛋白和纤维粘连蛋白等细胞外基质(Extracellular matrixc,ECM)所致,多种细胞及分子均参与纤维化的进程[1].其中,肝星状细胞(Hepatic Stellate Cell,HSC)的激活是肝纤维化发展中的一个重要过程[2].肝损伤会诱导HSC活化,导致其基因表达的改变,引起细胞增殖和迁移,同时HSC可转化为表达大量a-平滑肌肌动蛋白(Smooth Muscle-alpha,α-SMA)的肌成纤维细胞,产生大量的胶原蛋白和其他ECM分子,并分泌促炎细胞因子等加重后续免疫细胞浸润进而促进纤维化发生[3-4].转化生长因子-β1(Transforming Growth Factor-β1,TGF-β1)是转化生长因子家族的一员,这个家族的细胞因子对于细胞分化、增殖、凋亡和迁移有着广泛的影响,也是一种重要的促纤维化信号因子,参与包括肝脏在内的多种器官的纤维化形成的启动和维持.TGF-β1特异性细胞表面受体具有丝氨酸/苏氨酸激酶活性,Smad家族的转录因子是TGF-β1受体激酶的直接底物,TGF-β1受体复合物被激活后,可诱导多个Smads蛋白的磷酸化[5],因此寻找新的靶向TGF-β1/Smad通路天然化合物是当前开发抗纤维化药物的有效途径之一.
木犀草素(Luteolin),全称3,4,5,7-四羟基黄酮,是一种常见的黄酮类化合物,存在于多种植物中如药草、水果和蔬菜[6].富含木犀草素的植物在中国传统医学记载中认为可用于治疗多种疾病,如炎症性疾病、癌症和高血压[7].现有研究显示木犀草素除抗炎及抗癌活性外,也具有一定的抗氧化及自由基清除能力[8-10].同时有临床应用研究也表明含有木犀草素和浓缩木犀草素提取液未发生显著不良反应[11].目前有大量研究表明木犀草素对多种纤维化疾病,如肾脏、肺脏及肝纤维化均有保护作用,但其深入的分子调控机制值得探讨.本实验体外采用LX-2细胞为研究对象,体内使用CCl4诱导的小鼠肝纤维化模型,进一步明确木犀草素对肝纤维化的保护作用,并探讨其对于LX-2中TGF-β1/Smad信号通路的影响并寻找其抗肝纤维化的其他可能调控机制,为木犀草素的临床应用提供部分科学依据.
1 材料与方法
1.1 材料
LX-2人肝星状细胞系,由本实验室保存.木犀草素购自上海源叶生物科技有限公司,蛋白定量试剂盒、SDS凝胶试剂盒、细胞裂解液、购自弗德生物科技有限公司.蛋白酶抑制剂购自罗氏试剂生物有限公司,TGF-β购自Peprotech.体积分数4%多聚甲醛、DMEM培养液、胎牛血清、胰蛋白酶消化液和青链霉素购自美国HyClone,Collagen I、α-SMA、Smad2、p-Smad2、β-Actin和GADPH相关抗体均购自美国Cell Signaling Technology公司.
1.2 方法
1.2.1CCK-8增殖与细胞划痕实验
将LX-2细胞以每孔2×104个接种于96孔板中,或以每孔4×105个接种于6孔板中,同时将细胞分为4组,分别为对照组、TGF-β1(10 μg/L)刺激组,TGF-β1(10 μg/L)与木犀草素处理组(12.5、25 μmol/L),待细胞密度达80%左右,加入这些药物处理48 h后以每孔20 μL CCK-8试剂加入96孔板,检测OD450值;或用200 μL无菌枪头在药物处理之前于6孔板中均匀画横线,48 h后,对划痕进行显微镜拍照.
1.2.2逆转录、荧光定量PCR与Western blot检测
将LX-2细胞以每孔4×105个接种于6孔板中,同时将细胞分为4组,分别为对照组、TGF-β1(10 μg/L)刺激组,TGF-β1(10 μg/L)与木犀草素处理组(12.5、25 μmol/L),待细胞密度达80%左右,加入这些药物处理24 h.Trizol法提取总RNA,按照逆转录试剂盒对总RNA进行逆转录处理.逆转录程序为:1)37 ℃,15 min;2)85 ℃,5 s.按荧光定量PCR试剂盒进行操作.荧光定量PCR反应条件为:1)95 ℃,2 min;2)95 ℃,5s;3)60 ℃,34s;40个循环.引物序列如下,CollagenⅠ:Forward 5′-ATTTTTCTGDCGACACCCGAT-3′,Reverse 5′-TCCCAGGTGTAGACCAA-3′;α-SMA:Forward 5′-ATTTTTGCCCGATACCCGAT-3′,Reverse 5′-TGACCGTCATAGACCAA-3′;β-Actin:Forward 5′-ATTTTTGTACACACAATGC-3′,Reverse 5′-TGACCGGTGTCCCTGACGAT-3′.
将LX-2细胞以每孔4×105个接种于6孔板中,分组同前,药物处理24 h后加入RIPA裂解液(含有体积分数1%蛋白酶抑制剂)冰上裂解30 min,高速离心机4 ℃,12 000 r/min离心15 min后吸取上层蛋白.蛋白定量完成后加上样缓冲液,沸水煮10 min.电泳结束后进行转膜,随后用脱脂牛奶进行封闭,PBST清洗,均为1∶1 000体积稀释一抗(collgenI、α-SMA、Smad2、P-Smad2、β-Actin、GAPDH),4 ℃过夜.第2天用冷PBS清洗条带3次,二抗孵育1 h,化学发光仪发光拍照.
1.2.3CCl4小鼠肝纤维化模型与天狼猩红染色
C57小鼠分组,分为PBS组和木犀草素治疗组,每组6只.CCl4和橄榄油(2∶3)按比例混匀,每周2次腹腔注射,每只小鼠注射100 μL,注射剂量3 mL/kg,连续注射6周.CCl4注射4周后,木犀草素组灌胃给药100 mg/kg,每周3次给药,连续给药2周.2周后处死所有小鼠,取小鼠肝脏并固定在体积分数4%多聚甲醛中.
中性甲醛液固定组织,石蜡切片,常规脱蜡至水.天狼猩红染色50 min.蒸馏水洗3次.梯度乙醇脱水.二甲苯透明,中性树胶封固.染色的结果胶原呈红色.
1.2.4质谱样本处理与检测
将LX-2细胞以每孔4×105个接种于6孔板中,分为TGF-β1(10 μg/L)刺激组,TGF-β1(10 μg/L)与木犀草素(25 μmol/L)处理组,给药处理24 h,将处理好的LX-2细胞进行收集,用预冷的PBS洗涤2遍.细胞中加入含8 mol/L尿素、1%蛋白酶抑制剂的裂解缓冲液进行超声裂解,离心取上清.向蛋白质溶液中加入终浓度为5 mmol/L的DTT,60 ℃条件下孵育30 min进行还原.加入15 mmol/L的IAA烷基化.然后向上述体系中加入25 mmol/L的NH4HCO3溶液置换出尿素.将胰蛋白酶和蛋白按1∶50的质量比加入胰酶,37 ℃酶切过夜.将10%TFA加入消化后的样本中终止消化,BCA测蛋白浓度.将该样品溶液过C18除盐小柱后收集滤液,在离心浓缩仪中常温旋干.
除盐纯化后的多肽样品通过Orbitrap Fusion Lumos三合一质谱仪进行检测.设置质谱检测分析条件:阳离子采集模式;一级质谱扫描分辨率为60 000;高能碰撞解离(HCD)设置为15;二级质谱碰撞能量为30%.自动采集各多肽信息,获得其二级谱图.
1.2.5数据分析
将UniProt人源蛋白质数据库导入Proteome Discoverer 2.2(Thermo Fisher)软件中,将MS/MS图谱数据输入数据库进行检索,检索方法参考文献[13],基于Label Free定量(LFQ)在软件中表示为肽量化蛋白质丰度,将木犀草素组与对照组均值之比≤0.5且P<0.05定义为蛋白表达量下调.所有数据均经GraphPad Prism 9软件统计分析,组间比较用t检验.
2 结 果
2.1 木犀草素显著抑制LX-2细胞的增殖
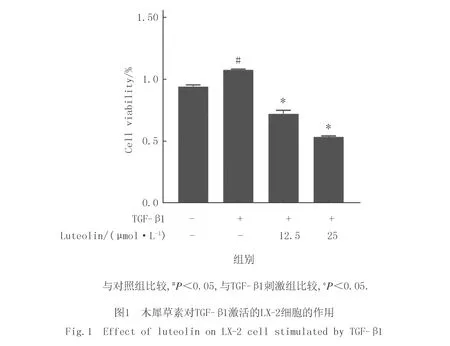
为了验证木犀草素是否能影响肝星形细胞的增殖,选择人肝星形细胞系LX-2作为研究对象,其具有肝星状细胞的典型特点.CCK8实验结果显示(图1):与未处理的对照组相比,10 μg/L TGF-β1处理可促进LX-2细胞增殖(P<0.05);而木犀草素可显著抑制LX-2的增殖(P<0.05),且这种抑制作用具有剂量依赖性.
2.2 木犀草素可明显抑制LX-2细胞迁移
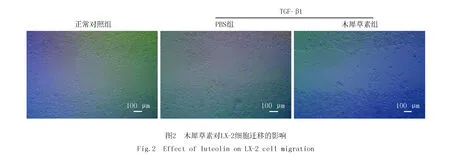
图2所示,木犀草素处理可显著抑制LX-2的迁移,这提示木犀草素可通过影响LX-2迁移修复能力从而抑制纤维化进程.
2.3 木犀草素可明显抑制α-SMA、Collagen I的mRNA水平表达
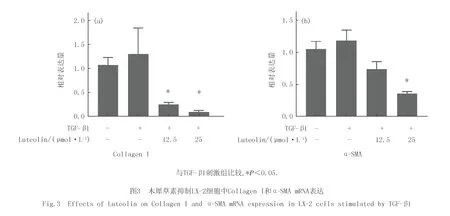
LX-2细胞活化后会明显增加α-SMA及胶原的生成量,从而促进纤维化.为研究木犀草素对LX-2的活化有无影响,在TGF-β1刺激的条件下给予木犀草素处理LX-2细胞,提取细胞RNA,逆转录及荧光定量PCR检测相关基因的表达.结果如图3所示,木犀草素处理可在mRNA水平下调LX-2细胞Collagen I和a-SMA表达.
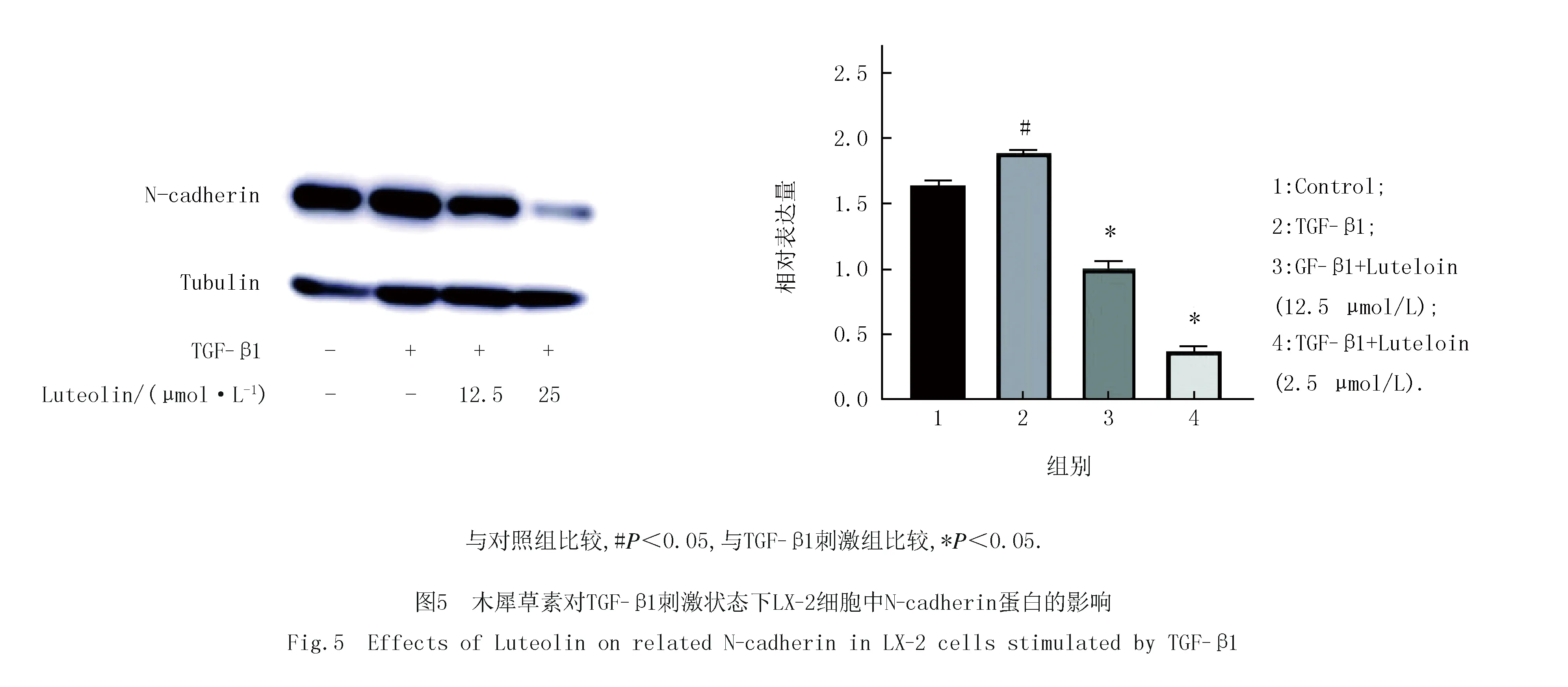
2.4 木犀草素可抑制LX-2细胞N-cadherin、Collagen I、α-SMA蛋白表达及Smad2磷酸化
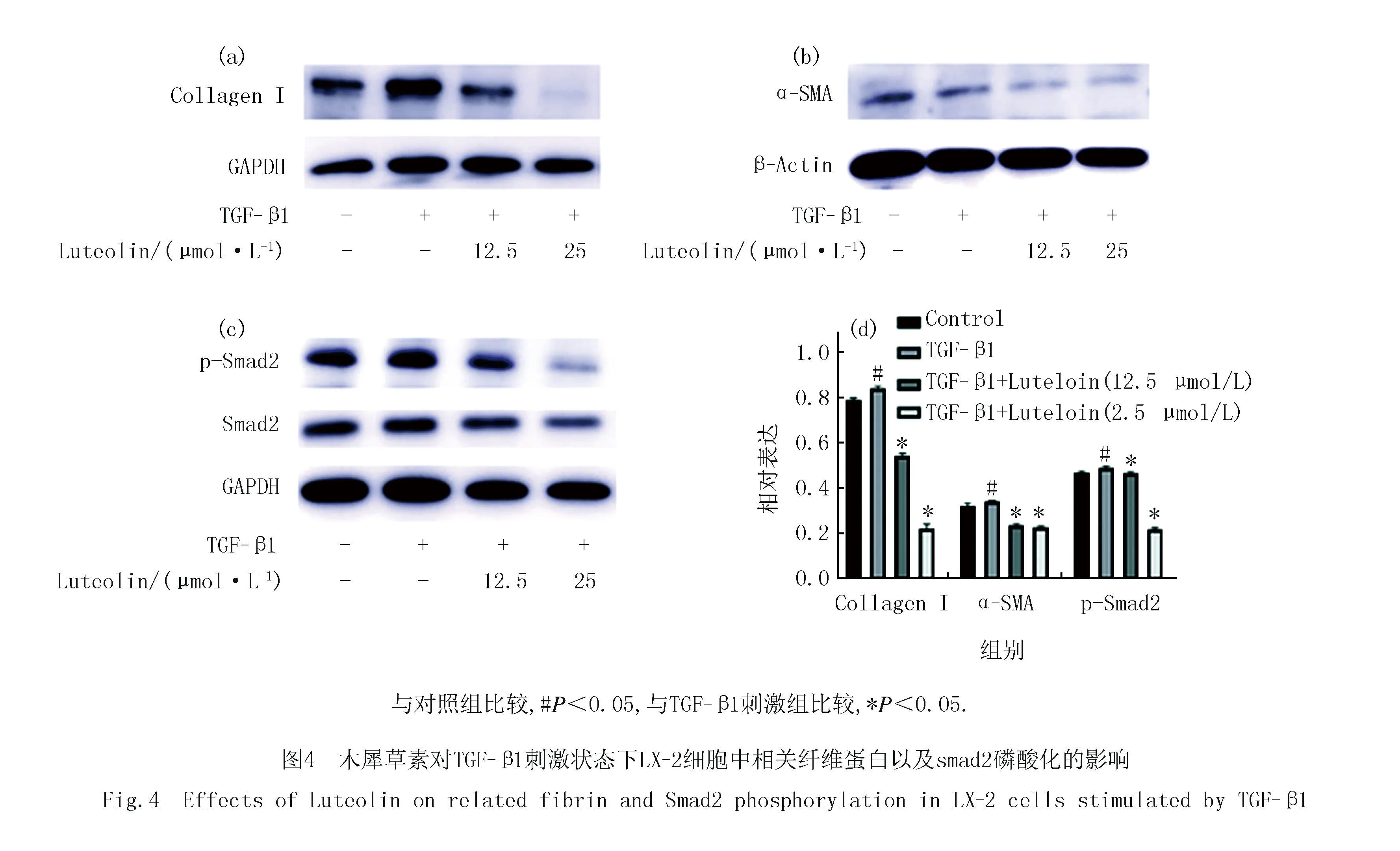
接下来为了进一步明确木犀草素对LX-2细胞转分化以及释放ECM等的影响,在蛋白水平上验证了其对相关指标的影响.如图4(a,b)所示,与mRNA结果变化一致,木犀草素可明显抑制Collagen I和a-SMA的蛋白表达,且具有剂量依赖性.考虑到Smads的磷酸化是TGF-下游激活的重要标志,我们检测了木犀草素对Smads磷酸化的影响.结果如图4(c,d)所示,木犀草素显著抑制了Smad2 Ser-465/467位点的磷酸化水平,这表明木犀草素很有可能是通过抑制TGF-β1/Smads信号通路来抑制LX-2的活化.此外,验证了木犀草素对上皮转分化的重要标志物N-cadherin的表达影响,结果如图5所示,木犀草素可明显抑制N-cadherin的表达,这提示木犀草素也可通过抑制上皮转分化来抑制细胞侵袭等来影响纤维化.
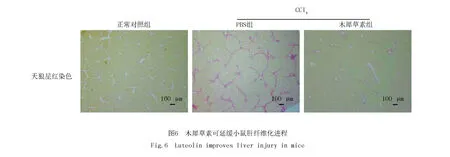
2.5 木犀草素可明显延缓CCl4诱导的小鼠肝纤维肝组织的进程
使用CCl4诱导小鼠肝纤维化模型,进一步在体内明确木犀草素对肝纤维化的保护作用.如图6所示,天狼猩红染色显示正常组小鼠的肝小叶结构正常,仅在汇管区和中央静脉有少量胶原纤维;CCl4建模组小鼠的肝组织中胶原纤维沉积,形成一个连续的网状结构,浸润肝实质,失去正常的小叶结构,可见明显染色成红色的纤维间隔;在CCl4建模4周后,给予木犀草素处理2周,明显减少了小鼠肝组织的胶原纤维沉积,维持肝小叶结构完整,提示木犀草素显著延缓了CCl4诱导的小鼠肝纤维化进程.
2.6 木犀草素对下调差异表达蛋白的GO注释分析及KEGG通路分析
用Orbitrap Fusion Lumos三合一超高分辨质谱仪分析了木犀草素处理组与PBS处理组LX-2细胞所表达的蛋白差异,结果显示两组细胞中共鉴定出3 511个蛋白,其中有81个蛋白表达下调.GO分析结果显示,下调差异蛋白主要参与线粒体电子传递、氧化磷酸化、受体介导的内吞作用的调节、血管生成和形态发生、ATP代谢过程、细胞骨架组织的调节等生物学过程;差异蛋白主要定位在基膜、线粒体膜间隙、高尔基体、胞质囊腔和细胞外基质等细胞器上;在分子功能方面,差异蛋白主要涉及氧化还原驱动活性跨膜转运蛋白活性、电子转移激活、细胞外基质结构成分、激活结构分子等活性(附图Ⅰ).
通过KEGG数据库对下调差异表达蛋白进行通路富集分析,发现木犀草素处理组的差异蛋白主要涉及其中66条信号通路,包含Metabolic、ECM-receptor interaction、PI3K-Akt、Oxidative phosphorylation、AGE-RAGE、mTOR等信号通路(附图Ⅱ).
3 讨 论
肝纤维化是由病毒、酒精、自身免疫等多种原因引起肝细胞发生炎症坏死,从而导致肝星状细胞激活转化、细胞外基质的合成增加与降解减少而大量沉积在细胞间质中形成的.有研究证明肝纤维化及肝硬化早期是可逆转的,但后期进展为肝硬化终末期则不可逆转,甚至可能发展为肝癌[14].肝纤维化是慢性肝病的重要环节,严重威胁人类的健康,因而不断寻找有效阻断甚至逆转肝纤维化的治疗方法迫在眉睫.肝纤维化发病机制的相关研究显示肝星状细胞的激活与转化在肝脏纤维化中起着关键作用.而转化生长因子TGF-β1,在肝脏纤维化形成的过程中起着非常重要的作用,其中TGF-β1/Smad信号通路则被认为是刺激HSC活化、增殖的关键信号通路[15].因此,抑制TGF-β1信号通路是一种很有前景的抗纤维化方法.
木犀草素具有较强的抗氧化能力,自由基清除能力,抗炎作用和抗癌活性,但其抗纤维化作用及机制还未明确阐明[12,16],但本研究认为木犀草素作为一个天然化合物,很可能还存在影响其他通路的分子机制.本研究表明木犀草素可以有效抑制TGF-β1诱导的LX-2细胞的活化及CCl4诱导的小鼠肝纤维化.实验结果显示木犀草素可以抑制TGF-β1诱导后LX-2细胞的增殖,并抑制TGF-β1诱导后EMC成分CollagenI及α-SMA的mRNA和蛋白水平的表达,通过western blot显示木犀草素抑制Smad2的ser465/467磷酸化位点的表达.天狼猩红染色结果显示木犀草素可以显著改善CCl4诱导的肝组织学变化.说明木犀草素可以抑制TGF-β1诱导的LX-2的TGF-β1/Smad信号通路,从而抑制其纤维化水平.为进一步探讨木犀草素参与肝纤维化的机制,本研究采用Orbitrap Fusion Lumos三合一超高分辨质谱仪对两组细胞蛋白进行了分析,共鉴定出3 511个蛋白,其中有81个蛋白表达下调.差异表达的蛋白对抑制细胞纤维化无疑起到重要的作用.GO注释和KEGG信号富集分析在生物信息学应用中有重要的作用[17].GO注释表明下调差异蛋白主要参与线粒体电子传递、氧化磷酸化、受体介导的内吞作用的调节、血管生成和形态发生、ATP代谢过程、细胞骨架组织的调节等生物学过程.KEGG通路分析下调差异蛋白主要参与了代谢途径、多种神经疾病、ECM与细胞的相互作用、氧化磷酸化、内吞作用、PI3K-Akt、mTOR等信号通路.
综上所述,本研究进一步明确了木犀草素对小鼠肝纤维化的保护作用,验证了其可能通过木犀草素TGF-β1/smad2信号通路从而影响肝星形细胞活化释放ECM以及抑制迁移、转分化等几个方面来肝纤维化.此外,通过质谱组学分析提示木犀草素很可能还通过影响代谢等多种通路调节肝纤维化,而阐明其中可能的机制对木犀草素的临床应用具有重要的指导意义.
作者贡献:刁莹和王仲娟为共同第一作者.
附 录
附图Ⅰ、Ⅱ见电子版(DOI:10.16366/j.cnki.1000-2367.2023.05.016).

