脓毒症患者肠道菌群生态特征与血清D-乳酸、sTREM1和MCP-1表达水平的相关性研究
陈 婕,张红梅,谭春艳(遂宁市中心医院检验科,四川遂宁 629000)
人体肠道内存在着大量的细菌,在生理状态下,肠道菌群存在“自我稳态”,维持着人体的健康。依据自然属性分类,人类肠道菌群已经鉴定出细菌的几十个门,其中主要的肠道菌可以归属为拟杆菌门、厚壁菌门、变形菌门和放线菌门[1]。在危重疾病状态下已经抗生素的使用,肠道稳态被打破,导致肠道菌群在种类、数量、比例、定位等多个方面发生改变。脓毒症是重症监护室(intensive care unit,ICU)中最常见的疾病,是机体对感染反应失调所引起器官功能障碍[2]。脓毒症的发病机制尚不清楚,有研究显示,肠道菌群紊乱可能是导致脓毒症发生及发展的重要因素[3]。然而,目前关于脓毒症患者肠道菌群紊乱的特点尚未研究清楚。D-乳酸主要来源于人体丙酮醛代谢,当肠道屏障功能受损时,D-乳酸将被大量释放至外周血,是提示肠道屏障功能受损的常见标志物[4]。可溶性髓样细胞触发性受体(soluble triggering receptor expressed on myeloid cells-1,sTREM1)是新型的炎症标志物,单核细胞趋化蛋白(monocyte chemoattractant protein-1,MCP-1)属于趋化因子家族,在细胞浸润及迁移中发挥重要作用[5]。目前关于肠道菌群紊乱与肠道屏障破坏、炎症反应之间是否存在联系仍未可知。本研究旨在通过分析脓毒症患者肠道菌群生态特征及其与血清D-乳酸、sTREM1 及MCP-1之间的关系,对脓毒症可能的致病机制进行探讨,现将结果报道如下。
1 材料与方法
1.1 研究对象 行前瞻性研究,将遂宁市中心医院2019.06~2022.06 间接收的46 例脓毒症患者纳为脓毒症组,同期45 例入住ICU 但无脓毒症者纳为非脓毒症组,50 例健康志愿者纳为对照组。纳入标准:①所有被研究者年龄18~45 岁;②脓毒症患者符合Sepsis3.0 中相关诊断标准;③脓毒症及非脓毒症患者入住ICU 时间≥2 天。排除标准:①并发肛周感染者及肠造瘘者;②并发慢性胃肠道疾病者;③既往有消化道疾病及手术史者;④入组前三个月前服用益生菌制剂、肠道营养制剂者。本研究经医院伦理委员会批准,参与者均知情且签署同意书。病例资料:脓毒症组中男性26 例,女性20例,体质量指数(body mass index,BMI) 20~26(23.69±3.15)kg/m2,年龄26~44(36.69±4.15)岁;原发病:呼吸系统疾病20 例,心血管疾病17例,神经系统疾病5 例,其他4 例。非脓毒症组中男性27 例,女性18 例,BMI 20~25(24.15±3.41)kg/m2,年龄25~45(37.85±3.79)岁;原发病:呼吸系统疾病21 例,心血管疾病15 例,神经系统疾6 例,其他3 例。对照组中男性28 例,女性22 例,BMI 19~26(24.63±3.58)kg/m2,年龄26~44(36.94±4.43)岁,两组一般资料比较,差异无统计学意义(χ2/F=0.179,0.372,0.920,0.990,均P>0.05)。
1.2 仪器与试剂 HiSeq2500 PE250(Illumina公司,美国),全自动生化分析仪(上海科华实验系统有限公司,型号:卓越480),sTREM-1 试剂盒(武汉菲恩生物科技有限公司);MCP-1 试剂盒(美国R&D 公司)。
1.3 方法
1.3.1 肠道菌群分析:①粪便标本采集:脓毒症组及非脓毒症组粪便标本采集时间为入住ICU 后第一天,患者自主排便或灌肠后,使用采样勺将患者新鲜粪便深处取材,取材后将标本迅速放置标本盒内送检。对照组则于入组后采集新鲜粪便标本。②肠道菌群检测:16S rRNA 基因序列分析技术检测被研究者肠道菌群情况。⑴提取粪便样本总DNA:以CTAB 法提取样本DNA,琼脂凝胶电泳法检测DNA 浓度与纯度。⑵PCR 扩增及产物纯化:以稀释后DNA 为模板,行优势菌16S rRNA 基因V3,V4 可变区的PCR 扩增,2g/dl 琼脂凝胶电泳纯化PCR 产物。⑶使用Thermofisher 公司的Ion Plus Fragment Libraey Kit 48 rxns 制备文库,行Qubit 定量检测。⑷IonS5TMXL 上机测序,将一致性达97%的序列聚类归并和可操作分类单元(operational taxonomic units,OTUs),与Silva 的SSUrRNA 数据库对比,进行样本复杂度及多样性比较,计算Chaol 指数、Shannon 指数、Simpaon 指数和ACE指数,TaxFun 软件进行给予KEGG 数据库的菌群功能预测。
1.3.2 血清D- 乳酸、sTREM1 及MCP-1 水平检测:①血压标本采集:分别于脓毒症及非脓毒症患者入住ICU 后第一天,及对照组入组后当天,采集其外周静脉血5ml,3 000r/min 快速离心15min,分离上层血清,置于-80℃冰箱内待用。②采用德国罗氏全自动分析仪及其配套试剂检测血清D-乳酸水平,D-乳酸的正常值范围为0.1~1.0mmol/L;酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)法检测血清sTREM-1 和MCP-1 水平,具体操作严格按照试剂说明进行。
1.4 统计学分析 采用SPSS19.0 统计软件处理数据。计量资料以均数±标准差(±s)表示,多组间比较采用单方差分析,检验有意义者,组内比较采用LSD-t检验,计数资料用例表示,组间比较采用χ2检验,相关性分析采用Spearman 相关分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 三组肠道菌群Alpha 多样性指数分析 见表1。三组肠道菌群ACE 指数比较,差异无统计学意义(P>0.05);三组Chaol,Shannon 及Simpaon 指数比较,差异均有统计学意义(均P<0.05),其中脓毒症组患者Chaol,Shannon 及Simpaon 指数均低于非脓毒症组(t=8.733,2.234,2.811,均P<0.05)与对照组(t=12.360,2.911,3.311,均P<0.05),非脓毒血症组低于对照组(t=1.584,0.894,0.113,均P<0.05),差异具有统计学意义。
表1 三组肠道菌群Alpha 多样性指数分析(±s)
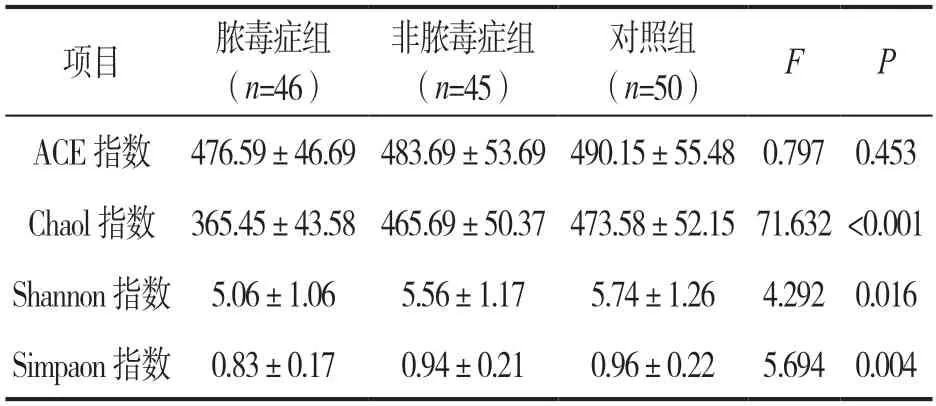
表1 三组肠道菌群Alpha 多样性指数分析(±s)
项目脓毒症组(n=46)非脓毒症组(n=45)对照组(n=50)FP ACE 指数 476.59±46.69 483.69±53.69 490.15±55.48 0.797 0.453 Chaol 指数 365.45±43.58 465.69±50.37 473.58±52.15 71.632<0.001 Shannon 指数 5.06±1.065.56±1.175.74±1.26 4.292 0.016 Simpaon 指数 0.83±0.170.94±0.210.96±0.22 5.694 0.004
2.2 三组肠道菌群菌门水平种类成分分析 见表2。对样本OTU 聚类分析后发现,在门水平上,脓毒症组、非脓毒症组及对照组患者肠道微生物主要分为拟杆菌门、厚壁菌门、放线菌门、变形菌门及梭杆菌门5 类。对样本OTU 聚类分析后发现,非脓毒症组与对照组患者肠道微生态中拟杆菌门+厚壁菌门占比均超过90%,脓毒症组拟杆菌门+厚壁菌门占比低于其余两组,变形菌门占比高于其余两组,差异具有统计学意义(均P<0.05)。脓毒症组拟杆菌门+厚壁菌门、变形菌门与非脓毒症组、对照组相比,差异均有统计学意义(χ2=4.558,3. 984;4.623,4.058,均P<0.05)。
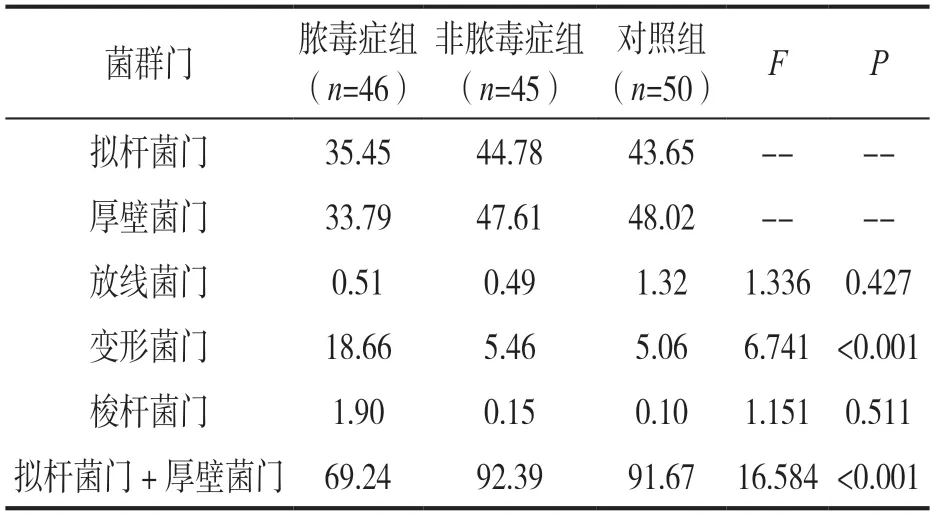
表2 三组肠道菌群菌门水平种类成分分析(%)
2.3 三组血清D 乳酸、sTREM1,MCP 1 水平比较 见表3。脓毒症组、非脓毒症组及对照组间血清D-乳酸、sTREM1 及MCP-1 水平呈依次下降趋势,差异有统计学意义(均P<0.05),其中,与脓毒症组比较,非脓毒症组和对照组三项水平显著降低(t=28.577,27.435,15.716; 21.417,38.888,22.411,均P<0.05),与非脓毒症组比较,对照组三项水平降低(t=5.576,5.662,4.987,均P<0.05),差异均有统计学意义。
表3 三组血清D-乳酸、sTREM1,MCP-1 水平比较(±s)

表3 三组血清D-乳酸、sTREM1,MCP-1 水平比较(±s)
项目脓毒症组(n=46)非脓毒症组(n=45)对照组(n=50)FP D-乳(mmol/L) 4.26±0.85 0.69±0.16 0.53±0.12 822.762<0.001 sTREM1(ng/ml) 183.16±23.26 60.15±19.48 42.48±10.34 806.300<0.001 MCP-1(ng/ml) 563.15±63.69365.73±55.78 311.42±51.74 311.42<0.001
2.4 脓毒症患者血清D-乳酸、sTREM1,MCP 1 水平与其肠道菌群之间的关系 见表4。相关性分析提示,脓毒症组患者肠道内拟杆菌门及厚壁菌门与其血清D-乳酸、sTREM1,MCP-1 水平均呈负相关,变形菌门与其血清D-乳酸、sTREM1,MCP-1水平均呈正相关。

表4 脓毒症患者血清D-乳酸、sTREM1,MCP-1水平与其肠道菌群之间的关系
3 讨论
在ICU 中,脓毒症是宿主对感染所做出的一系列反应,最常见的致死性临床综合征,其致死率可高达50%,严重威胁患者生命健康。探究脓毒症发病原因及致病机制,是有效控制病情,改善患者预后的重要前提[6-7]。在脓毒症3.0 中强调,脓毒症与器官功能障碍密切相关,作为肠道内重要的组成部分,肠道菌群与脓毒症之间的关系逐渐得到重视[8-9]。但在脓毒症中,肠道菌群紊乱的特点还尚未研究清楚。
本研究利用16S rRNA 技术对脓毒症患者粪便菌群进行分析,结果提示,与健康对照组及ICU 非脓毒症患者一样,脓毒症患者粪便中的主要菌门均为拟杆菌门及厚壁菌门,但对照组及非脓毒症组患者粪便内拟杆菌门+厚壁菌门占比均超过90%,而脓毒症组患者两菌门占比总和明显降低,且变形菌门占比明显增加,说明脓毒症患者肠道中优势专性厌氧菌丰富下降,兼性厌氧菌丰度升高,有益共生菌含量下降,致病菌含量增多。此外,脓毒症患者肠道菌群Alpha 多样性指数Chaol,Shannon 及Simpaon 指数均较非脓毒症组及对照组降低,提示脓毒症患者肠道菌群多样性下降。以上研究表示,脓毒症患者存在明显的肠道菌群失衡表现。这可能与脓毒症患者在病理状况下,肠道环境及肠黏膜血供改变,破坏肠道菌群生长环境,且脓毒症患者在治疗过程中接触的内源性调节剂等因素相关。
另一方面,肠道屏障功能障碍也是肠道微生态异常的表现之一,其可为肠道菌群和内毒素的异位提供条件,也是诱导脓毒症的重要原因之一。前期研究表明外周血D-乳酸水平也是肠道屏障功能障碍的标志之一。本研究发现脓毒症患者血清D-乳酸水平明显高于非脓毒症组及对照组,提示其出现肠道屏障功能障碍。且D-乳酸水平与其肠道拟杆菌门、厚壁菌门水平呈负相关,与变形菌门水平呈正相关。D-乳酸是丙酮醛代谢物,主要来源于丙酮醛代谢,正常条件下,D-乳酸在血液中含量很少,但当肠道屏障出现障碍时,血液中D-乳酸水平将急骤上升,进而引起D-乳酸中毒[10]。脓毒症患者常伴有低血容量、组织灌溉障碍、高乳酸血症甚至乳酸性酸中毒,故外周血D-乳酸水平升高已成为脓毒症、创伤性休克的常见诊断指标[11]。因此本研究的结果提示脓毒症患者肠道菌群失衡与肠道屏障功能障碍可能具有一定的相互作用力。
失控性炎症反应被认为是脓毒症的本质特征,作为机体对损伤性伤害的防御性反应,失控性炎症反应意味着机体自身调节能力失衡,此时激活的巨噬细胞、单核细胞及其他免疫细胞可产生级联放大反应,共同促进炎症反应的加剧,从而引发严重自身损伤。炎症相关因子在该过程中发挥着重要作用。在本研究中,我们发现脓毒症患者血清sTREM1 及MCP-1 水平高于非脓毒症组及对照组。提示脓毒症患者体内炎症反应明显。此外,相关性分析提示,脓毒症患者拟杆菌门及厚壁菌门与其血清sTREM1 及MCP-1 水平均呈负相关,与变形菌门水平呈正相关。说明脓毒症患者肠道菌群失衡,还可能与炎症反应相结合,共同参与脓毒症的发生与发展。同时,张琪等[5]研究发现,血清sTREM1及MCP-1 水平与脓毒症患者病情严重程度间呈明显正相关。这也同样辅证了我们的研究结果。目前关于sTREM1 和MCP-1 在脓毒症中的作用机制尚不清楚。有研究显示sTREM1 属于髓样细胞上的免疫球蛋白超家族,sTREM1 能选择性地表达在中性粒细胞及单核巨噬细胞上,诱导其分泌肿瘤坏死因子-α,干扰素γ 等炎性因子,触发并放大细菌与真菌所引起的级联反应,是炎症反应中重要的作用因子[12]。MCP-1 主要由单核细胞产生,可将单核细胞、中性粒细胞、T 细胞等募集至炎性病灶,参与炎症反应[13]。由此可知,脓毒症可能使肠道菌群失衡,加重机体的免疫调节负担,促进炎症相关性反应的发生。
综上所述,脓毒症患者肠道菌群多样性下降,肠道内拟杆菌门与厚壁菌门占比下降,变形菌门占比上升,且肠道菌群失衡可能联合肠道屏障障碍与炎症反应,共同参与脓毒症的发生。但本文所纳入的研究样本量过小,且未研究肠道菌群紊乱对脓毒症患者预后的影响,也并未分析改善肠道菌群在脓毒症中的应用价值,以上研究结果仅表明脓毒症肠道菌群多样性下降,且与肠道屏蔽障碍及炎症反应相关,可为脓毒症的治疗研究提供新思路。
- 现代检验医学杂志的其它文章
- 急性肺栓塞患者血清ADAM15和MMP-2表达水平及其与疾病严重程度的相关性研究
- 肺炎支原体感染诱发哮喘患儿血清中miR-424-5p和CX3CL1表达水平及与预后预测价值研究
- ALKBH5调控GEFT的m6A修饰对胆管癌转移及EMT的实验研究
- LncRNA NNT-AS1通过调控miR-582-5p/NCKAP1轴激活Hippo-YAP/TAZ信号通路促进膀胱癌细胞增殖、迁移、侵袭和干细胞干性影响
- 血浆外泌体miR-4306表达水平联合CT征象对单发非实性肺结节良恶性鉴别的价值研究
- 白细胞介素-1β基因(rs16944)单核苷酸多态性与骨髓增生异常综合征易感性及临床特征的相关性研究

